USA Pharm. 2010;35(5):36-41.
ett samband mellan diabetes mellitus (dm) och demens är obestridligt, med många studier som visar att DM ökar risken för kognitiv nedgång och demens, inklusive Alzheimers sjukdom (AD).1-5 ökar inte bara risken för demens, det ökar faktiskt graden av demensutveckling två-till trefaldig.,3 mekanismen för denna försämring är inte fullständigt förstådd, men det är hypotetiskt att hyperglykemi, insulinresistens, oxidativ stress, avancerade glykationslutprodukter och inflammatoriska cytokiner tillsammans leder till kognitiv dysfunktion.5 i själva verket beskrevs diabetes som en ”speciell typ av accelererad åldrande” 1976 på grund av dess många associerade komplikationer.,5 den uppenbara överlappningen mellan dm och demens har lett till förslaget att AD inte bara är en neurologisk sjukdom, utan snarare en neuroendokrin störning, med Steen et al coining termen typ 3-diabetes för att beskriva denna hybridsjukdom.,6
översikt över insulinresistens/nedsatt glukostolerans
patofysiologi: både nedsatt glukostolerans—definierad som en plasmaglukos på 140 mg/dL till 199 mg / dL efter ett oralt glukostoleranstest-och nedsatt fasteglukos-definierad som en fasteglukos på 100 mg / dL till 125 mg / dL-är diagnostik av prediabetes (prekursor till typ 2 DM ), liksom ett hemoglobin A1C på 5, 7% till 6, 4%.7 prediabetes patofysiologi är densamma som för T2DM, som diagnostiseras efter en fasteblodglukos på 126 mg/dL eller mer eller en A1C på 6.,5% eller mer (testet upprepas för bekräftelse).7 under båda betingelserna utvecklas insulinresistens i perifera vävnader, där insulin krävs för glukosupptag (nämligen muskel, lever och fett), och bukspottkörteln tvingas leverera allt mer insulin för att övervinna detta motstånd.8 i detta skede är patienter ofta hyperinsulinemiska; men med tiden kan bukspottkörteln inte uppfylla kraven i vävnaderna, och de insulinproducerande betacellerna i bukspottkörteln misslyckas långsamt och producerar allt mindre insulin.,8 utan tillräckligt med insulin ökar blodglukoskoncentrationerna, vilket leder till prediabetes och hos upp till 70% av patienterna med prediabetes, T2DM.9 komplikationerna av hyperglykemi är många och omfattar en ökad risk för makrovaskulära komplikationer (inklusive hjärtinfarkt, cerebrovaskulär olycka och perifer vaskulär sjukdom) och mikrovaskulära komplikationer (inklusive nefropati, neuropati och retinopati).7
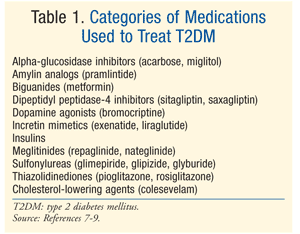
behandling: det finns många behandlingar för behandling av DM., Den initiala behandlingen för både prediabetes och T2DM är livsstilsförändring som involverar kost, motion och viktminskning.7 American Diabetes Association (ADA) rekommenderar också hänsyn till metformin hos patienter med prediabetes som löper hög risk för att utveckla diabetes.Metformin rekommenderas som initial farmakologisk behandling för T2DM.7 ofta behövs ytterligare farmakologisk terapi för att uppnå ada-glykemiska mål, inklusive en A1C <7%.,7 Det finns många klasser av läkemedel för T2DM (tabell 1), och valet av medel för att normalisera blodglukos beror på en mängd patient – och läkemedelsspecifika faktorer. Det är viktigt att notera att många patienter med T2DM så småningom kommer att kräva exogent insulin för att uppnå och bibehålla euglycemia eftersom beta-cellfunktionen gradvis minskar.
översikt över AD
patofysiologi: AD är den vanligaste formen av demens hos äldre vuxna, står för 60% till 80% av alla fall.,10 två histopatologiska kännetecken för AD är neuritiska plack och neurofibrillära trassel.11 plack består av olösligt beta-amyloidprotein. Tangles, som är intracellulära, består av fosforylerat tau-protein. Tau-protein är viktigt för mikrotubulmontering, och när detta protein är onormalt fosforylerat avbryts neuronal funktion. Neurofibrillära trassel påverkar oftast kolinerga neuroner.12 dessutom bidrar störningar av den huvudsakliga excitatoriska neurotransmittorn, glutamat, till AD-patologin., I AD finns en överaktivering av glutamat, som signalerar en process som kallas excitotoxicitet, vilket leder till plackbildning, hyperfosforylering av tau-protein och celldöd.12 Sammanfattningsvis stör excitotoxicitet och bildandet av neuritiska plack och neurofibrillära trassel neurotransmittorvägar, vilket resulterar i inlärnings-och minnesförlust i samband med AD.
behandling: tillgängliga FDA-godkända farmakologiska behandlingar för AD sammanfattas i tabell 2.,11,12 även om det fortfarande finns mycket att lära sig när det gäller terapier som behandlar eller förändrar patologin för AD, innebär för närvarande tillgängliga terapier användning av acetylkolinesterashämmare, av vilka det finns fyra, och N-metyl-d-aspartat-receptorantagonisten memantin.

Insulin och hjärnan
även om det är nödvändigt för glukostransport till perifera vävnader, verkar insulin inte krävas för transport av glukos i hjärnan eller för cerebral glukosmetabolism., Medan glukostransport till hjärnan inte är beroende av insulin transporteras insulin i sig över blod-hjärnbarriären (BBB) genom insulinreceptormedierade transportprocesser.13 denna transportmekanism är mätbar; vid långa perioder av överskott av insulinkoncentrationer (hyperinsulinemi) i periferin, såsom de som ses i prediabetes och T2DM, minskar denna receptormedierade transportmekanism, vilket minskar transporten av insulin i hjärnan och cerebrospinalvätskan.,
förutom insulin är insulinliknande tillväxtfaktor typ 1 (IGF-1) närvarande i hjärnan och krävs för normal tillväxt och funktion i centrala nervsystemet (CNS).14 insulin-och IGF-1-receptorer finns i hela hjärnan på neuroner och astrocyter (stjärnformade celler i CNS som hjälper till att stödja neuroner i hjärnan). Två områden i hjärnan som är avgörande för lärande och minne, hippocampus och hypotalamus, innehåller höga koncentrationer av insulinreceptorer.Hos råtta har intracerebroventrikulär insulinadministration visat sig förbättra minnet.,Dessutom har intranasal insulinadministration hos människa visat sig öka minnesprestandan.16 som tidigare noterats krävs inte insulin för cerebral glukosmetabolism; det kan emellertid finnas specifika områden i hjärnan där insulin utlöser metaboliska processer som involverar glukos. I råttstudier har insulin visat sig påverka glukosutnyttjandet i hypotalamus och locus coeruleus, två områden som är viktiga för lärande och minne.,17 inlärning har också visat sig underlätta ökat uttryck av CNS-insulinreceptorer, vilket leder till postulationen att närvaron och aktiviteten av insulin i hjärnan bidrar till och spelar en viktig roll i inlärning och minne. Insulin kan också bidra till modulering av CNS-neurotransmittorer, särskilt acetylkolin och norepinefrin, vilka båda är kritiska för normal kognition och hjärnhälsa.,18
insulinresistens och demens
Översikt: Det verkar finnas många defekter i insulinsignalering i hjärnan hos AD-patienter, vilket leder till minskat glukosutnyttjande och energimetabolism.6,19 eftersom T2DM är associerat med perifer insulinresistens är AD associerat med hjärninsulinresistens.20 tidigt i AD verkar det vara otillräckligt insulinupptag och signalering i hjärnan, ett tecken på insulinresistens.5,19,21,22 ökade insulinreceptorer har setts i hjärnan hos patienter med AD, sannolikt som kompensation för insulinresistens.,21
totalt sett har denna försämring av insulinsignaleringen många nedströms effekter i AD. En teori är att låga koncentrationer av insulin i CNS orsakar en minskning av acetylkolinnivåer och cerebralt blodflöde.13 dessutom kan förändringar i insulinkoncentrationer främja beta-amyloid-och tau-proteinbildning.2 i hjärnan är insulinnedbrytande enzym (IDE) involverat i nedbrytning och clearance av beta-amyloidproteiner.Höga halter av insulin hämmar IDE och kan leda till en minskning av beta-amyloidclearance, vilket därefter ökar hjärnans deponering av beta-amyloid.,5,19,21
nyligen ceramider, en familj av lipider, har befallt uppmärksamhet för deras potentiella roll i insulinresistens och demens.23,24 ceramider genereras i närvaro av inflammation, vilket är vanligt i fetma, T2DM och AD.Eftersom ceramid lätt passerar BBB orsakar exponeringen försämrad energimetabolism och förändringar i insulingeneuttryck, vilket bidrar till insulinresistens.23,24 detta är för närvarande ett aktivt intresseområde, med forskare som visar att hämmande ceramidsyntes förhindrade fetma-medierad insulinresistens.,Som tidigare nämnts förbättrar intranasal insulinadministration minnesprestandan hos människor.Flera studier av intranasalt insulin har utförts. Vid administrering av 20 enheter intranasalt insulin två gånger dagligen till försökspersoner fann Reger et al att, jämfört med placebo, gruppen som behandlades med insulin behöll mer verbal information och visade förbättrad uppmärksamhet och funktionsstatus.,25 dessa forskare noterade också att fastande plasmaglukos och insulin inte förändrades vid intranasal insulinanvändning, vilket indikerar att intranasal administrering ger direkt insulinåtkomst till CNS utan perifera effekter.25,26
PPAR-Gamma-agonister: i stor utsträckning studerats för behandling av perifer insulinresistens, undersöks tiazolidindioner rosiglitazon och pioglitazon för deras roll vid behandling av AD. Tiazolidindioner är peroxisomproliferator-aktiverade receptorer (PPAR)–gammaagonister., PPAR-gamma är involverad i glukos och lipidmetabolism och modulerar inflammation, en känd bidragsgivare till AD.22,27 tiazolidindioner är insulinsensibilisatorer, som arbetar för att minska insulinresistensen; de verkar också minska inflammation.21, 26 i flera placebokontrollerade studier uppvisade patienter som behandlades med rosiglitazon förbättrad minnesfunktion och kognitiv funktion.21,22,28 även om endast små studier av pioglitazon har utförts, har detta läkemedel också förknippats med förbättringar i minne och kognition.,Trots att pioglitazon och rosiglitazon har dålig BBB-permeabilitet har var och en av dessa läkemedel dokumenterats i hjärnan efter oral administrering.22 även om dessa läkemedel kan spela en roll i förebyggande eller behandling av AD, är de för närvarande inte FDA-godkända för patienter med AD, och deras potentiella fördelar och risker måste noggrant övervägas på individuell basis.
aerob träning: kanske den mest effektiva och mest förbisedda metoden för att minska insulinresistensen är fysisk aktivitet., Fetma har förknippats med en ökad risk för insulinresistens, diabetes, demens och AD.29,30 motion förbättrar insulinkänsligheten och sänker perifera insulinnivåer.26,31 fysisk aktivitet, oberoende av vikt, är förknippad med en lägre risk för AD, vilket gör den till den enda beprövade neuroprotektiva behandlingen.29-31 en möjlig mekanism för denna neuroprotektion är att motion främjar clearance av beta-amyloidproteiner och ökar hjärnderiverad neurotrofisk faktor, en tillväxtfaktor som är avgörande för kognition och neuronal överlevnad som reduceras i AD.,32
apotekarens Roll
apotekare spelar en viktig roll för att utbilda patienter om nya terapier; de måste också hålla sig à jour med nya medicinska upptäckter eller villkor som ofta presenteras i nyheterna. Typ 3-diabetes är ett sådant tillstånd. Även om det återstår mycket att lära sig om denna potentiella nya koppling mellan diabetes och nedsatt kognition, kommer allmänheten att be sina vårdgivare yttrande. Dessutom kommer många patienter med diabetes att vara intresserade av att lära sig mer och kommer att vända sig till sina apotekare för information., Därför bör apotekare diskutera den nuvarande förståelsen av detta tillstånd med sina patienter och också rådgöra med dem om strategier som kan minska risken, med tanke på deras individuella comorbiditeter.
slutsats
intensiv studie pågår i ett försök att bättre karakterisera typ 3-diabetes och att utveckla förebyggande och terapeutiska strategier. Hittills finns det inga specifika behandlingar med bevisad effekt vid förebyggande av kognitiv nedgång eller AD hos patienter med DM., Därför är hanteringen av kognitiv försämring hos patienter med DM identisk med den hos patienter utan DM, med särskild uppmärksamhet på glykemisk kontroll och kardiovaskulära riskfaktorer. Detta är samma tillvägagångssätt som redan är nödvändigt för att förebygga DM-relaterade komplikationer. Medan vissa patientgrupper verkar ha ökad risk för kognitiv försämring, har majoriteten av patienterna med DM inte väldefinierade kliniska föreningar., Även om inga specifika behandlingsalternativ finns tillgängliga, är det nuvarande logiska tillvägagångssättet att uppnå glykemisk kontroll och försiktigt hantera kardiovaskulära riskfaktorer, såsom hyperlipidemi och högt blodtryck.
1. Stewart R, Liolitsa D. typ 2 diabetes mellitus, kognitiv försämring och demens. Diabet Med.
2. Xu WL, von Strauss E, Qiu CX, et al. Okontrollerad diabetes ökar risken för Alzheimers sjukdom: en populationsbaserad kohortstudie. Diabetologia. 2009;52:1031-1039.
3. Arvanitakis Z, Wilson RS, Bennett DA. Diabetes mellitus, demens och kognitiv funktion hos äldre personer., J Nutr Hälsa Åldrande. 2006;10:287-291.
4. Jacobson ÄR, Musen G, Ryan CM, et al. Långvarig effekt av diabetes och dess behandling på kognitiv funktion. N Engl J Med. 2007;356:1842–1852.
5. Whitmer RA. Typ 2-diabetes och risk för kognitiv försämring och demens. Curr Neurol Neurosci Rep. 2007;7:373-380.
6. Steen E, Terry BM, Rivera EJ, et al. Nedsatt insulin och insulinliknande tillväxtfaktoruttryck och signaleringsmekanismer vid Alzheimers sjukdom—är denna typ 3-diabetes? J Alzheimers Sjukdom. 2005;7:63-80.
7. American Diabetes Association. Standarder för sjukvård i diabetes-2010., Diabetesvård.
8. Triplitt Cl, Reasner CA, Isley WL. Diabetes mellitus. I: DiPiro JT, Talbert RL, Yee GC, et al, red. Farmakoterapi principer & praxis. 7: e ed. New York, NEW york: McGraw Hill Medicinsk; 2008:1205-1241.
9. Nathan DM, Buse JB, Davidson VD, et al. Medicinsk hantering av hyperglykemi i typ 2-diabetes: en konsensusalgoritm för initiering och justering av terapi: ett konsensusutlåtande från American Diabetes Association och European Association for the Study of Diabetes. Diabetesvård.
10. Hebert LE, Scherr PA, Bienias JL, et al., Alzheimers sjukdom i den amerikanska befolkningen: prevalens uppskattningar med hjälp av 2000 folkräkningen. Arch Neurol. 2003;60:1119-1122.
11. Cummings J. Alzheimers sjukdom. N Engl J Med. 2004;351:56-67.
12. Slattum PW, Swerdlow RH, Hill ÄR. Alzheimers sjukdom. I: DiPiro JT, Talbert RL, Yee GC, et al, red. Farmakoterapi principer & praxis. 7: e ed. New York, NEW york: McGraw Hill Medicinsk; 2008:1051-1065.
13. Craft S, Watson GS. Insulin och neurodegenerativ sjukdom: delade och specifika mekanismer. Lancet Neurol. 2004;3:169-178.
14. de la Monte SM, Stavar JR., Granskning av insulin och insulinliknande tillväxtfaktoruttryck, signalering och funktionsfel i centrala nervsystemet: relevans för Alzheimers sjukdom. J Alzheimers Sjukdom. 2005;7:45-61.
15. Park CR, Seeley RJ, Hantverk S, Skogen SC. Intracerebroventrikulärt insulin ökar minnet i en passiv undvikande uppgift. Physiol Beteende. 2000;68:509-514.
16. Fehm HL, Perras B, Smolnik R, et al. Manipulera neuropeptiderga vägar hos människor: ett nytt tillvägagångssätt för neurofarmakologi? Eur J Pharmacol. 2000;405:43-54.
17. Zhao WQ, Alkon DL. Insulin-och insulinreceptorens roll i lärande och minne., Mol Cell Endocrinol. 2001;177:125-134.
18. Kopf s, Baratti C. effekter av posttraining administrering av insulin vid retention av ett tillvänjningssvar hos möss: deltagande av en central kolinerg mekanism. Neurobiol Lära Mem.
19. Revill P, Moral MA, Prous JR. nedsatt insulinsignalering och patogenesen av Alzheimers sjukdom. Droger Idag (Barc). 2006;42:785-790.
20. Moroz N, Tong M, Longato L, et al. Begränsad Alzheimer-typ neurodegeneration i experimentell fetma och typ 2 diabetes mellitus. J Alzheimers Sjukdom. 2008;15:29-44.
21. Haan MN., Terapi insikt: typ 2 diabetes mellitus och risken för sen debut Alzheimers sjukdom. Nat Clin Pract Neurol. 2006;2:159-166.
22. Landreth G, Jiang Q, Madrekar S, et al. PPARgamma agonister som terapeuter för behandling av Alzheimers sjukdom. Neuroterapeutics. 2008;5:481-489.
23. Lyn-Laga LE, Lawton M, Tong M, et al. Hepatisk ceramid kan medla hjärninsulinresistens och neurodegeneration vid typ 2-diabetes och alkoholfri steatohepatit. J Alzheimers Sjukdom.
24. Tong M, de la Monte SM. Mekanismer för ceramidmedierad neurodegeneration. J Alzheimers Sjukdom.
25., Reger MA, Watson GS, Grön PS. Intranasalt insulin förbättrar kognition och modulerar beta-amyloid i början av ANNONSEN. Neurology. 2008;70:440-448.
26. Craft S. insulinresistenssyndrom och Alzheimers sjukdom: ålders-och fetma-relaterade effekter på minne, amyloid och inflammation. Neurobiol Åldrande. 2005;26(suppl 1):65-69.
27. Jiang Q, Heneka M, Landreth GE. Rollen av peroxisom proliferator-aktiverad receptor-gamma (PPARgamma) vid Alzheimers sjukdom: terapeutiska konsekvenser. CNS droger. 2008;22:1-14.
28. Watson GS, Cholerton BA, Reger MA, et al., Bevarad kognition hos patienter med tidig Alzheimers sjukdom och amnestisk mild kognitiv försämring under behandling med rosiglitazon: en preliminär studie. Är J Geriatr Psykiatri. 2005;13:950-958.
29. Luchsinger JA, Mayeux R. Fetma och Alzheimers sjukdom. Curr Alzheimers Res. 2007;4:127-134.
30. Whitmer RA. Epidemiologi av adiposity och demens. Curr Alzheimers Res. 2007;4:117-122.
31. Watson gs, Craft S. Roll insulinresistens i patogenesen av Alzheimers sjukdom: konsekvenser för behandling. CNS droger. 2003;17:27-45.
32. Cole GM, Frautschy SA., Rollen av insulin och neurotrofisk faktor signalering i hjärnans åldrande och Alzheimers sjukdom. Exp Gerontol. 2007;42:10-21.
















Lämna ett svar