Tänk på vad som händer halvvägs genom färgförändringen. Vid denna tidpunkt är koncentrationerna av syran och dess Jon lika. I så fall kommer de att avbryta det vänliga uttrycket.
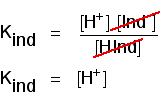
Du kan använda detta för att räkna ut vad pH är vid denna halvvägspunkt., Om du ordnar om den sista ekvationen så att vätejonkoncentrationen ligger på vänster sida och sedan konverterar till pH och pKind får du:
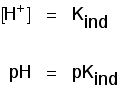
det betyder att slutpunkten för indikatorn helt och hållet beror på vad dess pKind-värde är. För indikatorerna vi har tittat på ovan är dessa:
| indikator | pKind |
|---|---|
| litmus | 6.5 |
| metyl orange | 3.7 |
| fenolftalein | 9.,3 |
pH-intervallet för indikatorer
indikatorerna ändrar inte färg kraftigt vid ett visst pH (givet av deras pKind). Istället ändras de över ett smalt intervall av pH.
Antag att jämvikten är fast åt sidan, men nu lägger du till något för att börja flytta den. När jämviktsskiftet börjar du få mer och mer av den andra färgen som bildas, och vid något tillfälle börjar ögat upptäcka det.
anta till exempel att du hade metylorange i en alkalisk lösning så att den dominerande färgen var gul., Börja nu lägga till syra så att jämvikten börjar skifta.
vid något tillfälle kommer det att finnas tillräckligt med den röda formen av metylorangen närvarande att lösningen börjar ta på sig en orange nyans. När du går på att lägga till mer syra, blir den röda så småningom så dominerande att du inte kan någon longe se någon gul.
det sker en gradvis jämn förändring från en färg till den andra, som sker över ett intervall av pH. som en grov ”tumregel” sker den synliga förändringen ca 1 pH-enhet vardera sidan av pKind-värdet.,
de exakta värdena för de tre indikatorerna vi har tittat på är:
| indikator | pKind | pH – intervall | ||||
|---|---|---|---|---|---|---|
| litmus | 6.5 | 5-8 | ||||
| methylorange | 3,7 | |||||
| 3.1 – 4.4 | ||||||
| fenolftalein | 9.3 | 8.3 – 10.0 |
lackmusfärgförändringen sker över ett ovanligt brett spektrum, men det är användbart för att detektera syror och alkalier i labbet eftersom det ändrar färg runt pH 7., Metylorange eller fenolftalein skulle vara mindre användbart.
detta är lättare att se diagramatiskt.
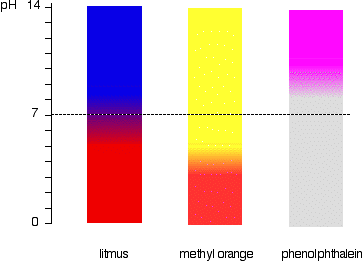
till exempel skulle metylorange vara gult i vilken lösning som helst med ett pH större än 4,4. Det kunde inte skilja mellan en svag syra med ett pH av 5 eller en stark alkali med ett pH av 14.
välja indikatorer för titreringar
Kom ihåg att ekvivalenspunkten för en titrering är där du har blandat de två ämnena i exakt ekvationsproportioner., Du måste självklart välja en indikator som ändrar färg så nära som möjligt till den ekvivalenspunkten. Det varierar från titrering till titrering.
stark syra v stark bas
nästa diagram visar pH-kurvan för att tillsätta en stark syra till en stark bas. Överlagd på det är pH-områdena för metylorange och fenolftalein.
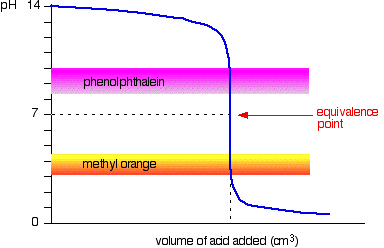
Du kan se att ingen av indikatorerna ändrar färg vid ekvivalenspunkten.,
grafen är dock så brant vid den tidpunkten att det kommer att finnas praktiskt taget ingen skillnad i volymen av syra tillsatt beroende på vilken indikator du väljer. Det skulle dock vara meningsfullt att titrera till bästa möjliga färg med varje indikator.
om du använder fenolftalein skulle du titrera tills det bara blir färglöst (vid pH 8.3) eftersom det är så nära som du kan komma till ekvivalenspunkten.
å andra sidan, med metylorange, skulle du titrera tills det finns det allra första spåret av apelsin i lösningen., Om lösningen blir röd, får du längre från ekvivalenspunkten.
stark syra v svag bas
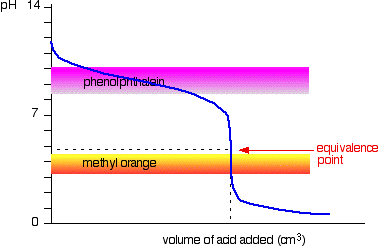
den här gången är det uppenbart att fenolftalein skulle vara helt värdelös. Metylorange börjar dock förändras från gult till orange mycket nära ekvivalenspunkten.
Du måste välja en indikator som ändrar färg på kurvans branta bit.
svag syra v stark bas
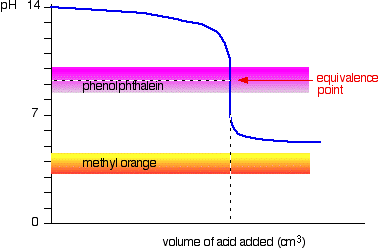
den här gången är metylorangen hopplös!, Fenolftalein ändrar dock färg exakt var du vill att den ska.
svag syra v svag bas
kurvan är för ett fall där syran och basen är båda lika svaga – till exempel etansyra och ammoniaklösning. I andra fall kommer ekvivalenspunkten att vara vid något annat pH.
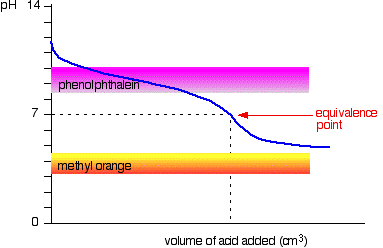
Du kan se att ingen av indikatorerna är till någon nytta. Fenolftalein kommer att ha slutat förändras långt före ekvivalenspunkten, och metylorange faller helt av grafen.,
det kan vara möjligt att hitta en indikator som börjar ändra eller slutar förändras vid ekvivalenspunkten, men eftersom pH för ekvivalenspunkten kommer att skilja sig från fall till fall kan du inte generalisera.
på det hela taget skulle du aldrig titrera en svag syra och en svag bas i närvaro av en indikator.
natriumkarbonatlösning och utspädd saltsyra
detta är ett intressant specialfall., Om du använder fenolftalein eller metylorange, kommer båda att ge ett giltigt titreringsresultat – men värdet med fenolftalein kommer att vara exakt hälften av metylorangeen.
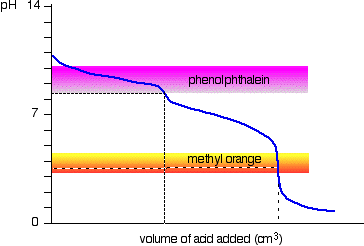
det råkar vara så att fenolftaleinet har avslutat sin färgförändring vid exakt pH i ekvivalenspunkten för den första halvan av reaktionen där natriumvätekarbonat produceras.
![]()
![]()
metylorangen ändrar färg vid exakt pH för ekvivalenspunkten för reaktionens andra steg.,
![]()
![]()
frågor för att testa din förståelse
om detta är den första uppsättningen frågor du har gjort, läs introduktionssidan innan du börjar. Du måste använda bakåtknappen på din webbläsare för att komma tillbaka hit efteråt.
frågor om indikatorer
svar
var Vill du gå nu?
till syra-bas-jämviktsmenyn . . .
till menyn fysikalisk kemi . . .
till huvudmenyn . . .,
















Lämna ett svar