introduktion
replikation i kärnan av eukaryota celler sysselsätter tre DNA-polymeraser: polymeras α, δ Och ε (Hubscher et al., 2002; Pavlov m.fl., 2006b; Kunkel och Hamburgare, 2008; Loeb och Monnat, 2008; Hamburgare, 2009; Pavlov och Shcherbakova, 2010; Lange et al., 2011)., DNA-syntes är riktad och fortsätter från 5 ’till 3’ , där nukleofil attack på α-fosfat av en nukleotid av 3 ’ OH av en primer resulterar i införlivandet av en nukleosidmonofosfat och frisättning av pyrofosfat (Steitz, 1999). Alla DNA-polymeraser kräver en primer och en fri 3 ’ OH för att utföra DNA-syntes, och pol α är inget undantag. Pol α är en heterotetramer bestående av två primasubenheter och två polymeras-subenheter., Primasubenheterna initierar DNA-replikation genom att syntetisera korta (7-12 ribonukleotider) rna-primrar, som sedan förlängs av polymeras α (Pellegrini, 2012). DNA-polymeras δ Och ε förlänger primrarna genererade av Pol α på ett korrekt och processivt sätt (Kunkel, 2004, 2011; Pellegrini, 2012). I jäst har DNA-polymeras δ visat sig vara väsentligt för DNA-syntes av den fördröjda strängen medan pol ε verkar huvudsakligen fungera vid den ledande strängen (Pursell et al., 2007; Nick Mcelhinny et al., 2008; Kunkel, 2011; Georgescu m.fl., 2014)., Däremot är i mitokondrier replikation ansvaret för en enda polymeras, DNA-polymeras γ (Lee et al., 2009).
DNA-polymeraser är grupperade i sju familjer (A, B, C, D, X, Y och RT). I eukaryoter råkar de tre nukleära replikativa DNA-polymeraserna tillhöra B-familjen (Burgers et al., 2001; Patel och Loeb, 2001). Det finns nu kristaller strukturer av alla tre replikativa DNA-polymeraser från jäst, som möjliggör för första gången en jämförelse av deras delade strukturella element samt en studie av deras unika egenskaper (Swan et al., 2009; Perera m.fl.,, 2013; Hogg et al., 2014; Jain et al., 2014a). Alla tre replikativa DNA-polymeras är multi-subenheten enzymer (Tabell 1) (Johansson och Macneill, 2010; Pavlov och Shcherbakova, 2010; Makarova et al., 2014). Huvudfokus för denna granskning ligger på deras katalytiska domän, eller underenhet A.
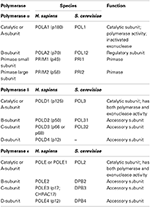
tabell 1. Eukaryota DNA-polymeraser är multi-subenheten enzymer.,
övergripande struktur av B-familjen polymeraser
alla DNA-polymeraser delar en gemensam polymerasfalk, som har jämförts med en mänsklig högra hand, bestående av tre underdomäner: fingrar, handflata och tumme (Steitz, 1999; Patel och Loeb, 2001). Palmen, en mycket bevarad vik bestående av fyra antiparallel β-strängar och två helices, hyser två strikt konserverade katalytiska aspartater som ligger i motiv A, DXXLYPS och motiv C, DTDS (Delarue et al., 1990; Braithwaite och Ito, 1993)., Detta RRM-som vik delas av en mycket stor grupp av enzymer, inklusive DNA och RNA, omvänd transcriptases, CRISPR-polymeras och även bakåt (3′-5′) transferases som Thg1 (Anantharaman et al., 2010, Hyde m.fl., 2010). Däremot uppvisar tummen och fingrarna väsentligt mer strukturell mångfald (Steitz, 1999). Fingrarna genomgår en konformationsförändring vid bindning av DNA och korrekt inkommande nukleotid. Denna rörelse tillåter rester i fingrarna underdomän att komma i kontakt med nukleotiden i det växande basparet., Tummen håller DNA duplex under replikering och spelar en roll i processivitet (Doublié och Ellenberger, 1998; Doublié et al., 1999).
eukaryotiska DNA-polymeraser α, δ Och ε delar homologi med många archaeala, bakteriella, bakteriofager och virala polymeraser (Delarue et al., 1990; Braithwaite och Ito, 1993; Franklin et al., 2001; Firbank et al., 2008; Wang Yang, 2009)., Koonin och medarbetare bidrog med en detaljerad fylogenetisk analys av arkaeala DNA-polymeraser och deras förhållande till eukaryotiska polymeraser i denna fråga av gränser i mikrobiologi tillägnad polymeraser Makarova et al. (2014).
alla B-familjepolymeraser består av fem underdomäner: fingrarna, tummen och handflatan (beskriven ovan) som utgör kärnan i enzymet, liksom en exonukleasdomän och en N-terminal domän (NTD) (Franklin et al., 2001; Xia och Konigsberg, 2014) (Figur 1, Tabell S1)., Exonukleas domänen bär en 3′ -5 ’ korrekturläsning aktivitet, som tar bort misincorporated nukleotider. Den exonukleas aktiva platsen ligger 40-45 Å bort från polymeras aktiva platsen. NTD verkar sakna katalytisk aktivitet. I pol δ innefattar NTD tre motiv: en har en topologi som liknar en OB-vik, ett enkelsträngat DNA-bindande motiv och en annan bär ett RNA-bindande motiv (rna-Igenkänningsmotiv eller RRM) (Swan et al., 2009). I bakteriofag T4 minskar mutationerna i NTD-uttrycket av polymerasen (Hughes et al., 1987)., I RB69 och T4, den gp43-polymeras binder sin egen messenger-RNA, förmodligen genom NTD och represses översättning (Petrov et al., 2002), vilket inte verkar vara fallet för pol δ (Swan et al., 2009). Nya data tyder på att NTD spelar en roll i polymerasstabilitet och trohet genom dess interaktioner med andra domäner (Li et al., 2010; Prindle et al. 2013) (se nedan).
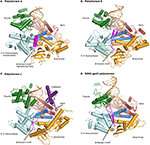
Figur 1. Ternära komplex av polymeraser α, δ, ε och RB69 gp43 illustreras av identiska orienteringar för jämförelse., Tummen (grön) och fingrarna (mörkblå) domäner förstå duplex nukleinsyra (primer visas i beige, Mall i orange) mot palm domänen (röd). N-terminaldomänen visas i gold, intill 3′ -5 ’ exonukleasdomänen (cyan). (A) – Polymeras α (PDBID 4FYD) binder en RNA/DNA hybrid, där den breda, långgrunda mindre spår av A-form DNA är uppenbart nära tummen. 3’ -5 ’ exonukleas domän saknar aktivitet. En spiralformad region (magenta) i den inaktiverade exonukleasdomänen stabiliserar mallen 5 ’ End., B) polymeras δ (PDBID 3IAY) har ett stort β-hårnålsmotiv (magenta), vilket är viktigt för att byta primersträngen från det aktiva polymeras-stället till det aktiva exonukleasstället vid korrekturläsning. C) polymeras ε (PDBID 4M8O) har en unik p-domän (lila), som ger polymeras med ökad processivitet. Intressant är β-hårnålsmotivet atrofierat i pol ε., (D) bevarande av familjen B DNA polymerase fold och domänorganisation, är uppenbart när modellenzymet från bakteriofag RB69 gp43 (PDBID 2OZS) ses tillsammans med de tre eukaryotiska replikativa polymeraserna. Domänavgränsningen för varje polymeras anges i tabell S1. Figur gjordes med PyMOL (Den PyMOL Molekylär Grafik System, Version 1.5.0.4 Schrödinger, LLC.).
alla DNA-polymeraser från däggdjur B-familjen är kända för att hysa två cysteinrika metallbindningsställen (CysA och CysB) i deras C-terminaldomän (CTD) (Figur 2)., CysA antas vara ett zinkbindningsställe medan CysB är ett järnsulfkluster (Netz et al., 2012). Förlust av klustret i CTD av jästpol δ påverkar negativt interaktioner med dess tillbehör B-subenhet (Sanchez Garcia et al., 2004). Det zinkbindande motivet visades vara viktigt för interaktion mellan POL δ och dess processivitetsfaktor PCNA (Netz et al., 2012).

Figur 2. Schematisk bild av de tre Saccharomyces cerevisiae replikativa DNA-polymeras α, δ och ε., DNA-polymeras från bakteriofag RB69 visas för jämförelse.
DNA-polymeras α
den katalytiska subenheten av DNA-polymeras α består av 1468 aminosyror (Tabell 2). Proteinkonstruktionen avsedd för kristallisering trunkerades vid n-och C-termini (rester 349-1258) och saknar därför CTD och dess kluster (Figur 2). Konstruktionen kristalliserades oligande, i ett binärt komplex med en DNA/RNA hybrid oligonukleotid, och i ett ternära komplex med DNA/RNA och inkommande nukleotid (Perera et al., 2013) (Figur 1).,

tabell 2. Sammanställning av DNA-polymeraser av B-familjen med känd struktur.
en mekanism för urkoppling av polymeras
RNA/DNA-OLIGONUKLEOTIDEN som fångas i kristallerna antar en a-form konformation, som förväntat. Tumdomänen engagerar sig i flera interaktioner med RNA-primern, både via hydrofoba kontakter och polära interaktioner (Perera et al., 2013)., Experiment i lösning har visat att förlängningen av RNA-primern med pol α är begränsad till 10-12 nukleotider, vilket motsvarar en varv av en helix. Denna observation ledde författarna att föreslå en mekanism för uppsägning av primersyntesen av pol α där förlust av specifika interaktioner mellan tummen och RNA skulle utlösa polymerasen att lossna från DNA/RNA oligonukleotid, och tillåta en hand off till en replikativ polymeras.,
rörelser i Palmdomänen kan underlätta translokation av Pol α
Efter att ha kristalliserat enzymet i tre tillstånd (apo, binär och ternär) tillät författarna att överlappa alla tre strukturella modeller. Pol α är den enda eukaryotiska familjen B-DNA-polymeras för vilken alla tre stater fångades i en kristallstruktur. Den strukturella överlagringen avslöjade att, förutom de väldokumenterade rörelserna hos fingrarna och tumdomänerna som åtföljer substratbindning och nukleotidylöverföring, genomgår palmunderdomänen själv en strukturell omläggning (Perera et al.,, 2013). Författarna föreslår att de olika konformationerna av palmdomänen skulle kunna underlätta translokation av pol α längs och bortom RNA / DNA duplex. Som nämnts ovan förutspås förlust av kontakter till RNA-strängen att utlösa frisättning av primer, som sedan blir tillgänglig för förlängning av pol δ Eller ε.,
En Annan Protein Vik i den Inaktiverade Exonuclease Underdomän
korrekturläsning aktivitet är avskaffat i pol-α, på grund av mutationer i alla fyra carboxylates (Asp114/Glu116/Asp222/Asp327 i RB69 gp43 motsvarar Ser542/Gln544/Tyr644/Asn757 i en struktur baserad alignment) (Tabell 2). Dessutom, β-hårnål motiv som finns i de flesta polymeraser av B-familj (rester 246-267 i RB69 gp43) är ersatt av en spiralformad regionen i pol-α (rester 667-676; 681-693) (Hogg et al., 2007)., Β hårnålen är en del av exonuclease domän och har visats i T4 och RB69 pols att delta i en uppdelning av DNA-primer mellan polymeras och exonuclease aktiv webbplats (Reha-Krantz, 1988; Stocki et al., 1995; Hogg m.fl., 2007). I avsaknad av korrekturläsning är det inte förvånande att detta motiv inte behölls i pol α. I pol α-stacken med en tymin-och guaninbas, vid positionerna -3 och -2 i den oparade 5 ’ end av mallen (Perera et al., 2013)., I pol α har således den region som motsvarar β-hårnålsmotivet en annan vik (helices vs β-strängar) och en annan funktion (stabilisering av mallsträngens oparade region snarare än att underlätta aktiv platsbyte). Eftersom pol α saknar korrekturläsning uppstår frågan om huruvida de korta oligonukleotiderna korrigeras, och i så fall genom vilket DNA-polymeras. Det verkar som att korrekturläsning av primrarna syntetiserade av pol α utförs av pol δ (Pavlov et al., 2006a).,
DNA-Polymeras δ
de Mänskliga pol δ består av fyra subenheter medan Saccharomyces cerevisiae har tre (Gerik et al., 1998; Liu m.fl., 2000) (Tabell 1). Förutom dess funktion i DNA-replikation har Pol δ visat sig spela en roll i DNA-reparation och rekombination (Hubscher et al., 2002; Lee et al., 2012; Tahirov, 2012). P12, den minsta subenheten i human Pol δ och även subenheten som inte ses i spirande jäst, bryts ned som svar på DNA-skada (Lee et al., 2014). Den katalytiska subenheten av jästpol δ (POL3) består av 1097 resthalter., Konstruktionen som används för kristallisering innefattar rester 67-985 och saknar således CTD (Figur 1; Tabell 2).
en tredje metalljon i det aktiva polymeras-området
palmdomänen innehåller tre konserverade karboxylater (Asp608, Asp762 och Asp764). De två katalytiska aspartaterna, Asp608 och Asp764, kontaktar två metalljoner (Ca2+) i det aktiva polymeras-stället åtskilda av 3,7 Å. Intriguingly en tredje metall observerades samordnas av γ fosfat av den inkommande nukleotid och Glu802, med Glu800 i närheten., Muterar båda glutamaterna till alanin gav en polymerasvariant med minskad inkorporeringseffektivitet för både korrekta och felaktiga nukleotider (Swan et al., 2009). På dessa aminosyror positioner, pol α och pol ε också har carboxylate återstoder (pol δ Glu800/Glu802 motsvarar pol α Asp1033/Asp1035, och pol ε Glu945/Asp947). Huruvida dessa karboxylater spelar liknande roller i pol α Och ε återstår att undersöka.,
High Fidelity och korrekturläsning
Human Pol δ är ett HiFi-polymeras som katalyserar nukleotidylöverföringsreaktionen med en felfrekvens på 1 per 22 000 (Schmitt et al., 2009). Korrekturläsning ökar polymerasens trohet med en faktor 10-100 (Mcculloch och Kunkel, 2008; Prindle et al., 2013). Pol δ har ett polymeras-och exonukleasaktivt område, åtskilt av ca 45 Å (Swan et al., 2009). DNA-polymeraser med korrekturläsande aktivitet kan känna av felaktiga nukleotider genom att kontakta det mindre spåret av baspar bortom insättningsstället., Proteinet interagerar med universella vätebindande acceptorer vid N3 och O2 positioner av puriner och pyrimidiner, respektive (Seeman et al., 1976; Doublié et al., 1998; Franklin et al., 2001). Dessa väte bond kontakter bevaras när basparet antar en Watson-Crick geometri och förlorade i händelse av en obalans. I RB69 gp43 sträcker sig kontakterna till de två första basparen bortom det växande basparet (Franklin et al., 2001; Hogg et al., 2004, 2005). Kontakterna är mycket mer omfattande i Pol δ, som sträcker sig till fem baspar efter insättning (Swan et al.,, 2009), vilket skulle kunna bidra till sin höga trohet.
som nämnts ovan spelar β-hårnålssegmentet från exonukleasdomänen en kritisk roll vid partitionen av DNA mellan polymerisations-och korrekturläsningsställen i T4 och RB69 pols (Stocki et al., 1995; Hogg m.fl., 2007). I RB69 gp43 antar β-hårnålsmotivet olika konformationer, beroende på om komplexet erhölls med oskadat DNA (Franklin et al., 2001; Zahn et al., 2007) eller DNA som innehåller en skada (Freisinger et al., 2004; Hogg et al., 2004)., Det var helt visualiserad kontakt både primer och mallsträngar i ett komplex med tyminglykol (Aller et al., 2011). På samma sätt sticker β-hårnålen i Pol δ ut i DNA: s stora spår och fungerar som en kil mellan dubbelsträngat DNA och enkelsträngat 5 ’ end av mallsträngen, som stabiliseras av två aromatiska rester Phe441 och Tyr446 (Figur 1) (Swan et al., 2009). P-hårnålens position överensstämmer med en roll vid aktiv växling.,
Mellandomänkontakter och trohet
mutationer som är involverade i cancer finns oftast i exonukleasdomänen för pol δ Och ε, med betoning på den kritiska rollen som korrekturläsning vid sänkning av förekomsten av mutationer (Church et al., 2013; Henninger och Pursell, 2014). En mutation i humana kolorektala cancerceller lokaliserar till fingrarna domän, R689W. den analoga mutationen i jäst (R696W) resulterar i en mutatorfenotyp (Daee et al., 2010)., En mutation i närheten av Arg696 i det mycket bevarade motivet B av fingrarna underdomän av jästpol δ (a699q) resulterar också i en mutatorfenotyp. Denna region av fingrarna ligger i närheten av NTD. Muterande Met540 av NTD till alanin avskaffar mutatorfenotypen av a699q, vilket illustrerar att interaktioner mellan fingrarna och NTD kan påverka polymerasens trohet (Prindle et al., 2013)., På samma sätt i T4 och RB69 pols är NPL-kärnmotivet, som innefattar rester från N-terminalen och palmdomänerna, i kontakt med fingrarna och visades stabilisera polymeras-DNA-komplex (Li et al., 2010).
DNA-polymeras ε
den katalytiska subenheten av DNA-polymeras ε är produkten av en mycket stor gen (2222 aminosyror i jäst; 2286 hos människor), och är endast tredje i storlek efter polymeras ζ (även en medlem av B-familjen) och pol θ, En familj en polymeras (3130 och 2590 aminosyror, respektive hos människor) (Lange et al.,, 2011; Hogg och Johansson, 2012) (Figur 1, Tabell 2). Pol ε är dubbelt så stor som pol δ och består av två tandempolymeras/exonukleasregioner. N-terminalsegmentet har både polymeras-och korrekturläsningsaktiviteter medan C-terminalsegmentet inaktiveras. De två exonukleas-polymerasmodulerna är avlägset besläktade (Tahirov et al., 2009). Även om det inaktiverade segmentet antas spela en strukturell roll under replikering, kunde två grupper kristallisera katalytiskt aktiva Pol ε-konstruktioner (rester 1-1228; 1-1187) som saknade hela C-terminalmodulen (Hogg et al.,, 2014; Jain et al., 2014a). Båda kristallstrukturerna var av ett ternära komplex av polymeras, DNA primer / Mall och inkommande nukleotid.
en ny Processivitetsdomän som härrör från Palmdomänen
Pol ε skiljer sig från pol δ genom att den inte kräver DNA-glidklämman PCNA för hög processivitet (Hogg och Johansson, 2012). Palmdomänen för Pol ε är betydligt större (380 resthalter) än den för Pol α Eller δ (175 respektive 203 resthalter)., De senaste Pol ε-kristallstrukturerna visade att Infogningar i palmdomänen tillsammans utgör en ny domän bestående av tre β-strängar och två helices (rester 533-555; 682-760) (Hogg et al., 2014; Jain et al., 2014a) (Figur 1, Tabell S1). Ta bort rester 690-751 resulterade i en variant med minskad polymerasaktivitet. Dessutom påverkade muterande positivt laddade rester (His748, Arg749 och Lys751) i närheten av fosfatbacken enzymets processivitet (Hogg et al., 2014)., Den extra domän som härstammar från handflatan namngavs sålunda processiviteten eller p-domänen efter dess funktion. Basen på p-domänen har en metallbindningsplats (se nedan) (Hogg et al., 2014; Jain et al., 2014a,b).
ett Järnsvavelkluster inom Polymerasdomänen
oväntat lösningsstudier visade att den katalytiska subenheten av jästpolymeras ε själv innehåller Ett kluster inom dess polymerasfalt (Jain et al., 2014b), utöver klustret i CTD (Figur 2; Tabell 2)., Det andra klustret inom pol ε tyder på att detta polymeras kan vara känsligare för oxidativ stress (Jain et al., 2014b). Kristallstrukturerna i pol ε avslöjade emellertid inte ett kluster i polymerasdomänen (Hogg et al., 2014; Jain et al., 2014a; Zahn och Doublié, 2014). Två av cysteinerna är oordnade i de strukturella modellerna och det resulterande metallbindningsstället verkar binda zink (Hogg et al., 2014; Jain et al., 2014a). Substitution av A med en icke-infödd zink i metallbindande proteiner är inte ovanligt (Netz et al., 2012) som kluster är labila., Visualisera inom polymerasdomänen av Pol ε kan kräva anaeroba förhållanden.
ett kort β-Hårnålsmotiv i Exonukleasdomänen
i alla DNA-polymeras som hyser både polymeras och exonukleasaktiviteter är det bundna DNA i jämvikt mellan de två aktiva centra (Beechem et al., 1998). Koncentrationen av inkommande nukleotid och närvaron av en skadad bas eller mispair är två faktorer som påverkar överföringen av DNA från polymerasen aktiverar platsen till den korrekturläsande aktiva platsen., Polymeraser övervakar den mindre spårsidan av de nybildade basparen och interagerar med universal H bond acceptors, O3 och N2, som ett sätt att kontrollera felmatchningar (Seeman et al., 1976; Franklin et al., 2001). En unik egenskap hos pol ε är kontakten till den stora spårsidan av det växande basparet via en rest från exonukleasdomänen, Tyr431. Ytterligare analys är motiverad för att belysa tyrosinens potentiella roll i Pol εs trovärdighet.,
i pol δ sätter β-hårnålssegmentet sig i DNA: t och fungerar som en kil mellan enkelsträngat och dubbelsträngat DNA (Swan et al., 2009). I E. coli DNA pol II skiftar införandet av en β-fat positionen för β-hårnålen på ett sådant sätt att polymerisering gynnas över korrekturläsning (Wang och Yang, 2009). Denna modifiering tillåter förmodligen detta polymeras att utföra translesionsyntesförlängning., Eftersom Pol ε är en exakt DNA-polymeras skulle antagandet före kunskap om kristallstrukturen vara att β-hårnålen borde vara närmare pol δ än E. coli Pol II. överraskande är β-hårnålsmotivet i pol ε trunkerat, för kort för att kontakta DNA (Figur 1). Vilket proteinmotiv kan då underlätta aktiv plats som byter vid avkänning av felpar? P-domänen är en bra kandidat, på grund av dess kontakter till både primer och mallsträngar; rester från P-domänen kan känna av replikeringsfel och kan därmed bidra till att underlätta aktiv webbplatsbyte.,
slutsatser
alla tre eukaryotiska replikativa DNA-polymeraser använder en gemensam b-familjevikt, och varje polymeras har införlivat modifierade strukturella element som är unika och skräddarsydda för varje polymeras specifika funktion (till exempel tillägg av processivitetsdomänen i pol ε, En processiv polymeras som inte använder PCNA, eller den modifierade region som kontaktar 5 ’ end av mallen i pol α, en polymeras som saknar korrekturläsningsaktivitet). Vecket av B-familjen polymeraser är väl lämpad för hifi -, replikativa polymeraser., Men överraskande används den också av translesionpolymeraser. Eukaryotisk pol ζ (eller REV3L) är ett 353 kDa-polymeras som fungerar i translesionsyntes och verkar undertrycka tumorigenes (Wittschieben et al., 2010; Lange m.fl., 2011; Zahn et al., 2011; Hogg och Johansson, 2012; Sharma et al., 2013). Strukturen av E. coli Pol II avslöjade modifieringar i NTD som påverkar positionen för β-hårnålen i exonukleasdomänen och därmed partitionering av DNA mellan polymerisations-och korrekturläsningsställena (Wang och Yang, 2009)., Strukturen hos pol ζ kan avslöja liknande justeringar, som förändrar den vik som används av HiFi, replikativa polymeraser för att göra enzymet mindre troget och kunna utföra translesionsyntes.
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
bekräftelse
detta arbete stöddes av ett bidrag från National Institutes of Health (NCI R01 CA 52040).
















Lämna ett svar