| Universitetet i Sheffield | |
| Institutt for Kjemi | VSEPR |
Ammoniakk har også fire electron par og koordinering geometri av nitrogen er basert på en tetrahedral arrangement av electron par. Det er bare tre limt grupper, derfor er det en enslig par. Men siden den ensomme par er ‘usynlig’, i form av ammoniakk er pyramidal.,r>
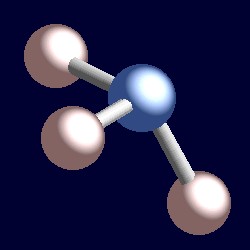
Vurdere en bonding par av elektroner. De to elektroner er plassert mellom to kjerner, og er tiltrukket av begge. En enslig par er ulike. Det er nødvendigvis bare tiltrukket av en kjerne, og konsekvensen er at det vedtar en posisjon effektivt nærmere som en kjerne enn bonding par av elektroner. Dette betyr at den effektive solid vinkel okkupert av en enslig par er større enn det som er okkupert av en bond-par., Lone par etterspørselen større kantete rom, og ligger nærmere deres atomer enn bond par. Konsekvensen av dette for ammoniakk er at lone par gjør rommet for seg selv ved å skyve de tre hydrogen atomer sammen en liten og H-N-H bond vinkler er litt mindre (106.6°) enn den ideelle tetrahedral vinkel på 109.5°.
















Legg igjen en kommentar