Tenk på hva som skjer halvveis gjennom den fargen du vil endre. På dette punktet konsentrasjon av syre og dens ion er lik. I så fall, de vil kansellere ut av den Type uttrykk.
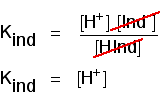
Du kan bruke dette til å finne ut hva pH er på denne halv-veis punkt., Hvis du re-arrangere den siste ligningen, slik at hydrogen ion-konsentrasjonen er på venstre side, og deretter konvertere til pH og pKind, får du:
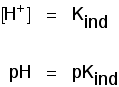
det betyr At endepunktet for indikatoren kommer helt an på hva pKind verdi er. For de indikatorene vi har sett på ovenfor, disse er:
| – indikatoren | pKind |
|---|---|
| lakmus | 6.5 |
| methyl-orange | 3.7 |
| phenolphthalein | 9.,3 |
pH utvalg av indikatorer
Indikatorer ikke endre farge kraftig på en bestemt pH (gitt av deres pKind). I stedet, de endrer seg over et smalt spekter av pH.
Anta likevekt er fast til den ene siden, men nå kan du legge til noe for å starte å skifte den. Som likevekt skift, vil du begynne å få mer og mer av den andre fargen dannes, og på et tidspunkt øyet vil begynne å oppdage det.
For eksempel, tenk deg at du hadde methyl oransje i en basisk løsning, slik at den dominerende farge er gul., Nå kan du begynne å legge til syre, slik at likevekt begynner å skifte.
På et tidspunkt vil det være nok av det røde form av metyl-orange til stede for at løsningen skal begynne å ta på seg et oransje skjær. Som du går på å legge til mer syre, den røde vil til slutt bli så dominerende at du kan no longe se noen gule.
Det er en gradvis glatt endres fra en farge til den andre, som finner sted over et utvalg av pH. Som en grov «tommelfingerregel», den synlige endringen finner sted ca 1 pH-enhet hver side av pKind verdi.,
De eksakte verdiene for de tre indikatorene vi har sett på er:
| – indikatoren | pKind | pH-område |
|---|---|---|
| lakmus | 6.5 | 5 – 8 |
| methyl-orange | 3.7 | 3.1 – 4.4 |
| phenolphthalein | 9.3 | 8.3 – 10.0 |
lakmus farge endring skjer over et uvanlig bredt spekter, men det er nyttig for påvisning av syrer og baser i laboratoriet, fordi det endrer farge rundt pH 7., Methyl oransje eller phenolphthalein ville være mindre nyttig.
Dette er lettere sett diagramatically.
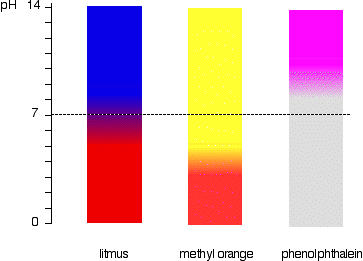
For eksempel, metyl-oransje ville bli gul i noen løsning med en pH-verdi som er større enn 4.4. Det kunne ikke skille mellom en svak syre med en pH-verdi på 5 eller sterkt alkaliske med en pH-verdi på 14.
Velge indikatorer for titrations
Husk at ekvivalens punkt i en titrering er der du har blandet de to stoffene i nøyaktig ligningen proporsjoner., Du trenger for å velge en indikator som forandrer farge så nært som mulig til at ekvivalens punkt. Det varierer fra titrering til titrering.
Sterk syre v sterk base
Det neste diagrammet viser pH-kurven for å legge til en sterk syre til en sterk base. Oppå det er pH-områder for methyl oransje og phenolphthalein.
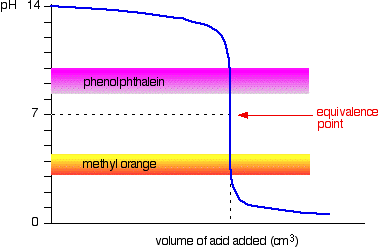
Du kan se at verken indikatoren skifter farge ved ekvivalens-punkt.,
Men den grafen er så bratt på det punktet at det vil være praktisk talt ingen forskjell i mengden av syre lagt hvilken indikator som du velger. Imidlertid vil det være fornuftig å kunne titrere til best mulig farge med hver indikator.
Hvis du bruker phenolphthalein, vil du kunne titrere til det blir bare fargeløs (ved pH 8.3) fordi det er så nært som du kan komme til ekvivalens punkt.
På den annen side, ved hjelp av metyl oransje, vil du kunne titrere til det er den aller første spor av oransje i løsningen., Hvis løsningen blir røde, får du ytterligere fra ekvivalens punkt.
Sterk syre v svak base
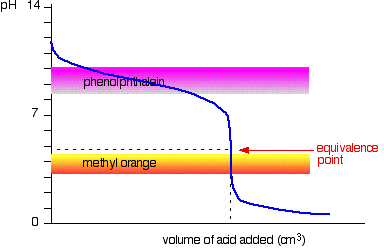
Denne gangen er det åpenbart at phenolphthalein ville være helt ubrukelig. Imidlertid, metyl-oransje begynner å endre seg fra gult mot oransje svært nær ekvivalens punkt.
Du må velge en indikator som forandrer farge på den bratte bit av kurven.
Svak syre v sterk base
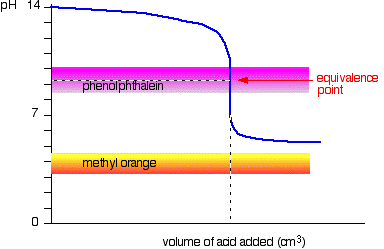
Denne tiden, methyl orange er håpløs!, Men phenolphthalein endrer farge akkurat der du vil ha det til.
Svak syre v svak base
kurven er for et tilfelle hvor syre og base er begge like svake – for eksempel, ethanoic saltsyre og ammoniakk løsning. I andre tilfeller, den ekvivalens punktet vil være på noen annen pH.
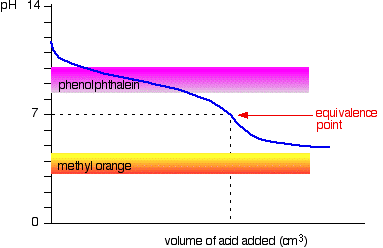
Du kan se at verken indikatoren er enhver bruk. Phenolphthalein vil ha ferdig med å endre godt før ekvivalens punkt, og methyl oransje faller av grafen helt.,
Det kan være mulig å finne en indikator som begynner å endre eller ferdig endring i ekvivalens punktet, men fordi pH-verdien av den ekvivalens punktet vil være forskjellig fra sak til sak, du kan ikke generere.
i det hele, ville du aldri kunne titrere en svak syre og en svak base i nærvær av en indikator.
natriumkarbonat løsning og fortynnet saltsyre
Dette er et interessant spesielle tilfelle., Hvis du bruker phenolphthalein eller methyl oransje, som begge vil gi en gyldig titrering resultat – men verdien med phenolphthalein vil være nøyaktig halvparten av metyl oransje.
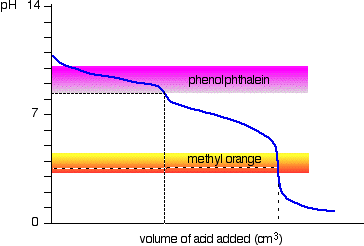
Det skjer, slik at den phenolphthalein har fullført sin farge endre på nøyaktig pH i ekvivalens punktet på den første halvdel av den reaksjonen som sodium hydrogencarbonate er produsert.
![]()
![]()
methyl oransje, endres fargen på nøyaktig pH i ekvivalens punkt på den andre etappen av reaksjonen.,
![]()
![]()
Spørsmål for å teste din forståelse
Hvis dette er det første settet av spørsmål du har gjort, kan du lese innledende side før du starter. Du må bruke TILBAKE-KNAPPEN i nettleseren din for å komme tilbake hit etterpå.
spørsmål om indikatorer
svar
Hvor ønsker du å gå nå?
Til syre-base-likevekter-menyen . . .
Til Fysisk Kjemi-menyen . . .
Til Hovedmenyen . . .,
















Legg igjen en kommentar