Innledning
Replikasjon i kjernen av eukaryote celler sysselsetter tre DNA-polymerases: polymerase α, δ, og ε (Hubscher et al., 2002; Pavlov et al., 2006b; Kunkel og Hamburgere, 2008; Loeb og Monnat, 2008; Burgere, 2009; Pavlov og Shcherbakova, 2010; Lange et al., 2011)., DNA-syntese er retningsbestemt og innbetaling fra 5′ til 3′, der nucleophilic angrep på α-fosfat av en nukleotid av 3 ‘ OH av en primer resultater i inkorporering av en nucleoside monophosphate og utslipp av pyrophosphate (Steitz, 1999). Alle DNA-polymerases trenger en introduksjon og en fri 3 ‘ OH til å gjennomføre DNA-syntese, og pol α er intet unntak. Pol α er en heterotetramer består av to primase underenhetene og to polymerase underenhetene., Den primase underenhetene starte DNA-replikasjon av å syntetisere kort (7-12 ribonucleotid) RNA-primere, som er så utvidet med polymerase α (Pellegrini, 2012). DNA-polymerase δ og ε strekke primere som er generert av pol α i en nøyaktig og processive måte (Kunkel, 2004, 2011; Pellegrini, 2012). I gjær, DNA polymerase δ har vist seg å være viktig for DNA-syntese av lagging strand mens pol ε ser ut til å hovedsakelig funksjon på ledende strand (Pursell et al., 2007; Nick Mcelhinny et al., 2008; Kunkel, 2011; Georgescu et al., 2014)., I kontrast, i mitokondriene replikering har ansvar for ett eneste polymerase, DNA polymerase γ (Lee et al., 2009).
DNA polymerases er gruppert i sju familier (A, B, C, D, X, Y, og RT). I eukaryotes de tre kjernefysiske replicative DNA polymerases tilfeldigvis tilhører B-familien (Burgere et al. I 2001; Patel og Loeb, 2001). Det er nå krystaller strukturer av alle tre replicative DNA polymerases fra gjær, som gjør det mulig for første gang en sammenligning av deres felles strukturelle elementer, så vel som en studie av sin unike funksjoner (Swan et al., 2009; Perera et al.,, 2013; Hogg et al., 2014; Jain et al., 2014a). Alle tre replicative DNA polymerases er multi-subunit enzymer (Tabell 1) (Johansson og Macneill, 2010; Pavlov og Shcherbakova, 2010; Makarova et al., 2014). Hovedfokus for denne vurderingen er på sin katalytisk domene, eller subunit A.
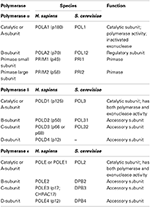
Tabell 1. Eukaryote DNA polymerases er multi-subunit enzymer.,
Generelle Strukturen av B-Familien Polymerases
Alle DNA-polymerases dele en felles polymerase brett, som har blitt sammenlignet med et menneske høyre hånd, som består av tre underdomener: fingrene, håndflaten og tommelen (Steitz, 1999; Patel og Loeb, 2001). The palm, som er en svært bevart brett består av fire antiparallel β tråder og to helices, havner to strengt bevart katalytisk aspartates ligger i ET motiv, DXXLYPS og motiv C, DTDER (Delarue et al., 1990; Braithwaite og Ito, 1993)., Dette RRM-brett som er delt av en meget stor gruppe av enzymer, blant annet DNA og RNA polymerases, omvendt transcriptases, CRISPR polymerase, og til og med reversere (3′-5′) transferases som Thg1 (Anantharaman et al., 2010; Hyde et al., 2010). I kontrast til tommel og fingre underdomener utstilling vesentlig mer strukturelle mangfold (Steitz, 1999). Fingrene gjennomgå en conformational endre ved binding til DNA og riktig innkommende nukleotid. Denne bevegelsen gjør rester i fingrene underdomene til å komme i kontakt med nukleotid i den nye base-par., Tommelen har DNA-duplex under replikasjon og spiller en del i processivity (Doublié og Ellenberger, 1998; Doublié et al., 1999).
Eukaryote DNA polymerases α, δ, og ε dele homologi med mange archaeal, bakteriell, bacteriophage, og viral polymerases (Delarue et al., 1990; Braithwaite og Ito, 1993; Franklin et al. I 2001; Firbank et al., 2008; Wang og Yang, 2009)., Koonin og samarbeidspartnere bidratt med en detaljert fylogenetisk analyse av archaeal DNA polymerases og deres forhold til eukaryote polymerases i dette nummeret av Grenser i Mikrobiologi dedikert til polymerases Makarova et al. (2014).
Alle B-familien polymerases er sammensatt av fem underdomener: fingrene, tommelen, og palm (beskrevet ovenfor) som utgjør kjernen av enzymet, samt en exonuclease domene og en N-terminal domene (NTD) (Franklin et al. I 2001; Xia og Konigsberg, 2014) (Figur 1, Tabell S1)., Den exonuclease domene bærer en 3′-5′ korrekturlesing aktivitet, som fjerner misincorporated nukleotider. Den exonuclease aktive nettstedet, er forretningsvennlig og ligger 40-45 Å bort fra polymerase aktive nettstedet. Den NTD synes å være blottet for katalytisk aktivitet. I pol-δ den NTD består av tre motiver: man har en topologi som ligner en OB-brett, en single-strandet DNA-bindende motiv, og en annen bærer et RNA-bindende motiv (RNA Anerkjennelse Motiv eller RRM) (Swan et al., 2009). I bacteriophage T4, mutasjoner i NTD redusere uttrykk for polymerase (Hughes et al., 1987)., I RB69 og T4, den gp43 polymerase binder seg sin egen messenger RNA, antagelig gjennom NTD, og undertrykker oversettelse (Petrov et al., 2002), som ikke synes å være tilfelle for pol-δ (Swan et al., 2009). Nye data tyder på at NTD spiller en rolle i polymerase stabilitet og troskap gjennom sine samhandlinger med andre domener (Li et al., 2010; Prindle et al., 2013) (se nedenfor).
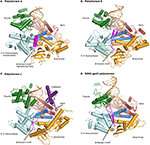
Figur 1. Trefoldig komplekser av polymerases α, δ, ε, og RB69 gp43 er illustrert fra identiske retningen for sammenligning., Tommelen (grønn) og fingre (mørk blå) domener ta tak i duplex-nukleinsyre (primer vist i beige, mal i oransje) mot palm domene (red). N-terminal domene vises i gull, i tilknytning til 3′-5′ exonuclease domene (cyan). (En) Polymerase α (PDBID 4FYD) binder et RNA/DNA-hybrid, der den brede, grunne mindre sporet i A-form DNA er tydelig i nærheten av tommelen. 3′-5′ exonuclease domenet er blottet for aktivitet. En spiralformet regionen (magenta) i inaktivert exonuclease domene stabiliserer 5’end av malen., (B) Polymerase δ (PDBID 3IAY) havner en stor β hårnål motiv (magenta), noe som er viktig i bytte primer strand fra polymerase aktive området til exonuclease aktive området i tilfelle av korrektur. (C) Polymerase ε (PDBID 4M8O) utøver en unik P-domene (lilla), som gir polymerase med økt processivity. Interessant, β hårnål motiv er undertrykket i pol-ε., (D) Bevaring av familien B DNA-polymerase brett og domene organisasjonen, er tydelig når modellen enzym fra bacteriophage RB69 gp43 (PDBID 2OZS) er sett sammen med de tre eukaryote replicative polymerases. Domenet avgrensning for hver polymerase er gitt i Tabell S1. Figuren ble laget med PyMOL (Den PyMOL Molekylær Grafikk System, Versjon 1.5.0.4 Schrödinger, LLC.).
Alle pattedyr B familien DNA polymerases er kjent for å harbor to cystein-rik metall bindende områder (CysA og CysB) i sin C-terminal domene (CTD) (Figur 2)., CysA er antatt å være en sink-bindende nettstedet mens CysB er en jern-svovel-klynge (Netz et al., 2012). Tap av klyngen i CTD av gjær pol δ negativt påvirker interaksjoner med tilbehøret B-subunit (Sanchez Garcia et al., 2004). Sink-bindende motiv ble vist å være viktig for samspillet mellom pol δ med sin processivity faktor, PCNA (Netz et al., 2012).

Figur 2. Skjematisk diagram av de tre Saccharomyces cerevisiae replicative DNA polymerases α, δ, og ε., DNA-polymerase fra bacteriophage RB69 er vist for sammenligning.
DNA-Polymerase α
Den katalytisk subunit av DNA-polymerase α er sammensatt av 1468 aminosyrer (Tabell 2). Protein konstruere designet for krystallisering ble avkortet på N – og C-termini (rester 349-1258), og derfor mangler CTD og sin klynge (Figur 2). Den konstruere ble krystallisert unliganded, i en binær kompleks med en DNA/RNA-hybrid oligonukleotid, og i en trefoldig kompleks med DNA/RNA og innkommende nukleotid (Perera et al., 2013) (Figur 1).,

Tabell 2. Samling av DNA polymerases av B-familien av kjent struktur.
En Mekanisme for Atskillelse av Polymerase
RNA/DNA oligonukleotid fanget i krystaller vedtar En a-form, konformasjon, som forventet. Tommelen domene engasjerer seg i flere interaksjoner med RNA-primer, både via hydrofobe kontakter og polare interaksjoner (Perera et al., 2013)., Eksperimenter i løsningen har vist at utvidelsen av RNA-primer av pol α er begrenset til 10-12 nukleotider, som utgjør en tur på en helix. Denne observasjonen førte forfatterne til å foreslå en ordning for oppsigelse av primer syntese av pol α der tap av spesifikke interaksjoner mellom tommelen og RNA ville utløse polymerase løsner fra DNA/RNA oligonukleotid, og la en hånd av en replicative polymerase.,
Bevegelser i Palm Domene kan legge til Rette Translocation av Pol α
etter å Ha utkrystallisert enzymet i tre stater (apo, binære, og trefoldig) tillatt forfatterne å legge alle tre strukturelle modeller. Pol α er den eneste eukaryote familie B DNA polymerase som alle tre landene var fanget i en krystallstruktur. Den strukturelle superposisjon åpenbart at, i tillegg til godt dokumentert bevegelser i fingrene og tommelen underdomener som følger underlaget bindende og nucleotidyl transfer, palm underdomene seg selv gjennomgår en strukturell omorganisering (Perera et al.,, 2013). Forfatterne foreslår at de ulike conformations av palm domene kan lette translocation av pol α langs og utenfor RNA/DNA tosidig. Som nevnt ovenfor, tap av kontakter til RNA strand er spådd til å utløse frigjøring av primer, som deretter blir tilgjengelige for utvidelse av pol δ eller ε.,
En Annen Protein Fold i Inaktivert Exonuclease Underdomene
korrekturarbeidet aktivitet er avskaffet i pol-α, på grunn av mutasjoner i alle fire carboxylates (Asp114/Glu116/Asp222/Asp327 i RB69 gp43 svarer til Ser542/Gln544/Tyr644/Asn757 i en struktur-basert justering) (Tabell 2). Videre, β-hårnål motiv som finnes i de fleste polymerases av B-familien (rester 246-267 i RB69 gp43) er erstattet av en spiralformet regionen i pol-α (rester 667-676; 681-693) (Hogg et al., 2007)., Den β hårnål er en del av exonuclease domene og har vært vist i T4 og RB69 pols til å delta i en oppdeling av DNA-primer mellom polymerase og exonuclease aktive nettstedet (Rehabilitering-Krantz, 1988; Strømp et al. I 1995; Hogg et al., 2007). I fravær av korrekturlesing aktivitet det er ikke overraskende at dette nå var ikke opptjent i pol-α. Rester Hans 684 og Phe 685 av helical-regionen i pol-α stabel med et innhold av tymin og guanin base, henholdsvis på stillinger -3 og -2 er gruppert i 5’end av malen (Perera et al., 2013)., Dermed, i pol-α regionen tilsvarende til β-hårnål motiv vedtar et annet brett (helices vs. β tråder) og en annen funksjon (stabiliserende gruppert regionen malen strand heller enn å tilrettelegge aktive nettstedet switching). Siden pol α er blottet for korrekturlesing aktivitet oppstår spørsmålet om kort oligonukleotider er rettet opp, og hvis så, hvor DNA-polymerase. Det ser ut til at korrekturlesing av primere syntetisert av pol α er utført av pol δ (Pavlov et al., 2006a).,
DNA-Polymerase δ
Menneskelige pol δ er sammensatt av fire underenhetene mens Saccharomyces cerevisiae har tre (Gerik et al., 1998; Liu et al., 2000) (Tabell 1). I tillegg til dens funksjon i DNA-replikasjon pol δ har vist seg å spille en rolle i DNA-reparasjon og rekombinasjon (Hubscher et al., 2002; Lee et al., 2012; Tahirov, 2012). P12, den minste subunit i menneskelige pol δ og også subunit som ikke er sett i spirende gjær, er dårligere i respons til DNA skade (Lee et al., 2014). Den katalytiske subunit av gjær pol δ (POL3) er sammensatt av 1097 rester., Den konstruere brukes for krystallisering består av rester 67-985 og dermed mangler CTD (Figur 1, Tabell 2).
En Tredje Metal Ion-i-Polymerase Aktive Nettstedet
The palm domene inneholder tre bevart carboxylates (Asp608, Asp762, og Asp764). De to catalytic aspartates, Asp608 og Asp764, ta kontakt med to metall-ioner (Ca2+) i polymerase aktive nettstedet adskilt med 3,7 Å. Intriguingly en tredje metall ble observert koordinert av γ-fosfat av innkommende nukleotid og Glu802, med Glu800 i nærheten., Muterende både glutamates til alanin gitt en polymerase variant med redusert inkorporering effektiviteten for både riktig og feil nukleotider (Swan et al., 2009). På disse aminosyre stillinger -, pol-α-og pol-ε også har kaliumcarboxylaat rester (pol δ Glu800/Glu802 svarer til pol α Asp1033/Asp1035, og pol ε Glu945/Asp947). Om disse carboxylates spille lignende roller i pol-α og ε er fortsatt å bli undersøkt.,
High Fidelity og Korrektur
Menneskelige pol δ er en high-fidelity-polymerase, catalyzing den nucleotidyl overføre reaksjon med en feil frekvens på 1 per 22,000 (Schmitt et al., 2009). Korrekturlesing øker gjengivelse av polymerase med en faktor på 10-100 (Mcculloch og Kunkel, 2008; Prindle et al., 2013). Pol δ havner en polymerase og exonuclease aktive nettstedet, atskilt med ca 45 Å (Swan et al., 2009). DNA polymerases med korrekturlesing aktivitet er i stand til å sanse misincorporated nukleotider ved å kontakte mindre sporet av base par utover innstikkstedet., Protein samhandler med universell hydrogen bond akseptorer på N3 og O2 posisjoner av puriner og pyrimidines, henholdsvis (Seeman et al., 1976; Doublié et al., 1998; Franklin et al., 2001). Disse hydrogen bond-kontakter er bevart når basen par vedtar en Watson-Crick geometri og tapt i tilfelle av et misforhold. I RB69 gp43, kontakter utvide til de to første base par utover den gryende base-par (Franklin et al. I 2001; Hogg et al., 2004, 2005). Kontaktene er mye mer omfattende i pol-δ, utvide til fem base par post-innsetting (Swan et al., 2009), som kan bidra til selskapets high fidelity.
Som nevnt ovenfor, β-hårnål segment fra exonuclease domene spiller en avgjørende rolle i partisjonen av DNA mellom polymerisasjon og korrektur nettsteder i T4 og RB69 pols (Strømp et al. I 1995; Hogg et al., 2007). I RB69 gp43 den β-hårnål motiv vedtar ulike conformations, avhengig av om den komplekse ble oppnådd med uskadet DNA (Franklin et al. I 2001; Zahn et al., 2007) eller DNA som inneholder en skade (Freisinger et al., 2004; Hogg et al., 2004)., Det var fullt visualisert å kontakte både primer og mal trådene i en kompleks med innhold av tymin glykol (Aller et al., 2011). På samme måte β hårnål i pol-δ stikker inn i store sporet av DNA og fungerer som en kile mellom dobbel-strandet DNA og enkelt-strandet 5’end av malen strand, som er stabilisert ved to aromatiske rester Phe441 og Tyr446 (Figur 1) (Swan et al., 2009). Plasseringen av β hårnål er konsistent med en rolle i aktive nettstedet bytte.,
Interdomain Kontakter og Troskap
Mutasjoner som er involvert i kreft er for det meste funnet i exonuclease domenet av pol δ og ε, understreker den viktige rollen korrekturlesing i å redusere forekomsten av mutasjoner (Church et al., 2013; Henninger og Pursell, 2014). En mutasjon i menneskelig kolorektal kreft celler lokaliserer til fingrene, domene, R689W. Den analoge mutasjon i gjær (R696W) resulterer i en mutator fenotypen (Daee et al., 2010)., En mutasjon i nærheten av Arg696 i svært bevart motiv B av fingrene underdomene av gjær pol δ (A699Q) også resulterer i en mutator fenotypen. Denne regionen av fingrene er i umiddelbar nærhet til NTD. Muterende Met540 av NTD til alanin opphever mutator fenotypen av A699Q, for å illustrere samspillet mellom fingrene og NTD kan påvirke gjengivelse av polymerase (Prindle et al., 2013)., På samme måte i T4 og RB69 pols den NPL core motiv, som innebærer rester fra N-terminal og palm domener, er i kontakt med fingrene domene og ble vist å stabilisere polymerase-DNA komplekser (Li et al., 2010).
DNA-Polymerase ε
Den katalytisk subunit av DNA-polymerase ε er et produkt av et svært stort genet (2222 aminosyrer i gjær; 2286 på mennesker), og er bare tredje i størrelse etter polymerase ζ (også medlem av B-familien) og pol θ, en familie, En polymerase (3130 og 2590 aminosyrer, henholdsvis i mennesker) (Lange et al.,, 2011; Hogg og Johansson, 2012) (Figur 1, Tabell 2). Pol ε er dobbelt så stor som pol-δ og er sammensatt av to tandem-polymerase/exonuclease regioner. N-terminal segmentet havner både polymerase og korrektur aktiviteter mens C-terminal segmentet er inaktivert. De to exonuclease-polymerase moduler er distantly i slekt (Tahirov et al., 2009). Selv om det inaktivert segmentet er antatt å spille en strukturell rolle under replikasjon, to gruppene var i stand til å krystallisere catalytically aktiv pol ε konstruksjoner (rester 1-1228; 1-1187) mangler hele C-terminal modul (Hogg et al.,, 2014; Jain et al., 2014a). Både krystallstrukturer var av en trefoldig kompleks av polymerase, DNA-primer/mal og innkommende nukleotid.
En Roman Processivity Domene som Kommer fra Palm Domene
Pol ε skiller seg fra pol δ i at det ikke krever DNA skyve klemme PCNA for høy processivity (Hogg og Johansson, 2012). Palm domenet av pol ε er betydelig større (380 rester) enn i pol-α eller δ (175 og 203 rester, henholdsvis)., Den siste pol ε krystallstrukturer åpenbart at innsettinger i palm domene samlet danner et nytt domene som består av tre β tråder og to helices (rester 533-555; 682-760) (Hogg et al., 2014; Jain et al., 2014a) (Figur 1, Tabell S1). Slette rester 690-751 resulterte i en variant med redusert polymerase aktivitet. Videre, muterende positivt ladet rester (His748, Arg749, og Lys751) ligger i nærheten av fosfat ryggraden påvirket processivity av enzymet (Hogg et al., 2014)., Den ekstra domene som stammer fra håndflaten og ble dermed kåret til processivity eller P-domene, etter sin funksjon. Basen av P domene havner et metall bindende nettstedet (se nedenfor) (Hogg et al., 2014; Jain et al., 2014a,b).
En Jern-Svovel-Klynge innen Polymerase Domene
Uventet løsning studier viste at katalytisk subunit av gjær-polymerase ε i seg selv inneholder en klynge innenfor sine polymerase brett (Jain et al., 2014b), i tillegg til klyngen i CTD (Figur 2, Tabell 2)., Andre klynge innen pol ε tyder på at dette polymerase kan være mer følsomme for oksidativt stress (Jain et al., 2014b). Crystal strukturer av pol ε, men ikke avsløre en klynge i polymerase domene (Hogg et al., 2014; Jain et al., 2014a; Zahn og Doublié, 2014). To av cysteines rester er uryddig i strukturelle modeller og den resulterende metall bindende nettstedet ser ut til å binde sink (Hogg et al., 2014; Jain et al., 2014a). Substitusjon av en av en ikke-innfødt sink i metall-bindende proteiner er ikke uvanlig (Netz et al., 2012) som klynger er labil., Visualisere innen polymerase domenet av pol ε kan nødvendiggjøre anaerobe forhold.
En Kort β-Hårnål Motiv i Exonuclease Domene
I en DNA-polymerase husing både polymerase og exonuclease aktiviteter bundet DNA er i likevekt mellom de to aktive sentre (Beechem et al., 1998). Konsentrasjonen av innkommende nukleotid, og tilstedeværelsen av en skadet base eller mispair er to faktorer som påvirker overføring av DNA fra polymerase aktivere nettstedet til korrekturlesing aktive nettstedet., Polymerases overvåke mindre groove siden av den nylig dannet base-par og samhandle med universal H bond akseptorer, O3, og N2, som en måte å kontrollere for samsvarer ikke (Seeman et al., 1976; Franklin et al., 2001). En unik funksjon i pol ε er kontakten til de store groove siden av den gryende base par via rester fra exonuclease domene, Tyr431. Videre analyse er berettiget til å belyse de potensielle rolle i denne tyrosin i high fidelity av pol ε.,
I pol-δ den β-hårnål segmentet setter seg selv i DNA, og fungerer som en kile mellom enkelt-strandet og dobbel-strandet DNA (Swan et al., 2009). I E. coli DNA pol II, innsetting av en β fat skifter posisjon av β hårnål på en slik måte at polymerisering er foretrukket over korrekturlesing (Wang og Yang, 2009). Denne modifikasjon antagelig gjør dette polymerase å gjennomføre translesion syntese extension., Siden pol ε er en nøyaktig DNA-polymerase forutsetningen før kunnskap av krystall struktur vil være at β hårnål bør være nærmere pol δ enn E. coli Pol II. Overraskende, β-hårnål motiv i pol-ε er avkortet, for kort til å kontakte DNA (Figur 1). Som protein motiv, da, kan være å tilrettelegge aktive nettstedet slå på sensing av en mispair? P-domene er en god kandidat, på grunn av sine kontakter til både primer og mal tråder; reststoffer fra P domene kunne kjenne replikering feil og dermed kan bidra til å gjøre aktive nettstedet bytte.,
Konklusjon
Alle tre eukaryote replicative DNA polymerases bruke en vanlig B-familien brett, og hver polymerase har innarbeidet endrede strukturelle elementer som er unike og som er skreddersydd for hver polymerase er bestemt funksjon (for eksempel tillegg av processivity domene i pol-ε, en processive polymerase som ikke bruker PCNA, eller endret regionen kontakte 5’end av malen i pol-α, en polymerase blottet for korrekturlesing aktivitet). Fold av B-familien polymerases er godt egnet for high-fidelity, replicative polymerases., Men overraskende er det også brukt av translesion polymerases. Eukaryote pol ζ (eller REV3L) er en 353 kDa polymerase hvilke funksjoner i translesion syntese og ser ut til å undertrykke tumorigenesis (Wittschieben et al., 2010; Lange et al., 2011; Zahn et al., 2011; Hogg og Johansson, 2012; Sharma et al., 2013). Strukturen av E. coli Pol II avdekket endringer i NTD som påvirker plasseringen av β hårnål av exonuclease domene, og dermed oppdeling av DNA mellom polymerisasjon og korrektur nettsteder (Wang og Yang, 2009)., Strukturen av pol ζ kan avsløre lignende justeringer, som endrer brett ansatt av high-fidelity, replicative polymerases til å gjengi enzymet mindre trofaste og i stand til å utføre translesion syntese.
interessekonflikt Uttalelse
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller finansielle forhold som kan oppfattes som en potensiell interessekonflikt.
Svar
Dette arbeidet ble støttet av et stipend fra National Institutes of Health (NCI R01 CA 52040).
















Legg igjen en kommentar