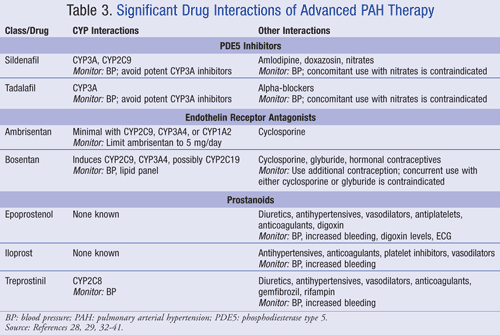
antagonistes des récepteurs de L’endothéline: L’endothéline-1(ET-1) est un puissant vasoconstricteur et stimulateur de la prolifération des cellules musculaires lisses artérielles pulmonaires. Les niveaux plasmatiques d’ET-1 sont corrélés à une gravité accrue et à une aggravation du pronostic de L’HTAP. Les antagonistes Endothelinreceptor, tels que le bosentan (Tracleer) et l’ambrisentan(Letairis), agissent en inhibant de manière compétitive L’ET-1 des récepteurs bindingendothelin pour diminuer la résistance vasculaire pulmonaire.,Il a été démontré que le 14 Bosentan a plus d’interactions médicamenteuses que l’ambrisentan.31 la Cyclosporine est contre-indiquée avec le bosentan, et l’efficacité de la contraception hormonale peut être réduite avec le bosentan.32,33 L’utilisation concomitante de bosentan et de glyburide est également contre-indiquée en raison de leur potentiel induisant le CYP3A4, ce qui entraîne une augmentation du niveau plasmatique des deux médicaments.32,34 lorsque le bosentan et le sildénafil sont donnés simultanément, les niveaux de bosentan peuvent augmenter et les niveaux de sildénafil peuvent diminuer, bien que des ajustements posologiques puissent ne pas être nécessaires.,32à ce jour, ambrisentan est associé à une interaction cliniquement significative. En cas d’utilisation avec la cyclosporine, ambrisentan doit être limité à 5 mg par jour.35,36
compte tenu du risque de lésions hépatiques et de dommages tératogènes(Catégorie X de grossesse), bosentan et ambrisentan ne sont disponibles que par le biais du programme Tracleer Access et du programme Letairis Education et AccessProgram, respectivement.32,36
prostanoïdes: la prostacycline synthase est réduite chez les patients atteints d’HTAP. En conséquence, la production de prostacycline (PGI2), un vasodilatateur ayant des effets antiprolifératifs, est insuffisante.,14 Patients atteints d’HTAP sont traités avec des prostanoïdes pour remplacer la prostacycline dans le système vasculaire artériel pulmonaire.37 Les prostanoïdes induisent une vasodilatation artérielle pulmonaire, entravent la croissance des cellules musculaires lisses et perturbent l’agrégation plaquettaire.37
Plusieurs prostanoïdes sont disponibles. Iloprost (Ventavis) est inhalé en utilisant le système AAD I-neb ou le système AAD Prodose.37,38 Treprostinil (Tyvaso) est un autre prostanoïde qui peut être administré parinhalation. À ce jour, il n’y a pas d’études pharmacocinétiques avec inhalétreprostinil., Le potentiel d’interaction médicamenteuse est basé sur ce qui est connu avec le tréprostinil oral ou injecté (Remoduline). Prostanoids availablepour l’administration parentérale incluent epoprostenol (generic, Flolan,Veletri) et trepostinil (Remodulin). L’époprosténol est administré sous forme de pompe à perfusion intraveineuse continue en raison de sa courte demi-vie de 2,7 minutes.39il a été le premier prostanoïde largement utilisé et a été montré pour dilater efficacement les artères pulmonaires, réduire les symptômes de L’HTAP et offrir un bénéfice de survie.,37 Le Treprostinil peut être administré en perfusion anSC ou en perfusion as IV chez les patients présentant une irritation indolable due à L’administration de SC. Un ajustement posologique d’oftrepostinil peut être nécessaire lorsqu’il est utilisé avec gemfibrozil orrifampin.40,41
un résumé des interactions médicamenteuses des traitements avancés de L’HTAP est présenté dans le tableau 3.28,29,32-41
rôle du pharmacien
le traitement de l’HTAP implique un médicament complexe., Les pharmaciens en milieu hospitalier et communautaire peuvent aider les patients à comprendre le besoin de différents types de médicaments et de thérapies non pharmacologiques. En appliquant de manière appropriée les informations provenant de l’étiquetage des emballages, des bases de données sur les médicaments, des rapports post-commercialisation et des avis FDAMedWatch, les pharmaciens peuvent aider à déterminer l’importance clinique des interactions médicamenteuses des thérapies par HTAP et la nécessité d’ajuster les médicaments. Les pharmaciens peuvent également intégrer d’autres médicamentsdans le plan de pharmacothérapie.
bien que L’HTAP soit une maladie rare et mortelle, le pronostic s’est amélioré avec l’élargissement des options thérapeutiques., De nouveaux médicaments sont endéveloppement, tel que Selexipag (ACT-293987).42 Les Pharmaciensavec des connaissances spécialisées sur les médicaments sont bien positionnés pourformer la surveillance des médicaments, ce qui peut prévenir les événements indésirables et ultimement optimiser les soins aux patients.
1. Badesch DB, Abman SH, Simonneau G, et coll. Medicaltherapy pour l’hypertension artérielle pulmonaire: lignes directrices de pratique clinique fondées sur des preuves ACCP mises à jour. Poitrine. 2007;131:1917-1928.
2. Hoeper MM. définition, classification et épidémiologie de l’hypertension artérielle pulmonaire. Semin Respir Crit Soins Med. 2009;30:369-375.
3., Frost AE, Badesch DB, Barst RJ, et coll. L’image changeante des patients souffrant d’hypertension artérielle pulmonaire aux États-Unis: Comment REVEAL diffère des enregistrements contemporains historiques et non américains. Poitrine. 2011;139:128-137.
4. Galie N, Hoeper MM, Humbert M, et coll. Lignes directrices pour le diagnostic et le traitement de l’hypertension pulmonaire. EUR Coeur J. 2009; 30: 2493-2537.
5. Badesch DB, Raskob GE, Elliott CG, et coll. Hypertension artérielle pulmonaire: caractéristiques de base de la Révèlerégistry. Poitrine. 2010;137:376-387.
6. Simonneau G, Robbins IM, Beghetti M, et coll., Classification clinique mise à jour de l’hypertension pulmonaire. J Am Coll Cardiol. 2009; 54 (supplément 1): S43-S54.
7. Yuan JX, Rubin LJ. Pathogenèse de l’hypertension artérielle pulmonaire: la nécessité de plusieurs coups. Circulation. 2005;111:534-538.
8. Lane KB, Machado RD, Pauciulo MW, et coll. Les mutations hétérozygotes de la germline dans BMPR2, codant pour un récepteur TGF-bêta, provoquent une hypertension pulmonaire primaire familiale. Nat Genet 2000; 26:81-84.
9. Deng Z, Morse JH, Slager SL, et coll. L’hypertension primairepulmonaire familiale (gène PPH1) est causée par des mutations dans le gène du récepteur de la protéine bonemorphogenetic–II., Am J Hum Genet. 2000;67:737-744.
10. Girerd B, Montani D, Coulet F, et coll. Clinicaloutvomes de l’hypertension artérielle pulmonaire chez les patients porteurs de la mutation anACVRL1 (ALK1). Am J Respir Crit Care Med. 2010;181:851-861.
11. Harrison RE, Berger R, Haworth SG, et coll. Transforminggrowth factor-mutations du récepteur bêta et hypertension artérielle pulmonaire dans l’enfance. Circulation. 2005;111:435-441.
12. Gurney AM, Joshi S, Manoury B. kcnq canaux potassiques: nouvelles cibles pour les médicaments vasodilatateurs pulmonaires? Adv Exp Med Biol. 2010;661:405-417.
13. Kuhr FK, Smith KA, chanson Mon, et al., Nouveaux mécanismes de l’hypertension artérielle pulmonaire: rôle de la signalisation Ca2+. Am J Physiol Coeur Circ Physiol. 2012; 302: H1546-H1562.
14. McLaughlin VV, Archer SL, Badesch DB, et coll. ACCP / AHA 2009 document de consensus d’experts sur l’hypertension pulmonaire. J Am Coll Cardiol. 2009;53:1573-1619.
15. Coumadin (warfarine) notice d’emballage. Princeton, NJ: Bristol-Myers Squibb Co; octobre 2011.
16. Rubin LJ. Hypertension pulmonaire primaire. N Engl J Med. 1997;336:111-117.
17. Bumex (bumétanide) notice d’emballage. Parsippany, New Jersey. Validus Pharmaceuticals LLC; septembre 2009.
18., Lasix (furosemide) package insert. Bridgewater, NJ: Sanofi-Aventis LLC; August 2011.
19. Demadex (torsemide) package insert. Somerset, NY: Meda Pharmaceuticals, Inc; February 2010.
20. Aldactone (spironolactone) package insert. New York, NY: Pfizer, Inc; January 2008.
21. Micromedex . GreenwoodVillage, CO: Truven Health Analytics, Inc. Updated periodically.www.micromedexsolutions.com. Accessed March 16, 2013.
22. Lexicomp . Hudson, OH:Lexi-Comp, Inc. Updated periodically. http://online.lexi.com. AccessedMarch 16, 2013.
23. Pitt B, Zannad F, Remme WJ., L’effet de la spironolactone sur la morbidité et la mortalité chez les patients atteints d’insuffisance cardiaque sévère. N Engl J Med. 1999:341:709-717.
le 24. Digoxin package insert. Columbus, OH: Roxane Laboratories, Inc; septembre 2012.
25. Procardia XL (nifédipine) notice d’emballage. New York, NY: Pfizer, Inc; août 2011.
26. Cardizem (diltiazem) notice d’emballage. Bridgewater, NJ: BTA Pharmaceuticals, Inc; novembre 2009.
27. Norvasc (amlodipine) notice d’emballage. Recherche Triangle Park, NC: Synthon Pharmaceuticals, Inc; septembre 2007.
28. Revatio (sildénafil) notice d’emballage., New York, NY: Pfizer Inc; août 2012.
29. Adcirca (tadalafil) notice d’emballage. Indianapolis, IN: Eli Lilly and Company; mars 2012.
30. Muirhead GJ, Wulff MB, Fielding A, et coll. Interactions pharmacocinétiques entre le sildénafil et le saquinavir/ritonavir. Br J Clin Pharmacol. 2000;50:99-107.
le 31. Weiss J, Herzog M, Haefeli NOUS. Modulation différentielle de l’expression d’enzymes et de transporteurs métabolisants importants de médicaments par les antagonistes des récepteurs de l’endothéline-1 ambrisentan andbosentan in vitro. Eur J de Pharmacol. 2011;660:298-304.
32. Tracleer (bosentan) notice d’emballage., Sud de San Francisco, CA: Actelion Pharmaceuticals; octobre 2012.
33. Treiber A, Schneiter R, Hausler s, et coll. Bosentan est asubstrate de OATP1B1 et OATP1B3 humains: inhibition de l’absorption hépatique asthe mécanisme commun de ses interactions avec la cyclosporine A, la rifampicine, et le sildénafil. Médicaments Metab Dispos. 2007;35:1400-1407.
34. van Giersbergen PL, Treiber A, Clozel M, et al. Invivo et études in vitro explorant l’interaction pharmacocinétique entre le bosentan, un antagoniste double des récepteurs de l’endothéline, et le glyburide. Clin Pharmacol Ther. 2002;71:253-262.
35. Frampton JE. Ambrisentan., Am J Cardiovasc Médicaments. 2011;11:215-226.
36. Letairis (ambrisentan) notice d’emballage. Foster City, Californie: Gilead Sciences; octobre 2012.
37. Mgr BM, Mauro VF, Khouri SJ. Considérations pratiques pour la pharmacothérapie de l’hypertension artérielle pulmonaire. Pharmacothérapie. 2012;32:838-855.
38. Ventavis (solution pour inhalation d’iloprost) notice d’emballage. Sud de San Francisco, CA: Actelion Pharmaceuticals; août 2012.
39. Veletri (epoprostenol pour injection) notice d’emballage. Sud de San Francisco, CA: Actelion Pharmaceuticals; juin 2012.
40., Tyvaso (solution pour inhalation de trepostinil) packageinsert. Recherche Triangle Park, NC: United Therapeutics Corp; February2011.
41. Remoduline (trepostinil injection) notice. Recherche Triangle Park, Caroline du Nord: United Therapeutics Corp; février 2011.
42. Selexipag (ACT-293987) dans l’hypertension artérielle pulmonaire, essai GRIPHON. ClinicalTrials.gov. http://clinicaltrials.gov/show/NCT01106014. Consulté Le 16 Septembre 2013.
















Laisser un commentaire