Mit zunehmender Temperatur steigt auch die Geschwindigkeit der Enzymreaktionen. Ein Temperaturanstieg von zehn Grad Celsius erhöht die Aktivität der meisten Enzyme um 50% bis 100%. Schwankungen der Reaktionstemperatur von nur 1 oder 2 Grad können zu Änderungen von 10% bis 20% in den Ergebnissen führen. Dieser Anstieg ist nur bis zu einem bestimmten Punkt, bis die erhöhte Temperatur die Struktur des Enzyms bricht. Sobald das Enzym denaturiert ist, kann es nicht mehr repariert werden., Da jedes Enzym in seiner Struktur und Bindung zwischen Aminosäuren und Peptiden unterschiedlich ist, ist die Temperatur für die Denaturierung für jedes Enzym spezifisch. Da die meisten tierischen Enzyme bei Temperaturen über 40°C schnell denaturiert werden, werden die meisten Enzymbestimmungen etwas unterhalb dieser Temperatur durchgeführt.
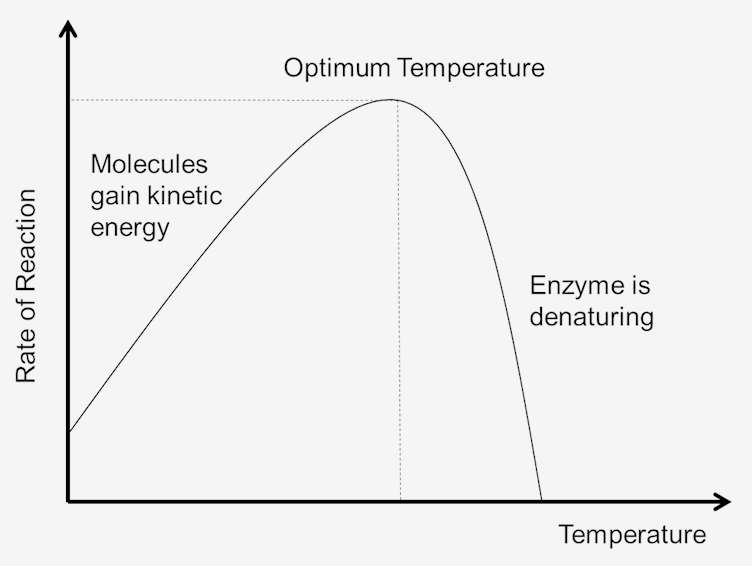 Abbildung 1. Auswirkung der Temperatur auf die Reaktionsgeschwindigkeit.
Abbildung 1. Auswirkung der Temperatur auf die Reaktionsgeschwindigkeit.
Enzyme werden über einen bestimmten Zeitraum auch bei moderaten Temperaturen deaktiviert. Die Lagerung von Enzymen bei 5°C oder darunter ist im Allgemeinen am besten geeignet. Niedrigere Temperaturen führen zu langsameren chemischen Reaktionen., Enzyme werden schließlich bei Gefriertemperaturen inaktiv, stellen jedoch den größten Teil ihrer Enzymaktivität wieder her, wenn die Temperaturen wieder steigen, während einige Enzyme ihre Aktivität verlieren, wenn sie eingefroren werden.
Kinetische Energie und innere Energie
Die Temperatur eines Systems ist in gewissem Maße ein Maß für die kinetische Energie der Moleküle im System. Kollisionen zwischen allen Molekülen nehmen mit zunehmender Temperatur zu. Dies ist auf die Zunahme der Geschwindigkeit und der kinetischen Energie zurückzuführen, die auf Temperaturerhöhungen folgt. Bei schnelleren Geschwindigkeiten bleibt weniger Zeit zwischen den Kollisionen., Dies führt dazu, dass mehr Moleküle die Aktivierungsenergie erreichen, was die Reaktionsgeschwindigkeit erhöht. Da sich die Moleküle auch schneller bewegen, nehmen auch die Kollisionen zwischen Enzymen und Substraten zu. Je niedriger also die kinetische Energie ist, desto niedriger ist die Temperatur des Systems und je höher die kinetische Energie, desto größer ist die Temperatur des Systems.
Wenn die Temperatur des Systems erhöht wird, erhöht sich die innere Energie der Moleküle im System., Die innere Energie der Moleküle kann die Translationsenergie, Schwingungsenergie und Rotationsenergie der Moleküle, die Energie, die an der chemischen Bindung der Moleküle beteiligt ist, sowie die Energie, die an nichtbondenden Wechselwirkungen beteiligt ist, umfassen. Ein Teil dieser Wärme kann in chemische Potentialenergie umgewandelt werden. Wenn diese chemische potentielle Energieerhöhung groß genug ist, können einige der schwachen Bindungen, die die dreidimensionale Form der aktiven Proteine bestimmen, gebrochen werden. Dies könnte zu einer thermischen Denaturierung des Proteins führen und somit das Protein inaktivieren., Somit kann zu viel Wärme dazu führen, dass die Geschwindigkeit einer enzymkatalysierten Reaktion abnimmt, da das Enzym oder Substrat denaturiert und inaktiv wird.
Optimale Temperatur
Jedes Enzym hat einen Temperaturbereich, in dem eine maximale Reaktionsgeschwindigkeit erreicht wird. Dieses Maximum wird als Temperaturoptimum des Enzyms bezeichnet. Die optimale Temperatur für die meisten Enzyme beträgt etwa 98,6 Grad Fahrenheit (37 Grad Celsius). Es gibt auch Enzyme, die bei niedrigeren und höheren Temperaturen gut funktionieren., Zum Beispiel haben arktische Tiere Enzyme, die an niedrigere optimale Temperaturen angepasst sind; Tiere in Wüstenklimata haben Enzyme, die an höhere Temperaturen angepasst sind. Enzyme sind jedoch immer noch Proteine, und wie alle Proteine beginnen sie bei Temperaturen über 104 Grad Fahrenheit abzubauen. Daher wird der Bereich der Enzymaktivität durch die Temperatur bestimmt, bei der das Enzym zu aktivieren beginnt, und die Temperatur, bei der das Protein zu zersetzen beginnt.,
Verwandte Dienstleistungen
Enzymkinetik
Enzymologie-Assays
Um weitere Servicedetails zu besprechen, kontaktieren Sie uns bitte unter 1-631-562-8517 oder per E-Mail an [email protected].
















Schreibe einen Kommentar