| Die University of Sheffield | |
| Department für Chemie | VSEPR |
Ammoniak hat auch vier Elektronenpaare und die Koordination der geometrie von Stickstoff basiert auf einer tetraedrischen Anordnung der Elektronenpaare. Es gibt nur drei gebundene Gruppen, daher gibt es ein einsames Paar. Da die einsamen Paare jedoch „unsichtbar“ sind, ist die Form von Ammoniak pyramidenförmig.,r>
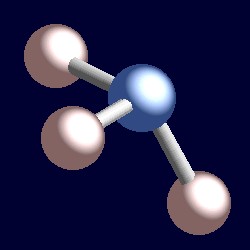
Betrachten Sie ein Bindungspaar von Elektronen. Die beiden Elektronen befinden sich zwischen zwei Kernen und werden von beiden angezogen. Ein einsames Paar ist anders. Es wird notwendigerweise nur von einem Kern angezogen und die Folge ist, dass es eine Position einnimmt, die effektiv näher an diesem einen Kern liegt als die Verbindungspaare von Elektronen. Dies bedeutet, dass der effektive feste Winkel, den ein einzelnes Paar einnimmt, größer ist als der eines Bondpaares., Einzelne Paare benötigen einen größeren Winkelraum und befinden sich näher an ihren Atomen als Bindungspaare. Die Folge davon für Ammoniak ist, dass das einsame Paar Platz für sich selbst schafft, indem es die drei Wasserstoffatome ein wenig zusammendrückt und die H-N-H-Bindungswinkel etwas geringer sind (106,6°) als der ideale tetraedrische Winkel von 109,5°.
















Schreibe einen Kommentar