Denken Sie daran, was auf halbem Weg durch den Farbwechsel passiert. An diesem Punkt sind die Konzentrationen der Säure und ihres Ions gleich. In diesem Fall werden sie den Kind-Ausdruck abbrechen.
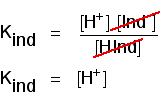
Sie können dies verwenden, um herauszufinden, was der pH-Wert an diesem halben Punkt ist., Wenn Sie die letzte Gleichung so anordnen, dass sich die Konzentration der Wasserstoffionen auf der linken Seite befindet, und dann in pH und pKind konvertieren, erhalten Sie:
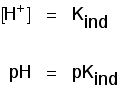
Das bedeutet, dass der Endpunkt für den Indikator vollständig davon abhängt, was sein pKind Wert ist. Für die Indikatoren, die wir angeschaut haben vor, diese sind:
| Indikator | pKind |
|---|---|
| Lackmus | 6.5 |
| methyl orange | 3.7 |
| phenolphthalein | 9.,3 |
Der pH-Bereich der Indikatoren
Die Indikatoren ändern ihre Farbe bei einem bestimmten pH-Wert nicht stark (angegeben durch ihre pKind). Stattdessen ändern sie sich über einen engen pH-Bereich.
Angenommen, das Gleichgewicht ist fest auf einer Seite, aber jetzt fügen Sie etwas hinzu, um es zu verschieben. Wenn sich das Gleichgewicht verschiebt, wird immer mehr von der zweiten Farbe gebildet, und irgendwann fängt das Auge an, sie zu erkennen.
Angenommen, Sie hatten Methylorange in einer alkalischen Lösung, so dass die dominierende Farbe gelb war., Beginnen Sie nun, Säure hinzuzufügen, damit sich das Gleichgewicht zu verschieben beginnt.
Irgendwann wird genug von der roten Form der Methylorange vorhanden sein, dass die Lösung einen orangefarbenen Farbton annimmt. Wenn Sie mehr Säure hinzufügen, wird das Rot schließlich so dominant, dass Sie kein Gelb mehr sehen können.
Über einen pH-Bereich findet ein allmählicher sanfter Wechsel von einer Farbe zur anderen statt.Als grobe „Faustregel“ gilt, dass die sichtbare Veränderung etwa 1 pH-Einheit auf beiden Seiten des pKind-Wertes erfolgt.,
Die genauen Werte für die drei Indikatoren, die wir uns angesehen haben, sind:
| Indikator | pKind | pH – Bereich |
|---|---|---|
| Lackmus | 6.5 | 5 – 8 |
| Methylorange | 3.7 | 3,1 – 4,4 |
| Phenolphthalein | 9,3 | 8,3-10,0 |
Die Lackmusfarbe ändert sich über einen ungewöhnlich breiten Bereich, ist jedoch nützlich, um Säuren und Laugen im Labor zu erkennen, da sie ihre Farbe um den pH-Wert 7 ändert., Methylorange oder Phenolphthalein wären weniger nützlich.
Dies ist schematischer zu sehen.
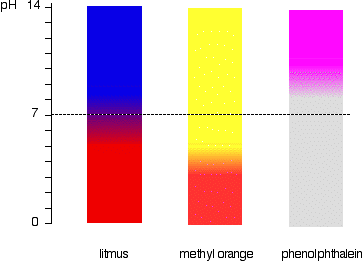
Methylorange wäre beispielsweise in jeder Lösung mit einem pH-Wert von mehr als 4,4 gelb. Es konnte nicht zwischen einer schwachen Säure mit einem pH-Wert von 5 oder einem starken Alkali mit einem pH-Wert von 14 unterscheiden.
Indikatoren für Titrationen auswählen
Denken Sie daran, dass der Äquivalenzpunkt einer Titration der Ort ist, an dem Sie die beiden Substanzen in genau gleichen Anteilen gemischt haben., Sie müssen natürlich einen Indikator auswählen, der die Farbe so nah wie möglich an diesem Äquivalenzpunkt ändert. Das variiert von Titration zu Titration.
Starke Säure v starke Base
Das nächste Diagramm zeigt die pH-Kurve zum Hinzufügen einer starken Säure zu einer starken Base. Überlagert sind die pH-Bereiche für methylorange und phenolphthalein.
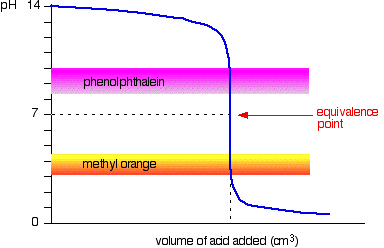
Sie können sehen, dass keiner der Indikatoren die Farbe am Äquivalenzpunkt ändert.,
Die Grafik ist an diesem Punkt jedoch so steil, dass es praktisch keinen Unterschied in der Menge der hinzugefügten Säure gibt, je nachdem, welchen Indikator Sie wählen. Es wäre jedoch sinnvoll, mit jedem Indikator auf die bestmögliche Farbe zu titrieren.
Wenn Sie Phenolphthalein verwenden, würden Sie titrieren, bis es einfach farblos wird (bei pH 8.3), da dies so nah ist, wie Sie zum Äquivalenzpunkt gelangen können.
Andererseits würden Sie mit Methylorange titrieren, bis die allererste Spur von Orange in der Lösung vorhanden ist., Wenn die Lösung rot wird, kommen Sie vom Äquivalenzpunkt weiter.
Starke Säure v schwache base
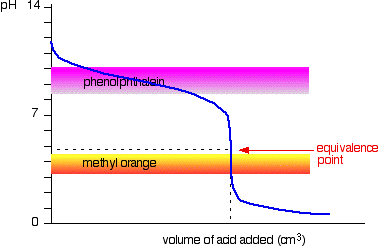
Dieses mal ist es offensichtlich, dass phenolphthalein wäre völlig nutzlos. Methylorange beginnt sich jedoch sehr nahe am Äquivalenzpunkt von Gelb in Orange zu ändern.
Sie müssen einen Indikator auswählen, der die Farbe auf dem steilen Teil der Kurve ändert.
Schwache Säure v starke Base
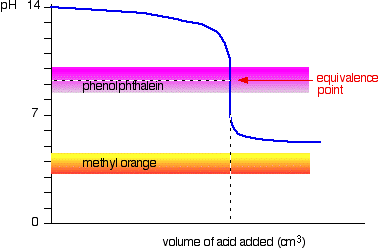
Diesmal ist die Methylorange hoffnungslos!, Allerdings ändert das Phenolphthalein Farbe genau dort, wo Sie es wollen.
Schwache Säure v schwache Base
Die Kurve gilt für einen Fall, in dem Säure und Base gleichermaßen schwach sind – beispielsweise Ethansäure und Ammoniaklösung. In anderen Fällen liegt der Äquivalenzpunkt bei einem anderen pH-Wert.
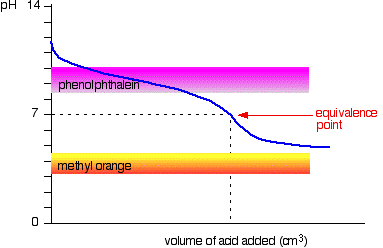
Sie können sehen, dass keiner der beiden Indikatoren verwendet wird. Phenolphthalein wird sich vor dem Äquivalenzpunkt gut verändert haben, und Methylorange fällt vollständig vom Graphen ab.,
Es kann möglich sein, einen Indikator zu finden, der sich am Äquivalenzpunkt zu ändern beginnt oder endet, aber da sich der pH-Wert des Äquivalenzpunkts von Fall zu Fall unterscheidet, können Sie ihn nicht verallgemeinern.
Insgesamt würden Sie niemals eine schwache Säure und eine schwache Base in Gegenwart eines Indikators titrieren.
Natriumcarbonatlösung und verdünnte Salzsäure
Dies ist ein interessanter Sonderfall., Wenn Sie Phenolphthalein oder Methylorange verwenden, ergeben beide ein gültiges Titrationsergebnis – aber der Wert mit Phenolphthalein beträgt genau die Hälfte des Methylorangenwerts.
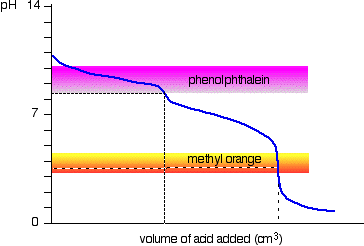
Es kommt also vor, dass das Phenolphthalein seine Farbänderung genau am pH-Wert des Äquivalenzpunktes der ersten Hälfte der Reaktion beendet hat, in der Natriumhydrogencarbonat hergestellt wird.
![]()
![]()
Die Methylorange ändert ihre Farbe genau am pH-Wert des Äquivalenzpunktes der zweiten Reaktionsstufe.,
![]()
![]()
Fragen um Ihr Verständnis zu testen
Wenn dies der erste Satz von Fragen, die Sie getan haben, lesen Sie bitte die Einführungsseite, bevor Sie beginnen. Sie müssen die SCHALTFLÄCHE ZURÜCK in Ihrem Browser verwenden, um danach hierher zurückzukehren.
Fragen zu Indikatoren
Antworten
Wohin möchten Sie jetzt gehen?
Zum Säure-Basen-Gleichgewicht-Menü . . .
Zum Menü Physikalische Chemie . . .
Zum Hauptmenü . . .,
















Schreibe einen Kommentar