Management der mütterlichen Alloimmunisierung
In der Regel werden serielle mütterliche Antikörpertiter bis zu einem kritischen Titer von 1:32 überwacht, was darauf hinweist, dass ein hohes Risiko für fetale Hydrops erreicht wurde. Zu diesem Zeitpunkt muss der Fötus sehr intensiv auf Anzeichen von Anämie und fetalen Hydrops überwacht werden., Bei der Kell-Alloimmunisierung können Hydrops aufgrund unterdrückter Erythropoese bei niedrigen mütterlichen Titern auftreten, und daher wurde ein Titer von 1:8 als kritisch vorgeschlagen. Daher sind Delta-OD 450-Werte auch bei der Vorhersage des Schweregrads der Erkrankung bei der Kell-Alloimmunisierung unzuverlässig.
Mütterliche Titer sind nicht nützlich, um den Beginn der fetalen Anämie nach der ersten betroffenen Schwangerschaft vorherzusagen. Bei demselben Patienten können große Titerunterschiede zwischen verschiedenen Labors festgestellt werden, und eine neuere Geltechnik führt zu höheren Titerergebnissen als bei der älteren Röhrchenmethode., Daher sollte eine Standardrohrmethode verwendet werden, um den kritischen Titer zu bestimmen, und eine Änderung von mehr als einer Verdünnung stellt einen echten Anstieg des mütterlichen Antikörpertiters dar. Für alle Antikörper, die für die hämolytische Erkrankung des Neugeborenen (HDN) verantwortlich sind, wird ein 4-facher Anstieg eines Antikörpertiters typischerweise als signifikante Veränderung angesehen, die eine fetale Bewertung erfordert.
Wenn angezeigt, kann eine Amniozentese bereits nach 15 Schwangerschaftswochen durchgeführt werden (in der ersten betroffenen Schwangerschaft vor 24 Schwangerschaftswochen selten erforderlich), um den fötalen Genotyp zu bestimmen und den Schweregrad zu beurteilen., Mütterliche und väterliche Blutproben sollten mit einer Fruchtwasserprobe an das Referenzlabor geschickt werden, um falsch positive Ergebnisse (vom Pseudogen-oder Ccde-Gen der Mutter) und falsch negative Ergebnisse (von einer Umlagerung am RHD-Genort beim Vater) zu eliminieren.
Die Bestimmung des fetalen Rh-Genotyps im mütterlichen Plasma ist in vielen europäischen Ländern zur Routine geworden und wird in den USA angeboten., Fetale zellfreie DNA macht 3% der gesamten zirkulierenden mütterlichen Plasma-DNA aus, wird bereits nach 38 Tagen der Schwangerschaft gefunden und stammt aus der Apoptose der Plazenta-Zytotrophoblastenschicht. Die mittlere Halbwertszeit der zirkulierenden fetalen DNA beträgt im Durchschnitt weniger als 30 Minuten, und das mütterliche Plasma wird vor dem Test einer Filtration und Mikrozentrifugation unterzogen, um alle zellulären Elemente zu entfernen. Dies eliminiert falsch positive Ergebnisse aus in Handarbeit gemachten fetalen Zellen früherer Schwangerschaften in mütterlichen lymphatischen Organen.,
Zellfreie fetale DNA wird einer Echtzeit-Polymerase–Kettenreaktion (PCR) auf das Vorhandensein RHD-genspezifischer Sequenzen unterzogen und hat sich in 99,5% der Fälle als genau erwiesen. Das SRY-Gen (im männlichen Fötus) und DNA-Polymorphismen in der Allgemeinbevölkerung (im weiblichen Fötus) werden als interne Kontrollen verwendet, um den fetalen Ursprung der zellfreien DNA zu bestätigen. Ein Panel von 92 Einzelnukleotidpolymorphismen (SNPs) wird zwischen mütterlicher Probe aus Buffy Coat und Plasma verglichen., Ein Unterschied von mehr als 6 SNPs bestätigt das Vorhandensein von fetaler DNA und die Gültigkeit des Tests bei einem weiblichen Fötus. Falsch-negative Ergebnisse, die höchst unerwünscht und folgerichtig sind, sind auf partielle oder schwache D-Phänotypen zurückzuführen. Sie werden mithilfe von mindestens zwei RHD-spezifischen Exon-Primern erkannt und in Duplikaten ausgeführt.
Glücklicherweise erwiesen sich auch zellfreie fetale DNA-Tests zur Bestimmung des Genotyps für andere rote Blutkörperchen-Antigene wie c, C, e, E und Kell als sehr zuverlässig und genau.,
Die serielle Amniozentese wird in Abständen von 10-14 Tagen begonnen, um die Schwere der Erkrankung beim Fötus zu überwachen. Alle Versuche sollten unternommen werden, um eine transplazentare Nadelpassage zu vermeiden, die zu fetomaternalen Blutungen (FMH) und einem weiteren Anstieg des Antikörpertiters führen kann. Serielle Delta-OD 450-Werte werden auf dem Queenan-Diagramm oder dem Extended Liley-Diagramm dargestellt, um das Risiko von fetalen Hydrops zu bewerten. Frühe Sonographie wird durchgeführt, um das richtige Gestationsalter festzustellen., Häufige sonographische Überwachung wird auch durchgeführt, um das Wohlbefinden des Fötus zu beurteilen und moderate Anämie und frühe Anzeichen von Hydrops zu erkennen.
Die Peak Systolic Middle cerebral artery (MCA) Doppler Velocity hat sich als zuverlässiges Screening-Tool zum Nachweis einer fetalen Anämie erwiesen und die Amniozentese ersetzt. Der MCA wird leicht mit Color-Flow Doppler visualisiert; gepulster Doppler wird dann verwendet, um die maximale systolische Geschwindigkeit nur distal zu seiner Gabelung von der inneren Halsschlagader zu messen., Da die MCA-Geschwindigkeit mit zunehmendem Gestationsalter zunimmt, wird das Ergebnis in Vielfachen des Medians (Mütter) berichtet. In neueren Studien hat sich gezeigt, dass die Empfindlichkeit für den Nachweis einer mittelschweren und schweren fetalen Anämie 100% beträgt, mit einer falsch positiven Rate von 10% bei 1,5 MOM. Es hat sich gezeigt, dass der Bedarf an invasiven diagnostischen Verfahren wie Amniozentese und Cordozentese um mehr als 70% reduziert wird.
MCA-Doppler-Studien können bereits nach 18 Schwangerschaftswochen begonnen werden, sind jedoch nach 35 Schwangerschaftswochen nicht zuverlässig., Es wurde auch verwendet, um die nachfolgende fetale Transfusion zu bestimmen und Anämie aus mehreren Ursachen zu diagnostizieren, z. B. bei Zwillingstransfusionen. Die MCA-Steigung von 3-wöchentlichen Messwerten wird jetzt verwendet, um das fetale Risiko für schwere Anämie vorherzusagen (siehe Bild unten).
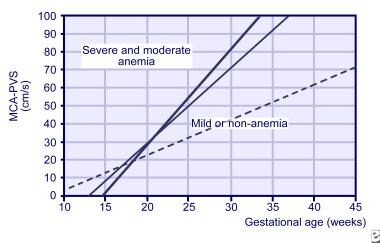 Steigungen für die höchste systolische Geschwindigkeit in der mittleren Hirnarterie (MCA) für normale Föten (gepunktete Linie), leicht anämische Föten (dünne Linie) und stark Anämie Föten (dicke Linie).,
Steigungen für die höchste systolische Geschwindigkeit in der mittleren Hirnarterie (MCA) für normale Föten (gepunktete Linie), leicht anämische Föten (dünne Linie) und stark Anämie Föten (dicke Linie)., Mit dem Erwerb von Erfahrung in der Durchführung von MCA-Doppler-Studien wurde die serielle Amniozentese zum Nachweis einer fetalen Anämie in geringerem Maße verwendet.
Während der Zeit, in der die intrauterine Peritonealtransfusion das einzige Behandlungsmittel war, wurden Neugeborene routinemäßig nach 32 Schwangerschaftswochen entbunden. Dieser Ansatz führte zu einer hohen Inzidenz von hyalinen Membranerkrankungen und Austauschtransfusionen., Mit dem Aufkommen der intravaskulären Transfusion (IVT) in der Gebärmutter besteht der allgemeine Ansatz für den schwer betroffenen Fötus darin, die IVT bis zur 35-wöchigen Schwangerschaft nach Bedarf durchzuführen, wobei die Entbindung termingerecht geplant ist. Die Feststellung der Lungenreife ist bei diesen Föten aufgrund der Kontamination des Fruchtwassers mit Restblut während der Transfusion schwierig; Wenn jedoch die Entbindung vor der 34-wöchigen Schwangerschaft geplant ist, ist die Verabreichung von mütterlichem Steroid zur Verbesserung der fetalen Lungenreife indiziert.,
Darüber hinaus verursachen überschüssige Fruchtwasser-Bilirubinspiegel eine falsche Erhöhung der Fluoreszenzdepolarisation TDx fetal lung maturity Test, Version II (TDX-FLMII); Daher sollten andere Tests zur Bestimmung der fetalen Lungenreife verwendet werden, wie Infrarotspektroskopie, Lamellenkörperzahl, Phosphatidylglycerin-Quantifizierung oder Lecithin/Sphingomyelin (L/S) – Verhältnis.
Liley beschrieb erstmals 1963 die intraperitoneale Transfusion (IPT). Eine Tuohy-Nadel wird unter sonographischer Anleitung in die fetale Peritonealhöhle eingeführt., Ein Epiduralkatheter wird durch die Nadel gefädelt. Ein strahlenundurchlässiges Medium wird in das fetale Peritoneum injiziert. Die richtige Platzierung wird durch Abgrenzung außerhalb des Darms oder unter dem Zwerchfell oder durch Diffusion bei fetalem Aszites bestätigt.,ss als 4 Tage alt, Gruppe O, Rh-negativ, Kell-negativ, leukoredukiert, mit 25 Gy bestrahlt, um eine Transplantat-gegen-Wirts – Krankheit zu verhindern, und Kreuzabgleich mit mütterlichem Serum werden in 10-ml-Aliquoten auf ein Volumen injiziert, das nach der folgenden Formel berechnet wird:
IPT volume = (Schwangerschaft in Wochen-20) × 10 mL
Es wird geschätzt, dass der Resthämoglobin (Hb) im Fötus den richtigen Abstand des IPT und die Auswahl der Trächtigkeit der Geburt nach der folgenden Formel zulässt:
Hb g/dL = 0.,85/125 × a / b × 120-c/120
In der Formel ist a die Menge an transfundiertem Spender-RBC-Hb, b das geschätzte Körpergewicht des Fötus und c das Intervall in Tagen vom Zeitpunkt der Transfusion bis zum Zeitpunkt der Hb-Schätzung des Spenders.
IPT wird wiederholt, wenn der fetale Hb schätzungsweise auf 10 g/dL gesunken ist. Normalerweise wird 10 Tage nach der ersten Transfusion ein zweiter IPT durchgeführt, um den Hb über 10 g/dl zu erhöhen. Dann wird alle 4 Wochen bis zur geplanten Entbindung bei 34-35 Schwangerschaftswochen eine weitere Transfusion durchgeführt., Fetale Zwerchfellbewegungen sind notwendig, damit die Absorption von RBC auftreten kann. Dieser Ansatz ist für einen Moribund-nicht vernichtenden Fötus von keinem Wert. Mütterliche Komplikationen umfassen Infektionen und transplazentare Blutungen, während fetale Komplikationen Übertransfusion, Exsanguination, Herztamponade, Infektion, Frühgeburt und Transplantat-gegen-Wirt-Krankheit sind. Die Überlebensraten nach IPT näherten sich mit Hilfe der Sonographie etwa 75%.,
Direkte IVT ist aufgrund der höheren Komplikationsrate und der begrenzten Wirksamkeit von IPT bei einem hydropischen Fötus zu einem bevorzugten Weg der fetalen Intervention geworden. Rodeck führte erstmals 1981 erfolgreich IVT durch. Unter Ultraschallführung wird eine 20-22-Gauge-Nadel in eine Nabelvene beim Einführen der Schnur in die Plazenta oder in ihren intrahepatischen Teil eingeführt und eine fetale Blutprobe erhalten. Die Blutprobe wird durch einen schnellen alkalischen Denaturierungstest als fetalen Ursprung bestätigt., Alle relevanten fetalen Tests (z. B. Blutgruppe, direkter Antikörpertest, Retikulozytenzahl, Thrombozytenzahl, Hb-Spiegel, Hct-Spiegel, Serumalbuminspiegel, Erythropoetinspiegel) werden durchgeführt. Wenn der Hb-Spiegel weniger als 11 g/dl beträgt oder wenn der Hct-Spiegel weniger als 30% beträgt, wird eine IVT gestartet. Die Position der Nadel wird bestätigt, indem die Turbulenz im fötalen Gefäß bei der Injektion von Kochsalzlösung festgestellt wird. Der Fötus ist häufig mit Pancuronium gelähmt und erhält 10 mcg/kg Fentanyl, um die Verschiebung der Nadel durch fetale Bewegungen zu verhindern., Mütterliche Medikamente variieren von nur Lokalanästhetika über routinemäßiges Indomethacin und bewusste Sedierung bis hin zu spinaler epiduraler Analgesie.
Die Transfusion erfolgt in 10-ml-Aliquoten bis zu einem Volumen von etwa 50 ml/kg geschätztem Körpergewicht mittels Ultraschall oder bis ein Hct-Spiegel von 40% erreicht ist. Das Verfahren wird umgehend abgebrochen, wenn bei Ultraschallbefunden eine Herzdekompensation festgestellt wird., Schwer anämische Föten tolerieren keine akute Korrektur ihrer Hct auf normale Werte, und die anfängliche Hct sollte zum Zeitpunkt der ersten IVT nicht um mehr als das 4-fache erhöht werden. Sie sollten dann alle 2-7 Tage überwacht werden. Die IVT wird wiederholt, wenn sie einen Wert erreicht, der eine kritische Anämie beim Fötus widerspiegelt. Ein Verlust von 1% der transfundierten Zellen pro Tag ist zu erwarten.
Einige Zentren führen eine Wiederholungstransfusion in Abständen von 10 Tagen, 2 Wochen und alle 3 Wochen durch. Andere transfuse basierend auf einem erwarteten Rückgang des fetalen Hämoglobins von 0,4 g/dL/Tag 0,3 g/dL/Tag und 0.,2 g/dL / Tag für das erste, zweite und dritte Transfusionsintervall. Die maximale systolische MCA-Geschwindigkeit wurde zur Zeit der zweiten Transfusion mit einer Schwelle von 1,32 MOM verwendet. Nach der ersten intrauterinen Transfusion unterdrückt das Vorhandensein roter Blutkörperchen mit adultem Hämoglobin die Erythropoese und verbessert die Sauerstoffzufuhr, was für die schlechte Korrelation zwischen der Spitzengeschwindigkeit der MCA und der Schwere der fetalen Anämie verantwortlich ist. Einige Zentren haben eine positive Wirkung der kombinierten IVT-und IPT-Transfusion auf das Intervall zur wiederholten Transfusion gefunden.,
Zusätzlich zu den Komplikationen der IPT wurden während der IVT vorübergehende fetale Bradykardie, Nabelschnurhämatom, Nabelvenenkompression und fetaler Tod berichtet. IVT hat jedoch viele Vorteile, einschließlich der sofortigen Korrektur von Anämie und Auflösung von fetalen Hydrops, reduzierter Hämolyse und nachfolgender Hyperinsulinämie und Beschleunigung des fetalen Wachstums bei nichthydropischen Föten, die häufig wachstumsverzögert sind. IVT ist die einzige Intervention, die für moribund hydropische Föten und solche mit anteriorer Plazenta verfügbar ist. Das Risiko eines fetalen Verlustes liegt bei IVT bei etwa 0, 8% gegenüber 3.,5% pro Verfahren für IPT und die Gesamtüberlebensrate beträgt 88%.
Kürzlich gewaschene mütterliche RBCs wurden erfolgreich als Quelle für antigen-negative RBCs bei seltener Inkompatibilität eingesetzt, wurden aber auch routinemäßig wegen Vorteilen wie einem verringerten Risiko für die Sensibilisierung gegen neue Erythrozytenantigene, einer längeren zirkulierenden Halbwertszeit als frisch und einem verringerten Risiko für die Übertragung viraler Agenzien eingesetzt. Mutter kann nach dem ersten Trimester eine Einheit roter Blutkörperchen spenden.,
Bei Lungenunreife und Delta-Odyssee in der betroffenen Zone der Queenan-Kurve reduziert die orale Verabreichung von 30 mg Phenobarbital an die Mutter dreimal täglich, gefolgt von einer Induktion in einer Woche, die Notwendigkeit einer Austauschtransfusion im betroffenen Neugeborenen. Ausgezeichnete Algorithmen für das Management der ersten betroffenen Schwangerschaft und der Schwangerschaft bei einer Mutter mit zuvor betroffenem Fötus werden in einem Review von Moise beschrieben (siehe die Bilder unten).
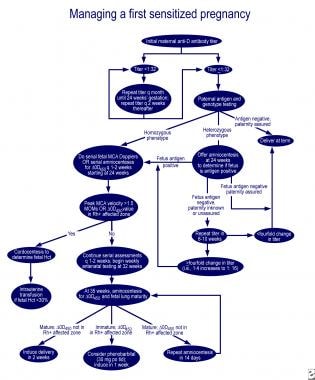 Verwaltung der ersten betroffenen Schwangerschaft.,
Verwaltung der ersten betroffenen Schwangerschaft., 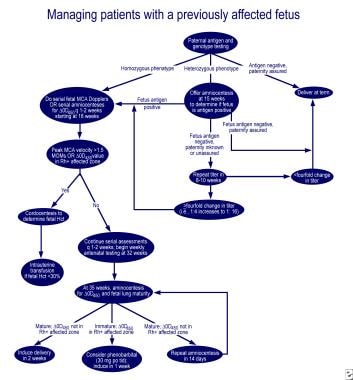 Management von schwangeren Frauen mit der zuvor betroffenen Fötus.
Management von schwangeren Frauen mit der zuvor betroffenen Fötus. Erste Versuche, die Rh-Antikörperproduktion mit Rh-Hapten, Rh-positivem RBC-Stroma und der Verabreichung von Promethazin zu unterdrücken, waren erfolglos. Eine ausgedehnte Plasmapherese mit partiellem Ersatz unter Verwendung von 5% Albumin (therapeutischer Plasmaaustausch) und intravenösem Immunglobulin (IVIG) oder die wöchentliche Verabreichung von IVIG bei 1 g/kg Körpergewicht hat sich als mäßig wirksam erwiesen., Der Wirkungsmechanismus scheint die Blockierung von Fc-Rezeptoren in der Plazenta zu sein, wodurch der Antikörpertransport zum Fötus, Fc-Rezeptoren auf den Phagozyten im fetalen retikuloendothelialen System und die Rückkopplungshemmung der mütterlichen Antikörpersynthese reduziert werden. Antikörperabhängige zellvermittelte Zytotoxizität und Rebound-Erhöhung der Antikörperkonzentration, Veränderung des Plazenta-Blutflusses während des Eingriffs und postpartale Blutung wurden jedoch nach dem Plasmaaustausch festgestellt.,
Eine neuere retrospektive Studie mit 5 schwangeren Frauen mit schwerem HDFN aufgrund von RBC-Alloimmunisierung berichtete über eine erfolgreiche Behandlung mit einem kombinierten Regime von therapeutischem Plasmaaustausch, IVIG und intrauteriner Transfusion (IUT) früh in den Schwangerschaften. Die Frauen wurden 3 Plasmaaustauschverfahren während der Wochen 10-13 der Schwangerschaft unterzogen, gefolgt von wöchentlichen IVIG-Infusionen; Die Föten erhielten RBC-Einheiten, die den mütterlichen Phänotyp vollständig mit den D -, C -, E -, K -, Fy -, Jk-und S-Antigengruppen übereinstimmten. Alle Frauen lieferten gesunde Säuglinge in 33-38 Schwangerschaftswochen.,
Diese Techniken verschieben jedoch nur die Notwendigkeit einer perkutanen Nabelblutentnahme (PUBS) und IVT bis zur 20-22-wöchigen Schwangerschaft, wenn diese Verfahren mit einem akzeptableren Risiko durchgeführt werden können. Eine Überprüfung der Verwendung von IVIG zeigt, wie nützlich es ist, den Beginn von fetalen Hydrops zu verhindern und den Bedarf an IUT zu verzögern., Daher wurde ein kombinierter Ansatz der Plasmapherese vorgeschlagen, der dreimal in dieser Woche mit einer 12-wöchigen Schwangerschaft beginnt, gefolgt von IVIG in einer Beladungsdosis von 2 g/kg nach der dritten Plasmapherese und dann mit einer Fortsetzung von IVIG 1 g/kg/wk bis zur 20-wöchigen Schwangerschaft wurde für gefährdete Föten vor der 20-wöchigen Schwangerschaft vorgeschlagen und kann auch später in der Schwangerschaft angewendet werden, wenn eine IVT nicht durchgeführt werden kann oder wenn Hydrops nicht auf die IVT reagiert.,
Ein Bericht zeigte, dass die Behandlung von Feten mit schwerer Alloimmunisierung unter Verwendung von IVT in Kombination mit fetaler IVIG-Therapie bei 1 g/kg/Dosis ab der dritten IVT dazu beitrug, die Häufigkeit von IVT zu reduzieren und Anzeichen von Hydrops zu verbessern. Ein Fallbericht zeigt eine erfolgreiche Behandlung von schwerer Anämie und Hydrops bei einem Fötus mit Alloimmunisierung aufgrund eines Anti-M-Antikörpers mit fetalen intraperitonealen IVIG-Injektionen von 2 g/kg, die wöchentlich ab 30 Wochen verabreicht werden. Dies war jedoch ein Fallbericht, und eine randomisierte kontrollierte Studie ist erforderlich, bevor dies zum Standard der Pflege werden kann.,
Ähnliche Test – und Behandlungsschemata werden bei der Behandlung von Schwangerschaften angewendet, die von einer NICHTRHD-Alloimmunisierung betroffen sind, wie z. B. Anti-Rhc, Anti-K (K1) und Anti-M. Sobald bei der Mutter ein Antikörper diagnostiziert wurde, der mit einer hämolytischen Erkrankung assoziiert ist, wird ein indirekter Coombs-Titer zusammen mit väterlichen Tests auf involvierte Antigen und Zygoten durchgeführt. Mütterliche Titer werden wiederholt (monatlich bis 28 Schwangerschaftswochen und dann alle 2 Wochen), bis eine Schwelle für fetale Anämie erreicht ist (1:8 für Kell und 1:32 für Ruhe).,
Die fetale Antigen-Typisierung erfolgt über Amniozentese oder zellfreie fetale DNA im mütterlichen Plasma, wenn der Vater heterozygot ist (100% für K1, 65% für M). Wenn bekannt ist, dass der Fötus antigenpositiv ist, wird eine Überwachung auf schwere fetale Anämie durchgeführt, wobei ein wöchentliches MCA-Doppler-Screening bereits nach 16 bis 18 Wochen durchgeführt wird, und eine IUT wird durchgeführt, wenn sie 1, 5 MOM mit einer Entbindung um 38 Schwangerschaftswochen überschreitet.
Es wurde gezeigt, dass mütterliche Alloantikörper gegen väterliche Leukozyten zu einer Fc-Blockade führen und die Schwere der fetalen hämolytischen Anämie verringern., Dies kann in Zukunft verwendet werden.
Das Management des sensibilisierten Neugeborenen
Eine leichte hämolytische Erkrankung macht 50% der Neugeborenen mit positiven direkten Antikörpertestergebnissen aus. Die meisten dieser Neugeborenen sind nicht anämisch (Nabelschnurhämoglobin 14 g/dl) und weisen eine minimale Hämolyse auf (Nabelschnurbilirubin < 4 mg/dl). Abgesehen von der frühen Phototherapie benötigen sie keine Transfusionen. Bei diesen Neugeborenen besteht jedoch das Risiko, nach 3-6 Lebenswochen eine schwere Spätanämie zu entwickeln. Daher ist die Überwachung ihres Hb-Spiegels nach der Entlassung aus dem Krankenhaus wichtig.,
Eine moderate hämolytische Erkrankung macht etwa 25% der betroffenen Neugeborenen aus. Moderate hämolytische Erkrankung des Neugeborenen ist durch moderate Anämie und erhöhte Nabelschnur-Bilirubinspiegel gekennzeichnet. Diese Säuglinge sind nicht klinisch Gelbsucht bei der Geburt, sondern entwickeln schnell unkonjugierte Hyperbilirubinämie in den ersten 24 Stunden des Lebens. Peripherer Abstrich zeigt zahlreiche kernförmige RBCs, verminderte Blutplättchen und gelegentlich eine große Anzahl unreifer Granulozyten., Diese Neugeborenen haben oft Hepatosplenomegalie und sind gefährdet, Bilirubin-Enzephalopathie ohne angemessene Behandlung zu entwickeln. Eine frühe Austauschtransfusion mit Typ-O-Rh-negativen frischen RBCs mit intensiver Phototherapie ist normalerweise erforderlich. Die Verwendung von IVIG in Dosen von 0,5-1 g / kg in einem Einzel-oder Mehrfachdosisschema konnte den Bedarf an Austauschtransfusionen effektiv reduzieren.,
Eine prospektive randomisierte kontrollierte Studie hat frühzeitig hochdosiertes IVIG 1 g/kg im Alter von 12 Stunden gezeigt, um die Dauer der Phototherapie und des Krankenhausaufenthalts zu reduzieren und eine Austauschtransfusion bei Neugeborenen mit mittelschwerer bis schwerer Rh-Isoimmunisierung zu verhindern. Diese Neugeborenen haben auch das Risiko, nach 4-6 Lebenswochen eine späte hyporegenerative Anämie im Säuglingsalter zu entwickeln. Eine randomisierte doppelblinde, placebokontrollierte Studie konnte jedoch nicht den Nutzen einer prophylaktischen IVIG-Therapie zeigen 0.,75 g / kg innerhalb von 4 Stunden bei stark betroffenen Neugeborenen, die zur Rh-Isoimmunisierung mit intrauteriner Transfusion behandelt wurden.
Schwere hämolytische Erkrankungen machen die restlichen 25% der alloimmunisierten Neugeborenen aus, die bei der Geburt entweder totgeboren oder hydropisch sind. Die fetalen Hydrops werden überwiegend durch ein Kapillarlecksyndrom aufgrund von Gewebehypoxie, Hypoalbuminämie infolge Leberfunktionsstörung und Herzinsuffizienz mit hohem Ausgangswert durch Anämie verursacht., Etwa die Hälfte dieser Föten wird vor der 34-wöchigen Schwangerschaft hydropisch und muss wie zuvor beschrieben intensiv überwacht und verwaltet werden alloimmunisierte Schwangerschaft. Leichte Hydrops mit Aszites kehren sich mit IVTs in nur 88% der Fälle mit verbessertem Überleben um, aber schwere Hydrops, die Kopfhautödeme und schwere Aszites und Pleuraergüsse verursachen, kehren sich in 39% der Fälle um und sind mit einem schlechten Überleben verbunden.
Das Management der ABO-Inkompatibilität
Das Management der Hyperbilirubinämie ist ein Hauptanliegen bei Neugeborenen mit ABO-Inkompatibilität., Die Kriterien für Austauschtransfusion und Phototherapie ähneln denen für die Rh-Alloimmunisierung. IVIG war auch sehr effektiv, wenn es früh im Kurs verabreicht wurde. Es wurde gezeigt, dass Tin (Sn) Porphyrin, ein potenter Inhibitor der Hämoxygenase, das Enzym, das den Geschwindigkeitsbegrenzungsschritt bei der Produktion von Bilirubin aus Häm katalysiert, die Produktion von Bilirubin verringert und die Notwendigkeit einer Austauschtransfusion und die Dauer der Phototherapie bei Neugeborenen mit ABO-Inkompatibilität verringert.
Zinn oder Zink Protoporphyrin oder Mesoporphyrine wurden bei Neugeborenen untersucht., Sie müssen intramuskulär in einer Dosis verabreicht werden, die auf dem Körpergewicht basiert, und ihre Wirksamkeit scheint bei allen Schwangerschaften dosisabhängig zu sein. Zu ihren möglichen toxischen Wirkungen gehören Photosensibilisierung der Haut, Eisenmangel und mögliche Hemmung der Kohlenmonoxidproduktion. Ihre Verwendung bei Rh-hämolytischen Erkrankungen von Neugeborenen wurde nicht berichtet. Ihre routinemäßige Anwendung kann aufgrund fehlender langfristiger Sicherheitsdaten noch nicht empfohlen werden.
















Schreibe einen Kommentar