Einführung
Chloroplasten stellen ein strukturelles Merkmal von Pflanzenzellen und Pflanzen unterstützen und das überleben, die über Ihre primäre Stoffwechsel-und high-level-Funktionen (Kirk und Tilney-Bassett, 1978; Mullet, 1988; Lopez-Juez, und Pyke, 2005). Während des vegetativen Pflanzenwachstums enthalten Blattzellen eine sehr homogene Population von Chloroplasten in Bezug auf Größe und Form., Die Anzahl der Chloroplasten pro Zelle wird durch binäre Spaltung bereits bestehender Organellen und Aufteilung in zwei Tochterzellen während der Zellteilung erreicht (Birky, 1983; Possingham und Lawrence, 1983). Daher ist die Regulierung der Chloroplastenzahl in einem bestimmten Zelltyp entscheidend für die zelluläre Funktion und die genetische Vererbung von Chloroplasten.
Um die Art der Chloroplastenzahlbestimmung in Pflanzenzellen zu untersuchen, haben Blattmesophyllzellen repräsentativer Arten eine wichtige Rolle gespielt ., Diese Zellen sind physiologisch wichtig für die Photosynthese und weisen eine hohe strukturelle und funktionelle Homogenität auf. Frühe systematische Beobachtung-Analysen an isolierten Geweben und Zellen (Boasson-und Laetsch, 1969; Possingham und Saurer, 1969; Boffey et al., 1979; Lamppa et al.,, 1980; Thomas und Rose, 1983; Pyke und Leech, 1991) lieferten viele nützliche Informationen zur Bestimmung der Chloroplastenzahl, einschließlich der Vorstellung, dass Chloroplasten (Plastide) nicht de novo synthetisiert werden, sondern durch Teilung replizieren, und der Beobachtung, dass die Mesophyllchloroplastenzahl gegenüber verschiedenen umwelt-und pflanzenendogenen Faktoren empfindlich ist. In Bezug auf letzteres hat Licht in Spinat einen positiven Einfluss auf die Chloroplastenteilung während der Blattscheibenkultur im Vergleich zu dunklen oder dunklen Bedingungen (Possingham und Lawrence, 1983)., In den ersten Weizenblättern korreliert das Zellvolumen positiv mit der Chloroplastenproliferation (Ellis und Leech, 1985; Pyke und Leech, 1987). Bei Arabidopsis beeinflusst der genetische Hintergrund die Chloroplastenproliferation; Die durchschnittliche Chloroplastenzahl pro Zelle in den ersten Blättern beträgt 121 im Landsberg erecta (Ler) – Ökotyp und 83 im Wassilewskija (Ws) – Ökotyp (Pyke und Leech, 1994; Pyke et al., 1994)., Blattmesophyllzellen haben auch zum Verständnis der genetischen Kontrolle der Chloroplastteilung beigetragen; Zum Beispiel haben Screening-Mutanten, die die Chloroplastproliferation beeinträchtigen und Genfunktionen charakterisieren, die an der Chloroplastteilung beteiligt sind, über 20 Gene aufgedeckt, die für Komponenten der Chloroplastteilung oder chloroplastregulatorische Faktoren kodieren (Gao und Gao, 2011; Miyagishima et al., 2011; Basak und Møller, 2013; Osteryoung und Pyke, 2014; Li et al., 2017).
Studien zur Replikation von Chloroplasten in Nicht-Mesophyll-Zellen (z.,, Pflasterzellen in der Blattepidermis; Itoh et al., 2018) knapp sind. Kürzlich wurde berichtet, dass sich die Regulation der Chloroplastenteilung zwischen Blattgeweben unterscheidet (Fujiwara et al., 2018; Itoh et al., 2018), obwohl der detaillierte Mechanismus unbekannt bleibt. Darüber hinaus, während die Analysen von Suspension-kultivierten BY-2-Zellen und Blattmesophyll-Protoplasten in Tabak und Spross apikalen Meristem und Blatt-Urzellen in Arabidopsis (Nebenführ et al., 2000; Sheahan et al.,, 2004; Seguí-Simarro und Staehelin, 2009) haben wichtige Erkenntnisse geliefert, wie die Chloroplasten (Plastid) – Partitionierung in Pflanzen reguliert wird, ist noch unklar. So bleiben trotz erheblichem Aufwand grundlegende Fragen in der Chloroplastenforschung bestehen, wie (i) wie wird die Chloroplastenzahl pro Zelle in Pflanzengeweben koordiniert und (ii) wie wird die Chloroplastenpartitionierung bei der Zellteilung reguliert.,
Forschungsgeschichte zur Stammzellchloroplastenzahl
Stomatale GCs in der Sprossepidermis enthalten im Allgemeinen Chloroplasten und kontrollieren den Gasaustausch zwischen dem Blattmesophyll und der Atmosphäre (Sachs, 1875; Taiz et al., 2015; siehe Abbildung 1A). Die erste Untersuchung der Chloroplastenzahl in Blättern wurde vor über einem Jahrhundert in natürlich gewachsenen Drosera-Pflanzen durchgeführt (Macfarlane, 1898)., Diese Studie zeigte, dass, wie andere Pflanzen-und Zellstrukturmerkmale, Die GC-Chloroplastzahl pro Zelle in einem mutmaßlichen Hybrid, der aus einer Kreuzung zwischen Drosera filiformis und Drosera intermedia stammt, zwischen den beiden Arten lag, was bedeutet, dass die GC-Chloroplastzahl verwendet werden könnte, um die genetische Zusammensetzung einer Pflanze zu bestimmen. Anschließend wurden wichtige Beobachtungen zu den Unterschieden in der GC-Chloroplastenzahl zwischen Pflanzenarten (Sakisaka, 1929) und der relativ stabilen Chloroplastenzahl in GCs in der Blattepidermis der Maulbeere (Morus spp.,; Hamada und Baba, 1930) und in reifen Blättern mehrerer Brassica-Arten (Iura, 1934). Darüber hinaus ergab die Analyse von autopolyploiden Zuckerrübenpflanzen (Beta vulgaris), dass die GC-Chloroplastenzahl in Blättern positiv mit dem nuklearen Ploidie-Gehalt von Pflanzen korreliert (Mochizuki und Sueoka, 1955). Weitere eingehende und umfassende Analysen wurden dann unter Verwendung verschiedener Pflanzenproben durchgeführt, um den Zusammenhang von Chloroplastenzahl und Stomatgröße mit dem Ploidie-Gehalt zu untersuchen (z. B. Frandsen, 1968)., In diesen Analysen wurde häufig die Chloroplastenzählung auf der Ebene des stomatalen (GC-Paares) übernommen, wodurch die Wirkung einer voreingenommenen Chloroplastverteilung zwischen gepaarten GCs ausgeschlossen wurde (z. B. Mochizuki und Sueoka, 1955; Frandsen, 1968), was ergab, dass die durchschnittliche GC-Chloroplastzahl in Blättern oder Cotyledonen bei ungefähr 80 Arten, Varianten oder Hybriden zwischen 2,8 und 40,0 in Diploiden (2×) und 5,0 bis 73,5 in Tetraploiden (4×) lag. Darüber hinaus Vollgenomverdopplungsereignisse in Pflanzen(d. H. 1× bis 2×, 2× bis 4× usw.) verursachte eine ungefähr 1.,7-facher Anstieg der GC-Chloroplastenzahl mit hoher Wiedergabetreue (rezensiert in Butterfass, 1973). Diese Ergebnisse förderten Untersuchungen des Ploidy-Spiegels in verschiedenen Geweben und Pflanzen, die durch Gewebekultur, Kreuzung oder natürliche Kultivierung in Kombination mit chemischen (z. B. Colchicin) oder Strahlenbehandlungen (z. B. Jacobs und Yoder, 1989; Singsit und Veilleux, 1991; Qin und Rotino, 1995)., Während die Chloroplastenzahl in der Stomatalbiologie (Lawson, 2009) und Zytologie untersucht wurde, um die Chloroplastenvermehrung zu verstehen (Butterfass, 1979; siehe unten), diente sie weitgehend als zuverlässiger und praktischer Marker für den Nachweis von Hybriden, Arten und Varianten und für die Schätzung der Ploidie-Spiegel von Zielpflanzengeweben.
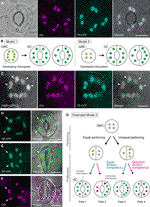
Abbildung 1 Vereinfachte Modelle und mikroskopische Nachweise für die Kontrolle der Chloroplastenzahl in stomatalen Schutzzellen (GCs)., (A) Ein typisches Stoma (GC-Paar) in der abaxialen Epidermis der Arabidopsis-Blattspreite, das eine stoma-gezielte Fusion des Transitpeptids (TP) mit Cyanfluoreszenzprotein (CFP; TP-CFP) exprimiert. (B) Zwei Modelle zur Bestimmung der Chloroplastzahl in GCs, die entweder Chloroplastpartitionierung (Modell 1) oder beide Chloroplastproliferation und-partitionierung (Modell 2) während der GC-Entwicklung von Guard Mother Cells (GMCs) beinhalten. (C) Ein GC-Paar in der adaxialen Epidermis von Arabidopsis-Blattstielen, das TP-CFP und FtsZ1 exprimiert und mit dem grün fluoreszierenden Protein (GFP; FtsZ1-GFP) verschmolzen ist., (D–F) GC-Paare in abaxialer Epidermis der Arabidopsis-Blattspreite mit (D, E) oder ohne (F) der Expression von TP, das mit dem gelb fluoreszierenden Protein (YFP; TP-YFP) verschmolzen ist. (F) Chlorophyll-Autofluoreszenz (Chl) wurde als Chloroplastenmarker verwendet., (G) Erweitertes Modell 2, das die Beteiligung der gleichen und ungleichen Chloroplastenpartitionierung nach GMC-Teilung und anschließender Teilung von GC-Chloroplasten mit gleicher (blauer Linie) oder selektiver (roter Linie) Teilungskompetenz darstellt, was zu vier Arten der Chloroplastenzahlbestimmung (Schicksale 1-4) während der späten stomatalen Entwicklung von Arabidopsis-Blättern führen würde. (A, C–F) Die Epifluoreszenzmikroskopie wurde mit einem invertierten Olympus IX71-Mikroskop unter Verwendung von Pflanzenmaterialien wie zuvor beschrieben durchgeführt (Fujiwara et al., 2017, Fujiwara et al., 2018)., Fluoreszenzsignale von Chlorophyll, CFP, GFP und YFP sind pseudofarben in Magenta, Cyan, Grün (nur im Bild) bzw. Hinweise in Panels sind wie folgt: Pfeilspitze, der FtsZ1-Ring; Pfeil, vergrößerter GC Chloroplast; gestrichelte Linie, Zellform. Maßstabsbalken = 10 µm.
Nützlichkeit von Blattschutzzellen für die Analyse der Chloroplastenzahlkontrolle
Blattmesophyllzellen werden seit langem als Primärmodell für die Analyse der Chloroplastenzahl verwendet., Sie haben zwar Vorteile für die Untersuchung der Auswirkungen von Umweltbedingungen auf die Chloroplastenteilung (z. B. die Lichtzytokinin-Signalgebung; Boasson und Laetsch, 1969; Possingham und Lawrence, 1983; Okazaki et al., 2009; Chiang et al., 2012) sind sie in mancher Hinsicht begrenzt. Erstens variieren Blattmesophyllzellen in Größe und Form und sind tief im Blatt verteilt, was es schwierig macht, intaktes Gewebe zu manipulieren., Zweitens kann die Anfälligkeit der Blattmesophyllchloroplastenproliferation für Umweltstress und Pflanzenwachstumsbedingungen zuverlässige Vergleiche zwischen Studien verhindern. Die Blattmesophyllchloroplastenzahl pro Zelle im Arabidopsis Columbia (Col) – Ökotyp wurde unterschiedlich berichtet 76 (Kinsman und Pyke, 1998), 80-100 (Stokes et al., 2000), 70 (Tirlapur und König, 2001), 41 (Yoder et al., 2007), 40-60 (Okazaki et al. 2009), und 30-40 (Kawade et al., 2013)., Darüber hinaus ist es fast unmöglich, den Beitrag der Chloroplastenpartitionierung zur endgültigen Chloroplastenzahl pro Mesophyllzelle während der Blattentwicklung zu beurteilen, obwohl angenommen wird, dass dies durch das Gleichgewicht zwischen der Zellteilungsrate und der Chloroplastteilungs-rate bestimmt wird. Um den Mechanismus der Chloroplastenzahlkontrolle in vegetativen Blattzellen aufzudecken, ist ein Modellsystem erforderlich, das die oben genannten Probleme überwindet.
Stomatale GCs (siehe Abbildung 1A) zeigen die Eigenschaften eines Modellsystems zum Verständnis des Mechanismus der Chloroplastenzahlkontrolle., GCs sind in Größe und Form innerhalb eines Gewebes sehr gleichmäßig, und ihre verstreute, aber dichte Verteilung in der äußersten Schicht der Triebe erleichtert ihre Erkennung durch Licht-und Fluoreszenzmikroskopie. GCs werden auch von protodermalen Zellen im Shoot apical Meristem oder von embryonalen epidermalen Zellen abgeleitet, und ihre Entwicklungssequenz durch Meristemoide (ein stomataler Vorläufer mit meristematischer Aktivität) und Schutzmutterzellen (GMCs; ein Vorläufer von GC-Paaren) wird im Detail festgelegt (Zhao und Sack, 1999; Nadeau und Sack, 2002; Kalve et al., 2014)., Die späte stomatale Entwicklung beinhaltet eine einzige Runde symmetrischer GMC-Teilung, die die Beurteilung der Chloroplastenverteilung und-partitionierung vor und nach der Zytokinese ermöglicht. Aus der Perspektive praktischer Experimente eignen sich Blatt-GCs für die Mikroskopie. Es wurde zuvor gezeigt, dass die Chloroplastenzahl pro Zelle in Blatt-GCs von Sinapis alba weniger von unterschiedlichen Lichtverhältnissen beeinflusst wurde als die in Blatt-Mesophyll-Zellen (Wild und Wolf, 1980)., Darüber hinaus ist der Unterschied in der GC-Chloroplastenzahl in Blattstielen bei den drei Arabidopsis-Ökotypen Col, Ler und Ws relativ gering (Fujiwara et al., 2018). Darüber hinaus wurde bei Arabidopsis leaf GCs keine Endoreduplikation nachgewiesen, die die Entwicklung von Blattmesophyll -, Pflaster-und Trichomzellen beeinflusst (Melaragno et al., 1993), die die Interpretationen von Chloroplastenzahldaten auf der 2C-Ebene von Zellen sicherstellen würde., Zusammen legen diese Berichte nahe, dass Blatt-GCs möglicherweise ein hervorragendes Modell für die systematische Analyse der Chloroplastenzahldynamik in einer bestimmten Zelllinie sind.
Arabidopsis-Blattschutzzellen als Modell zur Untersuchung der Kontrolle der Chloroplastenzahl
In der Geschichte der GC-Chloroplastenforschung hat die Chloroplastenzählung auf stomataler Ebene (GC-Paar) eine ebenso wichtige Rolle bei der Bestimmung der Chloroplastenzahl als Zählung auf individueller GC-Ebene gespielt. Beide Methoden erzeugen die gleiche mittlere Chloroplastenzahl (Butterfass, 1973)., Wenn die Variation der Chloroplastenverteilung in gepaarten GCs und ihrem zugrunde liegenden Mechanismus im Mittelpunkt steht, sind detaillierte Informationen über Chloroplasten auf individueller Zellebene, d. H. Ihre Größe, Form und intrazelluläre Lokalisation, unerlässlich. Die Chloroplastenproliferation (Plastid) während der GMC-GC-Differenzierung wurde zuvor bei mehreren Pflanzenarten untersucht (Butterfass, 1973, Butterfass 1979)., Diese Studien schlugen zwei Modelle zur Bestimmung der terminalen Chloroplastenzahl in GCs bei verschiedenen Pflanzenarten vor (Abbildung 1B): Eines (Modell 1; Zuckerrüben) beinhaltet nur die Chloroplastenpartitionierung bei der GMC-Teilung und das andere beinhaltet nicht nur die Chloroplastenpartitionierung, sondern auch die Chloroplastenproliferation während der GC-Entwicklung.
Im Zeitalter der Molekulargenetik, der Genomik, der Zellbildgebung und anderer interdisziplinärer Analysen gibt es viele Möglichkeiten zur weiteren Charakterisierung des Chloroplasten-Partitionierungsmechanismus., Arabidopsis leaf GCs kann eines der besten Modellsysteme für diesen Zweck sein. Mehrere Studien haben die GC-Chloroplastenzahl in den Blättern oder Cotyledonen von Arabidopsis untersucht (Hoffmann, 1968; Pyke und Leech, 1994; Pyke et al., 1994; Robertson et al., 1995; Keech et al., 2007; Chen et al., 2009; Yu et al., 2009; Higaki et al., 2012; Fujiwara et al., 2018). Diese GCs weisen eine bescheidene Anzahl von Chloroplasten auf, die im Durchschnitt zwischen 3,5 und 5,5 liegen. Bisher haben keine Studien die Veränderungen der Chloroplasten (Plastid) – Zahl während der stomatalen Entwicklung untersucht., Mikroskopische Beweise aus stomatalen Entwicklungsanalysen (z. B. Zhao und Sack, 1999; Hachez et al., 2011) und unsere vorläufigen Beobachtungen zeigen, dass GMCs eine geringere Anzahl sich entwickelnder Chloroplasten als GCs enthalten können und dass Chloroplastenproliferation während der GC-Differenzierung auftreten kann. Um dies zu testen, wurde die Bildung der Chloroplasten-Teilungsmaschinerie in GCs mit der Sonde FtsZ1, die mit dem grün fluoreszierenden Protein (FtsZ1-GFP) verschmolzen ist, überwacht (Fujiwara et al., 2008)., Eine transgene Linie, die gleichzeitig ein Transitpeptid (TP)-fusioniertes CFP und FtsZ1-GFP exprimiert, um den Stroma-bzw. FtsZ1-Ring zu visualisieren, wurde durch Epifluoreszenzmikroskopie untersucht (Fujiwara et al., 2017). Expandierende Blattstiele (fünfte Blätter von 4 Wochen alten Sämlingen) wurden verwendet. Als Ergebnis wurden GCs mit symmetrisch einschnürenden Chloroplasten nachgewiesen (Abbildung 1C). Diese Chloroplasten bildeten den FtsZ1-Ring, einen Chloroplasten-Teilungsring auf der Stromoberfläche der inneren Hüllmembran in Blattmesophyll – und Pflasterzellen (Vitha et al., 2001; Fujiwara et al.,, 2008), an der äquatorialen Einschnürstelle. Im Einklang mit der stomatalen Musterung in Arabidopsis Blattentwicklung (Donnelly et al., 1999; Andriankaja et al., 2012) wurden dividierende Chloroplasten im späten sowie frühen Stadium der Blattexpansion nachgewiesen. Daher passt Modell 2 höchstwahrscheinlich am besten zu Arabidopsis Leaf GCs.
Beziehung zwischen Chloroplastenproliferation und Expansion in Arabidopsis-Blattschutzzellen
Darüber hinaus wurde bei reifen GCs ein unerwarteter Phänotyp der GC-Chloroplastenmorphogenese beobachtet (Abbildungen 1D, E)., Wenn epidermale Schalen von vollständig expandierten Blättern (dritte–vierte Blattspreite von 4 Wochen alten Sämlingen) aus einer TP-fused Yellow Fluorescent Protein (YFP)-Linie mikroskopisch charakterisiert wurden (FL6-5-Linie; Fujiwara et al., 2018) zeigten einige Stomata ungleiche Chloroplastenverteilungsmuster in GC-Paaren, während die meisten Blattstomata gleiche oder ähnliche Chloroplastenverteilungsmuster zeigten (Robertson et al., 1995; Fujiwara et al., 2018)., Innerhalb des GC-Paares eines Stomas war die Größe von Chloroplasten in dem GC, das eine geringere Anzahl von Chloroplasten enthielt, größer als in den anderen GCs in dem Paar, das eine größere Anzahl von Chloroplasten enthielt (Abbildungen 1D, E). Auf diese Weise halten GCs wahrscheinlich das gesamte Chloroplastenvolumen pro Zelle während des Zellwachstums auf einem konstanten Niveau. Vergrößerte Chloroplasten stellten den terminalen Phänotyp dar und konnten sich in expandierten Blättern nicht mehr teilen. Diese Ergebnisse wurden in mehreren unabhängigen Experimenten unabhängig von der Expression eines TP-fused fluorescent Proteins zur Stroma-Kennzeichnung bestätigt (Abbildung 1F).,
Dieser GC-Chloroplastenphänotyp wird als Kompensationsmechanismus für die Chloroplastenexpansion interpretiert, der in Blattmesophyllzellen, die bei der Kontrolle der Chloroplastteilung fehlerhaft waren, gut dokumentiert war (Pyke und Leech, 1994; Pyke et al., 1994). Bisher hat nur eine Studie (Ellis und Leech, 1985) eine negative Korrelation zwischen Chloroplastzahl und Chloroplastgröße in Blattmesophyllzellen von Weizen berichtet, wohingegen viele Studien eine positive Korrelation zwischen Zellvolumen und Chloroplastzahl in normalen Blattmesophyllzellen gemeldet haben (Leech und Pyke, 1988; Pyke, 1997)., Während Ungleichgewichte in der Chloroplastenzahl bei niedriger Frequenz auftreten (Fujiwara et al., 2018) zeigt die Chloroplastenheterogenität in GC-Paaren, dass eine ungleiche Chloroplastenpartitionierung trotz symmetrischer Zellteilung ein differentielles Chloroplastenwachstum zwischen Blattzellen vom Wildtyp in Arabidopsis auslösen kann.
Der Chloroplastenkompensationseffekt in GCs kann weniger streng sein als in Blattmesophyllzellen., GCs könnten in stark beeinträchtigten Chloroplastteilungs-Mutanten, wie in Arabidopsis arc6 und atminE1 und Tomato suffulta, einer Knappheit oder einem vollständigen Verlust des gesamten Chloroplastvolumens pro Zelle standhalten, während viele mutierte GCs eine verringerte Chloroplastzahl und eine vergrößerte Chloroplastgröße ähnlich den Blattmesophyllzellen zeigten (Robertson et al., 1995; Her und Pyke, 2006; Chen et al., 2009; Fujiwara et al., 2018)., In einer späten Chloroplastteilungs-Mutante, arc5, war die Verringerung der GC-Chloroplastenzahl im Gegensatz zu Blattmesophyllzellen nicht mit einer signifikanten Zunahme der Chloroplastengröße verbunden (Pyke und Leech, 1994). Ein geringerer Grad an Chloroplastenexpansion in GCs als in Mesophyllzellen (Pyke und Leech, 1994; Barton et al., 2016), und die Variation der Chloroplastenexpansion unter den GCs könnte einem so breiten zulässigen Bereich des gesamten Chloroplastenvolumens pro GC zugrunde liegen., Darüber hinaus kann der Zeitpunkt der Chloroplastenteilung während der GMC-GC-Differenzierung den terminalen GC-Chloroplasten-Phänotyp signifikant beeinflussen. Obwohl eine weitere detaillierte Charakterisierung erforderlich ist, um dieses Problem anzugehen, scheint es plausibel, dass Arabidopsis leaf GCs ein System darstellt, um die ungenutzten Aspekte der Chloroplastenzahlkontrolle in Pflanzenzellen zu untersuchen.,
Ein Arbeitsmodell zur Bestimmung der Chloroplastzahl in Arabidopsis-Blattschutzzellen
Auf der Grundlage der obigen Ausführungen schlagen wir ein Arbeitsmodell (ein erweitertes Modell 2) für die Analyse der Chloroplastzahl in GCs vor (Abbildung 1G). Die endgültige Chloroplastenzahl pro GC wird durch Chloroplastenpartitionierung bei GMC-Division und Chloroplastenproliferation in GCs bestimmt. Während der GMC-Teilung können Chloroplasten entweder gleich oder ungleich partitioniert werden. Während der Chloroplastenproliferation vermehren sich GC-Chloroplasten entweder mit gleicher (blauer Linie) oder selektiver (Magenta-Linie) Teilungskompetenz., Wenn beispielsweise gleich partitionierte Chloroplasten eine äquivalente Teilungskompetenz besitzen, treten im GC-Paar gleiche Chloroplastenzahlen auf (Schicksal 1). Wenn ungleich verteilte Chloroplasten eine äquivalente Divisionskompetenz besitzen, nehmen Chloroplasten innerhalb des GC-Paares mit der gleichen Rate zu (Schicksal 3). Wenn eine selektive Chloroplastteilung in GCs auftritt, ändert sich das Gleichgewicht der Chloroplastzahl im GC-Paar nach der GMC-Teilung (Schicksale 2 und 4)., Es ist derzeit schwierig, Unterstützung für die „selektive Chloroplastteilung“ zu finden, aber wenn Schicksale 1 und 4 tatsächlich in GCs vorherrschen, dann könnten sie einen Mechanismus besitzen, der das gesamte Chloroplastenvolumen pro Zelle steuert, wie in Blattmesophyllzellen. Das Modell wirft zwei Probleme auf: (i) Sind GC Chloroplasten ordnungsgemäß in Tochterzellen partitioniert und wie partitionieren sie? Und (ii) ist die Kompetenz von GC Chloroplasten koordiniert geregelt?,
In Bezug auf die Frage (i), ob die Chloroplastenvererbung durch zufällige Verteilung mehrerer Chloroplasten im Zytoplasma oder durch positive Chloroplastenpartitionierungsmechanismen auftritt, war ein langjähriges Anliegen(Butterfass, 1969; Birky, 1983; Hennis und Birky, 1984; Nebenführ, 2007; Sheahan et al., 2016). Interessanterweise haben in Arabidopsis arc6 Blatt-oder Cotyledon-GCs null bis drei Chloroplasten, und in Chloroplasten-defizienten GCs existieren nicht-photosynthetische Plastiden immer noch in vesikulären bis länglichen Formen (Robertson et al., 1995; Chen et al., 2009; Fujiwara et al., 2018)., In arc6 wurden keine GCs ohne Plastiden an sich gefunden, und es wurde keine Erklärung dafür gefunden, trotz der Störung des Chloroplastenteilungsapparates (Vitha et al., 2003). Dementsprechend wird es wichtig sein, die Replikation und Morphologie von arc6-Chloroplasten in stomatalen Abstammungsstudien zu untersuchen. Arabidopsis Mutantenforschung kann auch einen weiteren Hinweis für dieses Problem geben., Die Beobachtung, dass 18% der Cotyledon-GCs im zerknitterten Blatt (crl) – Mutanten keine plastidischen Strukturen im Zytoplasma enthalten, während 100% der Blattmesophyllzellen ein bis vier vergrößerte Chloroplasten enthalten (Asano et al., 2004; Chen et al., 2009), ist von großer Bedeutung. CRL ist ein äußeres Chloroplasten-Hüllprotein mit unbekannter Funktion. Das Verständnis der CRL-Proteinfunktion kann Einblicke in die Mechanismen der Chloroplastenpartitionierung geben., Die Analyse der Chloroplastenproliferation und-Partitionierung in Blatt-Mesophyll-Zellen in Arabidopsis-Arc-Mutanten und anderen transgenen Linien hat die Erforschung der Proliferation und Partitionierung von Nicht-Mesophyll-Plastiden gefördert. Ebenso können in GCs erhaltene Ergebnisse auf andere Zellsysteme übertragbar sein.
Schlussbemerkung
Das GC-Modell eröffnet viele Perspektiven für die Entwicklung der Chloroplastenbiologie. Es ist beispielsweise bekannt, dass zytoskeletale Systeme Chloroplastenmorphologie, Bewegung und Partitionierung regulieren (Sheahan et al.,, 2016; Wada, 2016; Erickson und Schattat, 2018) hat die Rolle jedes regulatorischen Gens bei der Proliferation und Partitionierung von Chloroplasten in Pflanzen wenig Beachtung gefunden. Andererseits können, sobald es möglich wird, die GC-Chloroplastenzahl oder-morphologie durch verschiedene experimentelle Strategien zu beeinträchtigen, neue Erkenntnisse über die molekulare Kontrolle der Chloroplastenmorphogenese in stomatalen Stammzellen bereitgestellt werden. Darüber hinaus kann in Verbindung mit quantitativen Analysen der Chloroplastenzahl während der stomatalen Entwicklung eine mathematische Modellierung einen neuen Weg für diese Untersuchungen bieten., Dieses Papier präsentiert aktuelle Kenntnisse darüber, wie die GC-Chloroplastenzahl kontrolliert wird, und hebt den potenziellen Nutzen von Arabidopsis leaf GCs für das Verständnis der Chloroplastenproliferation und-partitionierung hervor.
Datenverfügbarkeitserklärung
Alle Datensätze für diese Studie sind im Artikel / Ergänzungsmaterial enthalten.
Autorenbeiträge
MF konzipierte die Studie und schrieb das Manuskript. MF und WIE die Experimente durchgeführt hat. AS und RI führten die Analysen durch. Alle Autoren lasen und genehmigten das endgültige Manuskript.,
Finanzierung
Diese Arbeit wurde vom japanischen Ministerium für Bildung, Kultur, Wissenschaft und Technologie im Rahmen von KAKENHI unterstützt (Zuschussnummern 19K05831 an MF und 18K06314 an RI).
Interessenkonflikt
Die Autoren erklären, dass die Forschung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Die Autoren danken Dr. Nobuyuki Kanzawa (Sophia-Universität) für die Beratung bei der Arbeit.
Birky, C. W., Jr (1983)., The partitioning of cytoplasmic organelles at cell division. Int. Rev. Cytol. 15, 49–86.
Google Scholar
Butterfass, T. (1969). Die Plastidenverteilung bei der Mitose der Schließzellenmutterzellen von haploidem Schwedenklee (Trifolium hybridum L.). Planta 84, 230–234. doi: 10.1007/BF00388108
PubMed Abstract | CrossRef Full Text | Google Scholar
Butterfass, T. (1973). Control of plastid division by means of nuclear DNA amount. Protoplasma 76, 167–195. doi: 10.,1007/BF01280696
CrossRef Full Text | Google Scholar
Qin, X., Rotino, G. L. (1995). Chloroplast number in guard cells as ploidy indicator of in vitro-grown androgenic pepper plantlets. Plant Cell Tissue Organ Cult. 41, 145–149. doi: 10.1007/BF00051583
CrossRef Full Text | Google Scholar
Sachs, J. (1875). Textbook of Botany. Oxford: Clarendon Press.
Google Scholar
Thomas, M. R., Rose, R. J. (1983)., Plastid Anzahl und plastid strukturelle Veränderungen im Zusammenhang mit Tabak Mesophyll Protoplastkultur und Pflanzenregeneration. Planta 158, 329-338. doi: 10.1007/BF00397335
PubMed Abstract | CrossRef Full Text | Google Scholar
Tirlapur, U. K., König, K. (2001). Femtosekunden-Nahinfrarotlaser als neuartiges Werkzeug zur nicht-invasiven hochauflösenden Echtzeit-Zeitraffer-Bildgebung der Chloroplastenteilung in lebenden Bündelscheidenzellen von Arabidopsis. Planta 214, 1-10. doi: 10.,1007/s004250100597
PubMed Abstract | CrossRef Full Text | Google Scholar
Wild, A., Wolf, G. (1980). Die Wirkung verschiedener Lichtintensitäten auf die Häufigkeit und Größe von Stomata, die Größe der Zellen, die Anzahl, Größe und den Chlorophyllgehalt von Chloroplasten im Mesophyll und den Schutzzellen während der Ontogenese der primären Blätter von Sinapis alba. Z. Pflanzenphysiol. Bd. 97, 325–342. doi: 10.1016 / S0044-328X (80)80006-7
CrossRef Volltext / Google Scholar
















Schreibe einen Kommentar