D Kelly1, G Crotty1, J O’Mullane2, M Stapleton2, B Sweeney1, SS O’Sullivan1
Abteilungen der 1Neurology und 2Biochemistry, Cork University Hospital, Wilton, Kork
Abstract
Der erste Schritt beim screening nach möglichen Wilson-Krankheit ist serum-ceruloplasmin-Tests, wobei ein Niveau von weniger als 0,2 g/L ist die suggestivkraft der Krankheit., Wir wollten herausfinden, welcher Anteil einer irischen Bevölkerung einen niedrigen Ceruloplasminspiegel aufwies, ob niedrige Messungen angemessen verfolgt wurden und welche klinischen Ergebnisse erzielt wurden. Wir führten eine retrospektive Überprüfung aller Serum-Ceruloplasmin-Messungen zwischen August 2003 und Oktober 2009 in einem großen tertiären Überweisungszentrum in Südirland durch. Klinische Daten, Serumkeruloplasmin, Leberfunktionstests, Harnuntersuchungen und Leberbiopsieberichte wurden, sofern verfügbar, aufgezeichnet. 1573 Patienten hatten während des 7-jährigen Studienzeitraums eine Serum-Ceruloplasmin-Messung. 96 Patienten (6.,1%) hatten einen Ceruloplasminspiegel <0,2 g/l und von diesen hatten nur 3 Patienten Wilson-Krankheit. Es gab nur 1 neue Diagnose. Nur 27 Patienten (28,1%) hatten irgendeine Form von Bestätigungstests durchgeführt. Nach unserer Erfahrung liegt der positive prädiktive Wert eines signifikant niedrigen Ceruloplasminspiegels bei 11,1% (95% CI 2,91-30,3%). In der Praxis folgt auf eine niedrige Serum-Ceruloplasmin-Messung oft kein geeigneter Bestätigungstest., Die Messung von Serum-Ceruloplasmin als singulärer diagnostischer Test für Wilson-Krankheit oder als Teil der Durchführung von nicht ausgewählten Leber-Screening-Tests ist ungeeignet und ertragsarm.
Einleitung
Die Wilson-Krankheit (WD) ist ein seltener autosomal-rezessiver Defekt beim hepatozellulären Kupfertransport, der bei 3 von 100.000 Menschen gefunden wird1. Es kann zu chronischer Kupferablagerung in Leber, Gehirn und anderen Geweben führen, was zu Hepatotoxizität und neuropsychiatrischen Folgen führt2., Die American Association for the Study of Liver Disease (AASLD) empfiehlt das Screening auf WD bei Personen im Alter zwischen 3 und 55 Jahren mit Leberanomalien unsicherer Ursache, insbesondere bei Personen mit komorbiden unerklärlichen neurologischen Störungen.3. Der erste Schritt beim Screening auf potenzielle WD ist die Serum-Ceruloplasmin-Messung, da etwa 85 bis 90 Prozent der Patienten mit WD niedrige Serum-Ceruloplasmin-Spiegel haben4., Ein niedriges Ceruloplasmin ist jedoch nicht spezifisch für WD; Es kann aus Malabsorption, anderen Lebererkrankungen, Proteinverlust Enteropathien, erworbenem Kupfermangel und erblichen Aceruloplasminemien5 resultieren. Ceruloplasmin ist auch ein Akutphasenreaktant und kann in entzündlichen Zuständen einschließlich bei Patienten mit aktiver Hepatitis6 erhöht sein. Hyperöstrogene Zustände, einschließlich Schwangerschaft oder Verwendung der oralen Kontrazeptiva, können auch den Ceruloplasminspiegel erhöhen, da die Ceruloplasmin-mRNA für ihre Transkription7 eine östrogenreaktive Upstream-Region aufweist. Ceruloplasmin levels von weniger als 0 ist.,es wurde gezeigt, dass 2g/L in einer Studie eine Empfindlichkeit von über 98%, eine Spezifität von über 55% und einen positiven prädiktiven Wert von über 48% für die Diagnose von WD bei genotypverifizierten Patienten8 aufweist.
Andere Untersuchungen legen jedoch nahe, dass der positive Vorhersagewert von Ceruloplasmin <0, 2 g/L bei Alleinanwendung bei Patienten mit Leberfunktionsstörungen bis zu 5, 9% betragen kann 1. Aus diesem Grund empfehlen die Leitlinien eine Reihe von Bestätigungstests, einschließlich einer Spaltlampenuntersuchung zum Nachweis von Kayser-Fleischer (KF)-Ringen und einer 24-Stunden-Urinkupferschätzung 3., Für Personen mit unbestimmten Ergebnissen können zusätzliche Untersuchungen erforderlich sein,einschließlich einer Leberbiopsie zur Bestimmung der Leberkupferkonzentration oder molekularer Tests auf ATP7B-Mutationen 9, 10. Die Leitlinien der European Association for the Study of the Liver (EASL) Clinical Practice erkennen auch die Einschränkungen der Serum-Ceruloplasmin-Messung als Einzeltest an und empfehlen die Verwendung einer Kombination von Tests, die den „gestörten Kupferstoffwechsel“ widerspiegeln, mit einem diagnostischen Bewertungssystem auf der Grundlage ihrer Ergebnie11., Unsere Studie untersuchte die Inzidenz niedriger Ceruloplasminspiegel in der Bevölkerung und die klinischen Indikationen für Tests. Wir haben festgestellt, ob weitere diagnostische Tests durchgeführt wurden und welche klinische Bedeutung diese Ergebnisse haben.
Methoden
Wir haben eine retrospektive Überprüfung aller Ceruloplasmin-Messungen am Cork University Hospital Clinical Laboratory durchgeführt, das zwischen August 2003 und Oktober 2009 ein großes Primärversorgungsnetz, Spezialkliniken und ein tertiäres neurologisches und hepatologisches Überweisungszentrum mit 800 Betten bedient., Der Zeitraum wurde so gewählt, dass er die maximal verfügbaren Daten enthält. Die Studie wurde von der Ethikkommission des Krankenhauses genehmigt. Klinische Daten, Serumkeruloplasmin, Leberfunktionstests, Harnuntersuchungen und Leberbiopsieberichte wurden, sofern verfügbar, aufgezeichnet. Die Nephelometrie war die Technik, die vom Überweisungslabor zur Messung von Serum-Ceruloplasmin während des Untersuchungszeitraums verwendet wurde. Wir behandelten Ceruloplasminwerte unter 0,2 g / l als potenziell positiv für WD gemäß den veröffentlichten Leitlinien3., Eine Diagnose von WD wurde auf der Grundlage der Ergebnisse von Bestätigungstests (Urin-und Leberuntersuchungen, ophthalmologische Untersuchungen) und der Dokumentation von Krankenakten bestimmt. Genetische Testergebnisse wurden aufgezeichnet, wo verfügbar. WD-Heterozygoten wurden als solche mit nur einer krankheitsverursachenden Mutation in Abwesenheit anderer unterstützender Merkmale definiert. Die Daten wurden mit SPSS Version 21 analysiert.
Ergebnisse
Demografie der getesteten Bevölkerung
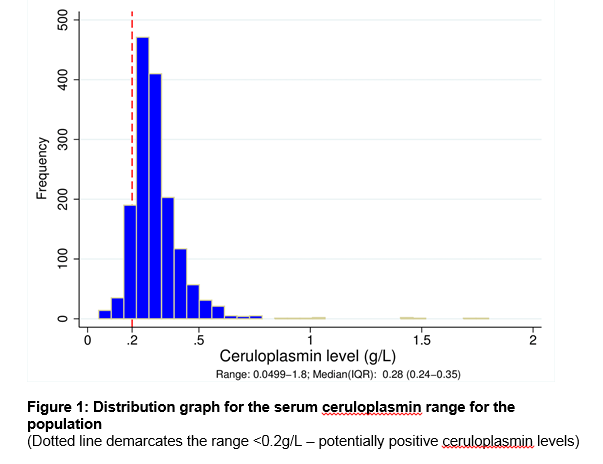
Unser Labor in Cork City, Irland, dient als überregionales Zentrum für eine Gesamtbevölkerung von 1,1 Millionen Menschen., Es gab 1573 Patienten in der Labordatenbank, die während des 7-jährigen Studienzeitraums eine Serum-Ceruloplasmin-Messung hatten. Tabelle 1 beschreibt die demografischen Details und die Überweisungsquelle nach klinischen Fachgebieten. Insgesamt wurden 476 Serum-Ceruloplasminspiegel (30, 3%) bei Patienten im Alter von weniger als 3 Jahren oder mehr als 55 Jahren, einer Gruppe außerhalb der AASLD-Empfehlungen3, bestellt. Siehe Abbildung 1 für den Bereich der Ceruloplasminspiegel in der gesamten Population. Der mittlere Ceruloplasminspiegel betrug 0,28 g/l (5.Centil = 0,18, 95. Centil = 0,5 g / l)., Es gab einen signifikanten Unterschied in der median-Ebene für Männer und Frauen in 0.27 g/L 0,3 g/L, respectively (p<0.05). Es war eine schwache positive Korrelation zwischen dem Alter und ceruloplasmin-Ebene mit geringeren Alters im Zusammenhang mit den niedrigeren ceruloplasmin Ebene, r =.124, n = 1573, p <.0005.
Tabelle 1:
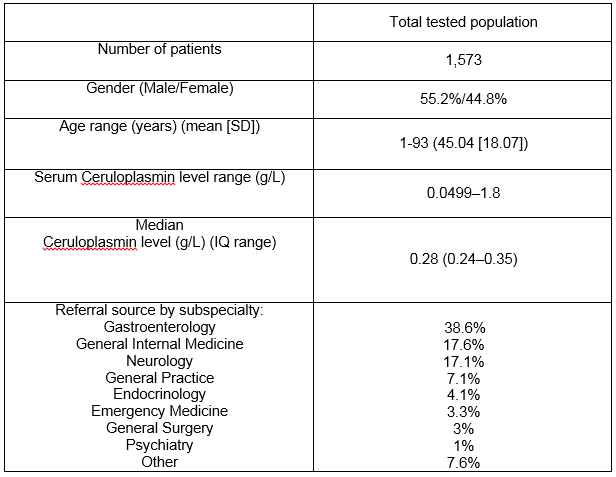
Positive Ceruloplasmin-Ergebnisse
96 Patienten (männlich:weiblich = 72%:28%) der gesamten Kohorte (6,1%) hatten einen Ceruloplasmin-Spiegel <0.,2 G/L (siehe Abbildung 1). Die häufigsten Indikationen für Tests waren das Vorhandensein von Leberfunktionstestanomalien (61, 5%), eine Bewegungsstörung (18, 8%) und psychiatrische Störungen (7, 3%). 40,6% der Gruppe erhielten anschließend eine endgültige Diagnose einer Lebererkrankung, von denen die häufigste alkoholische Lebererkrankung (14,6%) war, gefolgt von einer nichtalkoholischen Fettlebererkrankung (8,3%). Nur 3 der 96 Patienten (3,1%) hatten WD. Zwei dieser Patienten waren zuvor diagnostiziert worden und wurden erneut auf Krankheitsüberwachung getestet. Ein Patient wurde während des Untersuchungszeitraums neu mit WD diagnostiziert., Seine erhöhte 24-Stunden-Kupferausscheidung im Urin, Kayser-Fleisher, zusammen mit einem niedrigen Serum-Ceruloplasmin-Spiegel bestätigte die Diagnose. Alle 3 WD-Patienten hatten ein Ceruloplasmin < 0,05 g/L. Zusätzlich wurde 1 Person mit Tremor als WD-Träger mit nur einer einzigen ATP7B-Mutation identifiziert. Seine genetische Analyse stimmte nicht mit einer zusammengesetzten Heterozygote überein und er entwickelte nie weitere klinische Symptome.
Bestätigungstest auf Wilson-Krankheit
Nach einem positiven/suggestiven Ceruloplasmin-Ergebnis 27/96 Patienten (28.,1%) hatte irgendeine Form von Bestätigungstests für WD durchgeführt. 14 Patienten (14,5%) wurden ophthalmologisch auf Kayser-Fleisher-Ringe untersucht. 10 Patienten (10, 4%) hatten eine Leberbiopsie zur Quantifizierung von hepatischem Kupfer. 23 Patienten (24%) hatten eine Kupferquantifizierung im Urin. Der mittlere Follow-up-Zeitraum ab dem Zeitpunkt der ersten Prüfung betrug 51,4 Monate (SD 30,3 Monate). Nicht-Neurologie / Gastroenterologie Unterspezialitäten waren signifikant weniger wahrscheinlich Follow-up-Untersuchungen zu tun. (p<0.01). Nur 4 der 27 Patienten (14.,8%), die weitere Tests hatten, standen unter der Obhut der Nicht-Neurologie/Gastroenterologie-Unterspezialitäten.
Ceruloplasmin als Screening-Diagnosetest
Diskussion
Die Messung von Ceruloplasmin wird häufig bei der Bewertung und Verwaltung des Patienten mit Leberenzymerhöhung veranlasst. In unserem Rückblick auf 7 Jahre Ceruloplasmin-Bestellmuster haben wir eine schlechte Einhaltung der AASLD-Richtlinien festgestellt. Ein signifikanter Anteil der getesteten Population lag außerhalb der von der AASLD empfohlenen Altersgruppe. Es ist sehr ungewöhnlich, mit Wilson-Krankheit nach dem Alter von 4 Jahren zu präsentieren., In einer großen retrospektiven Überprüfung der Ceruloplasminspiegel bei 5023 Patienten betrug die Anzahl, die zum Testen auf eine spät einsetzende Wilson-Krankheit (>40 Jahre alt) erforderlich war, um eine neue Diagnose zu erhalten, 284713. In vielen Fällen waren die Leberanomalien nicht von ungewisser Ätiologie und häufigere Erkrankungen waren noch nicht ausgeschlossen. Einige von denen mit niedrigen Ceruloplasminspiegeln hatten eine chronische Hepatitis oder eine alkoholinduzierte Lebererkrankung-Zustände, die mit falsch positiven Ergebnissen als Folge einer schlechten Leberfunktion1 einhergingen., Weniger als 30% der Studienpopulation hatten entsprechende Follow-up-Untersuchungen für ein positives Ceruloplasmin-Ergebnis, wie z. B. eine ophthalmische Untersuchung auf KF-Ringe oder eine Leberbiopsie auf Kupferfärbung. Ceruloplasmin-Messungen wurden von einer Vielzahl von Unterspezialisten angefordert, wobei die häufigsten Gastroenterologie, Neurologie und Internisten sind. Der häufigste Grund für Tests war für die Bewertung der Leberenzym-Erhöhung oder etablierte Lebererkrankung. Ärzte, die keine Gastroenterologen oder Neurologen waren, führten mit geringerer Wahrscheinlichkeit Bestätigungsuntersuchungen durch (p<0.01)., Dies deutet auf eine mangelnde Vertrautheit anderer Unterspezialitäten mit dem Diagnosealgorithmus von Untersuchungen hin, die zur Bestätigung oder zum Ausschluss von WD erforderlich sind.
Serum Ceruloplasmin Messung mit einem Cut-off-Level von weniger als 0,2 g / L hatte eine niedrige PPV für WD in unserer Studie ähnlich wie zuvor veröffentlichte Arbeit1. Dies bezieht sich auf die geringe Vortestwahrscheinlichkeit der Diagnose bei einer nicht ausgewählten Population mit einer hohen Prävalenz von Lebererkrankungen mit bekannter Ätiologie. Eine Senkung des Referenzbereichs auf 0,14 hätte die Testleistung verbessert, ohne die Empfindlichkeit zu beeinträchtigen., In früheren Studien wurde über eine höhere diagnostische Genauigkeit mit diesem niedrigeren Schwellenwert berichtet, wobei eine lokale Validierung erforderlich ist8. In dieser Studie zeigten Serum-Ceruloplasmin-Konzentrationen von weniger als 0,20, 0,14 und 0,10 g/l positive prädiktive Werte von 48,3%, 100% bzw. 100% In der Validierungsgruppe eine Serum-Ceruloplasmin-Schwelle von 0,14 g/l ergab eine 100% ige Empfindlichkeit und Spezifität. Es ist jedoch möglich, dass nicht jeder Patient mit WD auf der Grundlage dieses Screening-Tests erfasst wurde., Wie bereits erwähnt, kann es zu falsch negativen Ergebnissen für WD angesichts einer Infektion oder Entzündung kommen14. Schwangerschaft und ergänzende Östrogentherapie können ähnliche Auswirkungen haben15. Zukünftige Testanfragen / Interpretationen sollten solche mildernden klinischen Faktoren berücksichtigen. Die Testmethode kann die Ergebnisse beeinflussen. Serum Ceruloplasmin kann enzymatisch durch seine kupferabhängige Oxidaseaktivität gegenüber spezifischen Substraten oder durch antikörperabhängige Assays gemessen werden. Letzteres umfasst Nephelometrie, Radioimmunoassay und radiale Immundiffusion., Die Ergebnisse sind im Allgemeinen ähnlich, mit Ausnahme der antikörperabhängigen und Immundiffusionstests, die die Ceruloplasminspiegel überschätzen können. Die Überschätzung kann auftreten, weil die beiden Testmethoden nicht zwischen Apoceruloplasmin (Ceruloplasmin ungebunden an Kupfer) und Holoceruloplasmin (Ceruloplasmin mit seinem vollen Komplement von 6 Kupferatomen pro Molekül)unterscheiden 16. Die Nephelometrie war die Technik, die während unseres gesamten Untersuchungszeitraums konsequent angewendet wurde.
Es gab mehrere Einschränkungen für diese Studie. Wir haben keine Patienten verfolgt, die normal waren (>0.,2g / L) Serum-Ceruloplasmin-Spiegel, um sicherzustellen, dass sie anschließend keine WD entwickelten. Daher haben wir möglicherweise nicht die Testmerkmale aller betroffenen Patienten erfasst. Unsere Fähigkeit, Ceruloplasmin als diagnostischen Test zu bewerten, war begrenzt, da wir nur Messungen einschließen konnten, bei denen definitive Bestätigungstests durchgeführt wurden. Darüber hinaus ist es möglich, dass der von uns identifizierte heterozygote Träger tatsächlich WD mit einem weniger schweren Phänotyp hatte., Da die meisten WD-Patienten zusammengesetzte Heterozygoten sind und es viele krankheitsspezifische Mutationen gibt, kann es schwierig sein, einen gesunden Träger von einem betroffenen Individuum zu unterscheiden17. Das routinemäßige Screening aller Patienten ist von begrenztem klinischem Nutzen und Ceruloplasmin sollte nicht als Teil der empirischen Analyse von Tests verwendet werden, die den Leberbildschirm bilden. Eine vernünftigere Anwendung von Ceruloplasmin in einer ausgewählten Population mit einer höheren Wahrscheinlichkeit vor dem Test einer Wilson-Krankheit kann ihren Nutzen als Screening-Instrument erhöhen., Diagnostische Bewertungssysteme wie die vom EASL11 vorgeschlagene können dazu beitragen, ein niedriges Serum-Ceruloplasmin-Ergebnis zu stratifizieren oder zu kontextualisieren. Es besteht ein klarer Bedarf an einer verstärkten Aufklärung über die geeigneten Indikationen für Ceruloplasmin-Tests in allen überweisenden klinischen Fachgebieten, insbesondere jedoch in nicht-neurologischen und nicht-gastroenterologischen Quellen. Die Testleistung kann sich mit lokal validierten niedrigeren Referenzbereichen, der Einhaltung von Richtlinien und der Verwendung in einer ausgewählten Population verbessern.,
– Korrespondenz: S O ‚Sullivan
Abteilung für Neurologie, Cork University Hospital, Cork
Email:
Finanzierung
S O‘ Sullivan erhielt Unterstützung zur Teilnahme an Sitzungen von Eisai Pharma, UCB, AbbVie, Lundbeck Pharma und Teva Pharma
- Cauza E, Maier-Dobersberger T, Polli C, Kaserer K, Kramer L, Ferenci P. Screening für Wilson-Krankheit bei Patienten mit Leber-Krankheiten, die durch serum-ceruloplasmin. Zeitschrift für Hepatologie. 1997;27:358-62.
- Medici V, Rossaro L, Sturniolo GC. Wilson-Krankheit–ein praktischer Ansatz zur Diagnose, Behandlung und Nachsorge., Verdauungs-und Lebererkrankungen: Amtsblatt der Italienischen Gesellschaft für Gastroenterologie und der italienischen Vereinigung für das Studium der Leber. 2007;39:601-9.
- Roberts EA, Schilsky ML. Diagnose und Behandlung der Wilson-Krankheit: ein Update. Hepatology (Baltimore, Md). 2008;47:2089-111.
- Stremmel W, Meyerrose KW, Niederau C, Hefter H, Kreuzpaintner G, Strohmeyer G. Wilson disease: clinical presentation, treatment, and survival. Annalen der inneren Medizin. 1991;115:720-6.
- Hellman NE, Gitlin JD. Ceruloplasmin Stoffwechsel und Funktion. Jährliche Überprüfung der Ernährung., 2002;22:439-58.
- Scott J, Gollan JL, Samourian S, Sherlock S. Wilson-Krankheit, präsentiert als chronische aktive Hepatitis. Gastroenterologie. 1978;74:645-51.
- Deutsche JL, 3., Bearn AG. Wirkung von Östrogenen auf den Kupferstoffwechsel bei Morbus Wilson. Journal of clinical investigation. 1961;40:445-53.
- Mak CM, Lam CW, Tam S. Diagnostische Genauigkeit von Serum-Ceruloplasmin bei Wilson-Krankheit: Bestimmung der Empfindlichkeit und Spezifität durch ROC-Kurvenanalyse bei ATP7B-genotypen Probanden. Klinische Chemie. 2008;54:1356-62.,
- Ferenci P, Steindl-Munda P, Vogel W, Jessner W, Gschwantler M, Stauber R, Datz C, Hackl F, Wrba F, Bauer P, Lorenz O. Diagnostischen Wert der quantitativen Leber-Kupfer-Bestimmung bei Patienten mit Morbus Wilson. Klinische Gastroenterologie und Hepatologie : das offizielle klinische Praxisjournal der American Gastroenterological Association. 2005;3:811-8.
- Schah AB, Chernov I, Zhang HT, Ross BM, Das K, Lutsenko S, Pavone L, Evgrafov O, Ivanova-Smolenskaja IA, Annerén G, Westermark K, Urrutia FH, Penchaszadeh GK, Sternlieb I, Scheinberg IH, Gilliam TC, K. Petrukhin, Identifikation und Analyse von Mutationen im Wilson disease gene (ATP7B): Bevölkerung Frequenzen, Genotyp-Phänotyp-Korrelation und funktionelle Analysen. American journal of human genetics. 1997;61:317-28.
- EASL Clinical Practice Guidelines: Wilson ‚ s disease. Zeitschrift für Hepatologie. 2012;56:671-85.
- Gow PJ, Smallwood RA, Angus PW, Smith AL, Wall AJ, Sewell RB. Diagnose der Wilson-Krankheit: eine Erfahrung über drei Jahrzehnte. Darm. 2000;46:415-9.
- Tapper EB, Rahni TUN, Arnaout R, Lai M. Die übernutzung der serum-ceruloplasmin-Messung. Die American journal of medicine., 2013;126:926.e1-5.
- Goldstein IM, Kaplan HB, Edelson HS, Weissmann G. Ceruloplasmin: eine akute-phase-Reaktion, die aufgeräumt Sauerstoff-abgeleitet freie Radikale. Annalen der New Yorker Akademie der Wissenschaften. 1982;389:368-79.
- Arredondo M, Nunez H, Lopez G, Pizarro F, Ayala M, Araya M. Einfluss von östrogenen auf Kupfer Indikatoren: in-vivo und in-vitro-Studien. Biologische Spurenelementforschung. 2010;134:252-64.
- Dufour JF, Kaplan MM. Trüben Wasser: Wilson ‚ s disease Herausforderungen wird nicht bald verschwinden. Gastroenterologie. 1997;113:348-50.
17. Schilsky ML, Ala A., Gentests für Wilson-Krankheit: Verfügbarkeit und Nutzen. Aktuelle gastroenterologische Berichte. 2010;12:57-61.
Seite 341
















Schreibe einen Kommentar