| University of Sheffield | |
| Institut for Kemi | VSEPR |
Ammoniak har også fire elektron-par og koordinering geometri af kvælstof er baseret på en tetrahedrale arrangement af elektron-par. Der er kun tre bundne grupper, derfor er der et ensomt par. Men da de enlige par er ‘usynlige’, formen af ammoniak er pyramideformet.,r>
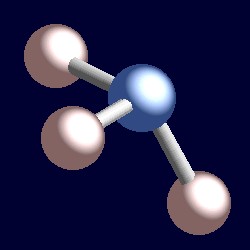
overvej et bindingspar af elektroner. De to elektroner er placeret mellem to kerner og tiltrækkes af begge. Et ensomt par er anderledes. Det er nødvendigvis kun tiltrukket af en kerne, og konsekvensen er, at den vedtager en position effektivt tættere på den ene kerne end bindingspar af elektroner. Dette betyder, at den effektive faste vinkel, der er besat af et ensomt par, er større end den, der er besat af et bindingspar., Enlige par kræver større vinkelrum og er placeret tættere på deres atomer end bindingspar. Konsekvensen af dette for ammoniak er, at det ensomme par giver plads til sig selv ved at skubbe de tre hydrogenatomer lidt sammen, og H-N-H-bindingsvinklerne er lidt mindre (106.6.) end den ideelle tetrahedrale vinkel på 109.5..
















Skriv et svar