US Pharm. 2010;35(5):36-41.
et forhold mellem diabetes mellitus (DM) og demens er ubestridelig, med adskillige undersøgelser, der konkluderer, at DM øger risikoen for kognitiv tilbagegang og demens, herunder Al .heimers sygdom (AD).1-5 DM øger ikke kun risikoen for demens, det øger faktisk graden af demensudvikling to til tredobbelt.,3 mekanismen for denne svækkelse forstås ikke fuldt ud, men det antages, at hyperglykæmi, insulinresistens, o .idativ stress, avancerede glycation slutprodukter og inflammatoriske cytokiner kollektivt fører til kognitiv dysfunktion.5 faktisk blev diabetes beskrevet som en “speciel form for accelereret aldring” i 1976 på grund af dens mange tilknyttede komplikationer.,5 den tilsyneladende overlapning mellem DM og demens har ført til antydningen om, at AD ikke kun er en neurologisk lidelse, men snarere en neuroendokrin lidelse, hvor Steen et al.,6
Oversigt over insulinresistens/Nedsat Glucose Tolerance
Patofysiologi: Både nedsat glukose-tolerance—defineret som et plasma glukose på 140 mg/dL til 199 mg/dL efter en oral glukose tolerance test—og impaired fasting glucose—defineret som en fastende plasma glukose på 100 mg/dL til 125 mg/dL—er diagnostisk for prædiabetes (forstadiet til type 2 DM ), som er en hæmoglobin A1C på 5,7% til 6,4%.7 patofysiologien for prediabetes er den samme som T2DM, der diagnosticeres efter en fastende blodglukose på 126 mg/dL eller derover eller en A1C på 6.,5% eller derover (testen gentages for bekræftelse).7 under begge forhold udvikles insulinresistens i det perifere væv, hvor insulin er nødvendigt til glukoseoptagelse (nemlig muskel, lever og fedt), og bugspytkirtlen tvinges til at levere stadig mere insulin for at overvinde denne modstand.8 i dette stadium er patienter ofte hyperinsulinemiske; over tid kan bugspytkirtlen imidlertid ikke imødekomme vævets krav, og de insulinproducerende beta-celler i bugspytkirtlen svigter langsomt og producerer stadig mindre insulin.,8 uden tilstrækkelig insulin stiger blodglukosekoncentrationerne, hvilket fører til prediabetes og hos op til 70% af patienterne med prediabetes T2DM.9 komplikationer af hyperglykæmi er mange og omfatter en øget risiko for macrovascular komplikationer (herunder myokardieinfarkt, cerebrovaskulær ulykke, og perifer karsygdom) og mikrovaskulære komplikationer (herunder nefropati, neuropati, og retinopati).7
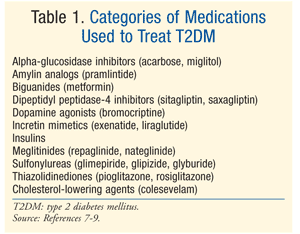
behandling: der findes mange terapier til behandling af DM., Den indledende behandling for både prediabetes og T2DM er livsstil ændring involverer kost, motion, og vægttab.7 American Diabetes Association (ADA) anbefaler også behandling af metformin hos patienter med prediabetes, der er i høj risiko for at udvikle diabetes.7 Metformin anbefales som initial farmakologisk behandling for T2DM.7 Ofte er der behov for yderligere farmakologisk terapi for at opnå ada-glykæmiske mål, herunder en A1C <7%.,7 Der er mange klasser af medicin for T2DM (TABEL 1), og valg af agent til at normalisere blodsukkeret, afhænger af et væld af patient – og medicin-specifikke faktorer. Det er vigtigt at bemærke, at mange patienter med T2DM i sidste ende vil kræve eksogent insulin for at opnå og opretholde euglykæmi, når betacellefunktionen gradvist falder.
Oversigt over AD
Patofysiologi: ANNONCEN er den mest almindelige form for demens hos ældre voksne, der tegner sig for 60% til 80% af alle tilfælde.,10 to histopatologiske kendetegn ved AD er neuritiske PLA plaues og neurofibrillære tangles.11 Pla Plaues består af uopløseligt beta-amyloidprotein. Tangles, som er intracellulære, er sammensat af phosphoryleret tau-protein. Tau-protein er vigtigt for mikrotubulesamling, og når dette protein er unormalt phosphoryleret, afbrydes neuronfunktionen. Neurofibrillære tangles påvirker oftest kolinerge neuroner.12 desuden bidrager forstyrrelse af den vigtigste e .citatoriske neurotransmitter, glutamat, til AD ‘ s patologi., I AD er der en overaktivering af glutamat, der signalerer en proces kendt som e .citotoksicitet, hvilket fører til PLA formationuedannelse, hyperphosphorylering af tau-protein og celledød.12 sammenfattende, excitotoxicity og dannelsen af neuritic plaques og neurofibrillary tangles forstyrre neurotransmitter veje, hvilket resulterer i læring og hukommelsessvækkelse, der er forbundet med AD.
behandling: de tilgængelige FDA-godkendte farmakologiske terapier for AD er opsummeret i tabel 2.,11,12, Mens der er stadig meget at lære med hensyn til behandlinger, der behandler eller ændre patologi ANNONCE, som i øjeblikket tilgængelige behandlinger indebærer brug af acetylcholinesterase-hæmmere, hvoraf der er fire, og N-methyl-d-aspartat receptor antagonist memantin.

Insulin og Hjernen
Selv om det er nødvendigt for glukose transport ind i perifere væv, insulin synes ikke at være nødvendige for transport af glucose i hjernen eller for cerebrale glukose metabolisme., Mens glukosetransport til hjernen ikke er afhængig af insulin, føres insulin i sig selv over blod–hjernebarrieren (BBB) af insulinreceptormedierede transportprocesser.13 Denne transportmekanisme er mættet; ved længerevarende perioder med overskydende insulin koncentrationer (hyperinsulinemia) i periferien, som dem, der ses i prædiabetes og T2DM, denne receptor-medieret transport mekanisme downregulates, hvorved transport af insulin i hjernen og cerebrospinalvæsken.,
ud over insulin er insulinlignende vækstfaktor type 1 (IGF-1) til stede i hjernen og er nødvendig for normal vækst og funktion af centralnervesystemet (CNS).14 Insulin-og IGF-1-receptorer er placeret i hele hjernen på neuroner og astrocytter (stjerneformede celler i CNS, der hjælper med at understøtte neuroner i hjernen). To områder af hjernen, der er afgørende for læring og hukommelse, hippocampus og hypothalamus, indeholder høje koncentrationer af insulinreceptorer.5 hos rotter har intracerebroventrikulær insulinadministration vist sig at forbedre hukommelsen.,15 derudover har intranasal insulinadministration hos mennesker vist sig at øge hukommelsesydelsen.16 som tidligere bemærket er insulin ikke påkrævet til cerebral glukosemetabolisme; der kan dog være specifikke områder i hjernen, hvor insulin udløser metaboliske processer, der involverer glukose. I rottestudier har insulin vist sig at påvirke glukoseudnyttelse i hypothalamus og locus coeruleus, to områder, der er vigtige for læring og hukommelse.,17 læring har også vist sig at lette øget ekspression af CNS-insulinreceptorer, hvilket fører til postuleringen, at tilstedeværelsen og aktiviteten af insulin i hjernen bidrager til og spiller en væsentlig rolle i læring og hukommelse. Insulin kan også bidrage til modulering af CNS-neurotransmittere, især acetylcholin og noradrenalin, som begge er kritiske for normal kognition og hjernesundhed.,18
insulinresistens og demens
oversigt: der ser ud til at være mange defekter i insulinsignalering i hjernen hos AD-patienter, hvilket fører til nedsat glukoseudnyttelse og energimetabolisme.6,19 da T2DM er associeret med perifer insulinresistens, er AD associeret med hjerneinsulinresistens.20 Tidligt i AD synes der at være utilstrækkelig insulinoptagelse og signalering i hjernen, et tegn på insulinresistens.5,19,21,22 øgede insulinreceptorer er set i hjernen hos patienter med AD, sandsynligvis som kompensation for insulinresistens.,21
generelt har denne svækkelse i insulinsignalering mange do .nstream-effekter i AD. En teori er, at lave koncentrationer af insulin i CNS forårsager et fald i acetylcholinniveauer og cerebral blodgennemstrømning.13 Desuden kan ændringer i insulinkoncentrationer fremme dannelse af beta-amyloid og tau-protein.2 i hjernen er insulinnedbrydende en .ym (IDE) involveret i nedbrydning og clearance af beta-amyloidproteiner.21 Høje niveauer af insulin hæmmer IDE og kan føre til et fald i beta-amyloid clearance, efterfølgende stigende hjernen aflejring af beta-amyloid.,5,19,21
for nylig har ceramider, en familie af lipider, befalet opmærksomhed for deres potentielle rolle i insulinresistens og demens.23,24 ceramider genereres i nærvær af inflammation, som er almindelig ved fedme, T2DM og AD.24 Fordi ceramid let krydser BBB, forårsager eksponering nedsat energimetabolisme og ændringer i insulingenekspression, hvilket bidrager til insulinresistens.23,24 dette er i øjeblikket et aktivt interesseområde, hvor forskere demonstrerer, at inhibering af ceramidsyntese forhindrede fedme-medieret insulinresistens.,24
intranasalt Insulin: som tidligere nævnt forbedrer intranasal insulinadministration hukommelsesydelsen hos mennesker.16 flere undersøgelser af intranasalt insulin er blevet udført. Ved administrationen af 20 enheder af intranasal insulin to gange dagligt for at forsøgspersoner, Reger et al fandt, at sammenlignet med placebo-gruppen, der er behandlet med insulin bevaret flere mundtlig information, og viste forbedret opmærksomhed og funktionel status.,25 disse forskere bemærkede også, at fastende plasmaglukose og insulin ikke ændrede sig med intranasal insulinbrug, hvilket indikerer, at intranasal administration giver direkte insulinadgang til CNS uden perifere virkninger.25,26
PPAR-Gamma-Agonister: Grundigt undersøgt til behandling af perifer insulinresistens, den thiazolidinediones rosiglitazon og pioglitazon er ved at blive undersøgt for deres rolle i behandling ANNONCE. Thia .olidinedioner er pero .isomproliferatoraktiverede receptorer (PPAR)-gammaagonister., PPAR-gamma er involveret i glucose og lipid metabolisme og modulerer inflammation, en kendt bidragyder til AD.22,27 Thia .olidinedioner er insulinsensibilisatorer, der arbejder for at reducere insulinresistens; de ser også ud til at reducere betændelse.21,26 i flere placebokontrollerede forsøg viste patienter behandlet med rosiglita .on forbedret hukommelse og kognitiv funktion.21,22,28 selvom kun små undersøgelser af pioglita .on er blevet udført, har denne medicin også været forbundet med forbedringer i hukommelse og kognition.,22 Selv om pioglitazon og rosiglitazon har dårlig BBB permeabilitet, hver af disse agenter er blevet dokumenteret i hjernen efter oral administration.22 selvom disse lægemidler kan spille en rolle i forebyggelsen eller behandlingen af AD, er de i øjeblikket ikke FDA-godkendt til patienter med AD, og deres potentielle fordele og risici skal overvejes grundigt individuelt.
aerob træning: måske er den mest effektive og mest oversete metode til at reducere insulinresistens fysisk aktivitet., Fedme har været forbundet med en øget risiko for insulinresistens, diabetes, demens og AD.29,30 træning forbedrer insulinfølsomheden og sænker det perifere insulinniveau.26,31 fysisk aktivitet, uafhængig af vægt, er forbundet med en lavere risiko for AD, hvilket gør det til den eneste beviste neuroprotektive terapi.29-31 en mulig mekanisme for denne neuroprotektion er, at motion fremmer clearance af beta-amyloidproteiner og øger hjerneafledt neurotrofisk faktor, en vækstfaktor, der er afgørende for kognition og neuronal overlevelse, der reduceres i AD.,32
Farmaceut Rolle
Farmaceuter kan spille en afgørende rolle i at uddanne patienter om nye behandlingsformer; de har også brug for at holde sig ajour med nye medicinske opdagelser eller betingelser, der ofte præsenteres i nyhederne. Type 3 diabetes er en sådan tilstand. Mens der stadig er meget at lære om denne potentielle nye forbindelse mellem diabetes og nedsat kognition, vil offentligheden spørge deres sundhedsudbyderes mening. Derudover vil mange patienter med diabetes være interesserede i at lære mere og vil henvende sig til deres apotekere for information., Derfor bør farmaceuter diskutere den nuværende forståelse af denne tilstand med deres patienter og også rådgive dem om strategier, der kan mindske deres risiko i betragtning af deres individuelle comorbiditeter.
konklusion
intensiv undersøgelse er i gang i et forsøg på bedre at karakterisere type 3 diabetes og udvikle forebyggende og terapeutiske strategier. Til dato er der ingen specifikke behandlinger med påvist effektivitet til forebyggelse af kognitiv tilbagegang eller AD hos patienter med DM., Derfor er håndteringen af kognitiv svækkelse hos patienter med DM identisk med den for patienter uden DM, med særlig opmærksomhed på glykæmisk kontrol og kardiovaskulære risikofaktorer. Dette er den samme tilgang, der allerede er vigtig for at forhindre DM-relaterede komplikationer. Mens nogle patientgrupper ser ud til at have en øget risiko for kognitiv svækkelse, har størstedelen af patienter med DM ikke veldefinerede kliniske foreninger., Selvom der ikke findes nogen specifikke behandlingsmuligheder, er den nuværende logiske tilgang at opnå glykæmisk kontrol og forsigtigt styre kardiovaskulære risikofaktorer, såsom hyperlipidæmi og hypertension.
1. Stewart R, Liolitsa D. Type 2-diabetes mellitus, kognitiv svækkelse og demens. Diabetes Med.
2. Xu WL, von Strauss E, Qiu CX, et al. Ukontrolleret diabetes øger risikoen for al .heimers sygdom: en befolkningsbaseret kohortundersøgelse. Diabetologia. 2009;52:1031-1039.
3. Arvanitakis Z, Wilson RS, Bennett DA. Diabetes mellitus, demens og kognitiv funktion hos ældre personer., J Nutr Sundhed Aldring. 2006;10:287-291.
4. Jacobson AM, Musen g, Ryan CM, et al. Langsigtet effekt af diabetes og dens behandling på kognitiv funktion. N Engl J Med. 2007;356:1842–1852.
5. Whitmer RA. Type 2 diabetes og risiko for kognitiv svækkelse og demens. Curr Neurol Neurosci Rep. 2007;7:373-380.
6. Steen e, Terry BM, Rivera EJ, et al. Nedsat insulin og insulinlignende vækstfaktorudtryk og signalmekanismer i Al ?heimers sygdom—er denne type 3 diabetes? J Al Alheimers Dis. 2005;7:63-80.
7. American Diabetes Association. Standarder for lægehjælp i diabetes-2010., Diabetes Pleje.
8. Triplitt Cl, Reasner CA, Isley WL. Diabetes mellitus. I: DiPiro JT, Talbert RL, Yee GC, et al, eds. Farmakoterapi principper & praksis. 7. udgave. New York, ny: McGraw Hill Medical; 2008:1205-1241.
9. Nathan DM, Buse JB, Davidson MD, et al. Medicinsk behandling af hyperglykæmi ved type 2-diabetes: en konsensus algoritme for igangsætning og justering af behandlingen: en konsensus erklæring af American Diabetes Association og European Association for the Study of Diabetes. Diabetes Pleje.
10. Hebert LE, Scherr PA, Bienias JL et al., Al .heimers sygdom i den amerikanske befolkning: prævalensestimater ved hjælp af 2000-folketællingen. Arch Neurol. 2003;60:1119-1122.
11. Cummings J. Al .heimers sygdom. N Engl J Med. 2004;351:56-67.
12. Slattum P., S .erdlo. RH, Hill AM. Al .heimers sygdom. I: DiPiro JT, Talbert RL, Yee GC, et al, eds. Farmakoterapi principper & praksis. 7. udgave. New York, ny: McGraw Hill Medical; 2008:1051-1065.
13. Craft s, GATSON GS. Insulin og neurodegenerativ sygdom: fælles og specifikke mekanismer. Lancet Neurol. 2004;3:169-178.
14. de la Monte sm, tryllestave JR., Gennemgang af insulin og insulinlignende vækstfaktorudtryk, signalering og funktionsfejl i centralnervesystemet: relevans for al .heimers sygdom. J Al Alheimers Dis. 2005;7:45-61.
15. Park CR, Seeley RJ, håndværk s, Woodsoods SC. Intracerebroventrikulært insulin forbedrer hukommelsen i en passiv-undgåelsesopgave. Fysiol Behav. 2000;68:509-514.
16. Fehm HL, Perras B, Smolnik R, et al. Manipulering af neuropeptidergic veje hos mennesker: en ny tilgang til neurofarmakologi? Eur J Pharmacol. 2000;405:43-54.
17. Alkhao W,, Alkon DL. Insulin og insulin receptors rolle i indlæring og hukommelse., Mol-Celleendokrinol. 2001;177:125-134.
18. Kopf s, Baratti C. effekter af posttraining administration af insulin på tilbageholdelse af et habituationsrespons hos mus: deltagelse af en central kolinerg mekanisme. Neurobiol Lære Mem.
19. Revill P, Moral MA, Prous JR. nedsat insulin signalering og patogenesen af Al .heimers sygdom. Narkotika I Dag (Barc). 2006;42:785-790.
20. Moro, N, Tong m, Longato L et al. Begrænset al neuroheimer-type neurodegeneration ved eksperimentel fedme og type 2 diabetes mellitus. J Al Alheimers Dis. 2008;15:29-44.
21. Haan MN., Terapi insight: type 2 diabetes mellitus og risikoen for sent debut Al .heimers sygdom. Nat Clin Pract Neurol. 2006;2:159-166.
22. Landreth G, Jiang,, Madrekar s, et al. Ppargamma agonister som terapeutiske midler til behandling af Al .heimers sygdom. Neuroterapeutika. 2008;5:481-489.
23. Lyn-Cook LE, La .ton m, Tong m et al. Hepatisk ceramid kan formidle hjerneinsulinresistens og neurodegeneration ved type 2-diabetes og ikke-alkoholisk steatohepatitis. J Al Alheimers Dis.
24. Tong M, de la Monte SM. Mekanismer for ceramidmedieret neurodegeneration. J Al Alheimers Dis.
25., Reger MA, GATSON GS, grøn PS. Intranasalt insulin forbedrer kognition og modulerer beta-amyloid i tidlig e.kr. Neurologisk. 2008;70:440-448.
26. Craft S. insulinresistens syndrom og Al .heimers sygdom: alder – og fedme-relaterede effekter på hukommelse, amyloid og inflammation. Neurobiol Aldring. 2005; 26 (suppl 1): 65-69.
27. Jiang,, Heneka M, Landreth GE. Pero .isomproliferatoraktiveret receptor-gamma (PPARgamma) rolle i Al .heimers sygdom: terapeutiske implikationer. CNS-lægemidler. 2008;22:1-14.
28. Watson GS, Cholerton BA, Reger MA, et al., Bevares kognition hos patienter med tidlig Alzheimers sygdom og amnestiske mild kognitiv svækkelse under behandling med rosiglitazon: en foreløbig undersøgelse. Am J Geriatr Psychiatry. 2005;13:950-958.
29. Luchsinger JA, Mayeu.R. Adiposity og Al .heimers sygdom. Curr Alzheimer Res. 2007;4:127-134.
30. Whitmer RA. Epidemiologi af fedme og demens. Curr Alzheimer Res. 2007;4:117-122.
31. Insulinatson GS, Craft S. insulinresistensens rolle i patogenesen af Al .heimers sygdom: konsekvenser for behandlingen. CNS-lægemidler. 2003;17:27-45.
32. Cole GM, Frautschy SA., Rolle insulin og neurotrofisk faktor signalering i hjernen aldring og Al .heimers sygdom. Exp Gerontol. 2007;42:10-21.
















Skriv et svar