tænk på, hvad der sker halvvejs gennem farveændringen. På dette tidspunkt er koncentrationerne af syren og dens ion ens. I så fald vil de annullere ud af det venlige udtryk.
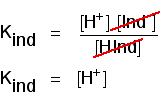
Du kan bruge dette til at finde ud af, hvad pH er på dette halvvejs punkt., Hvis du re-arrangere den sidste ligning, så den hydrogen ion koncentration er på venstre side, og derefter konvertere til pH og pKind, får du:
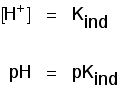
det betyder, At slutpunktet for indikatoren afhænger helt af, hvad dens pKind værdi. For de indikatorer, vi har set på ovenfor, disse er:
| – indikator | pKind |
|---|---|
| lakmus | 6.5 |
| methyl orange | 3.7 |
| phenolphtalein | 9.,3 |
ph-indikatorområdet
indikatorer ændrer ikke farve kraftigt ved en bestemt pH (givet af deres pKind). I stedet ændrer de sig over et snævert pH-område.
Antag, at ligevægten er fast til den ene side, men nu tilføjer du noget for at begynde at skifte det. Efterhånden som ligevægten skifter, vil du begynde at få mere og mere af den anden farve dannet, og på et tidspunkt vil øjet begynde at opdage det.Antag for eksempel, at du havde methylorange i en alkalisk opløsning, så den dominerende farve var gul., Begynd nu at tilføje syre, så ligevægten begynder at skifte.
på et tidspunkt vil der være nok af den røde form af methylorange til stede, at opløsningen vil begynde at tage en orange farvetone. Når du fortsætter med at tilføje mere syre, vil den røde til sidst blive så dominerende, at du ikke længere kan se nogen gul.
Der er en gradvis glat skifte fra den ene farve til den anden, der finder sted over et bredt udvalg af pH. Som en grov “tommelfingerregel”, den synlige forandringer finder sted omkring 1 pH-enhed på hver side af pKind værdi.,
Den nøjagtige værdier for de tre indikatorer, vi har kigget på, er:
| – indikator | pKind | pH-interval |
|---|---|---|
| lakmus | 6.5 | 5 – 8 |
| methyl orange | 3.7 | 3.1 – 4.4 |
| phenolphtalein | 9.3 | 8.3 – 10.0 |
Den afgørende farve forandring sker over en usædvanlig bred vifte, men det er nyttigt til påvisning af syrer og baser i laboratoriet, fordi den skifter farve omkring pH 7., Methyl orange eller phenolphthalein ville være mindre nyttigt.
dette ses lettere diagramatisk.
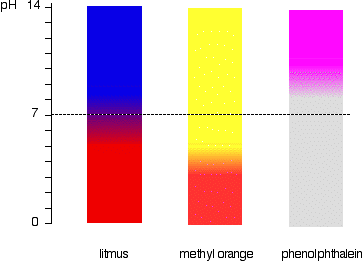
For eksempel, methyl ville orange gul i enhver opløsning med en pH-værdi der er større end 4.4. Det kunne ikke skelne mellem en svag syre med en pH på 5 eller en stærk alkali med en pH på 14.
Valg af indikatorer for titreringer
Husk, at ækvivalens punkt af en titrering er der, hvor du har blandet de to stoffer i præcis ligning proportioner., Du skal selvfølgelig vælge en indikator, der skifter farve så tæt som muligt på det ækvivalenspunkt. Det varierer fra titrering til titrering.
stærk syre v stærk base
det næste diagram viser ph-kurven for tilsætning af en stærk syre til en stærk base. Overlejret på det er pH-intervallerne for methylorange og phenolphthalein.
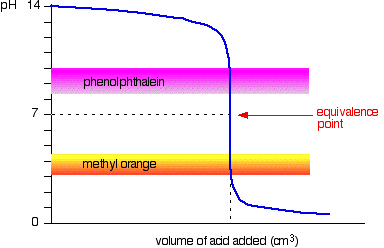
Du kan se, at ingen af indikatorerne ændrer farve ved ækvivalenspunktet.,
grafen er dog så stejl på det tidspunkt, at der næsten ikke vil være nogen forskel i mængden af tilsat syre, uanset hvilken indikator du vælger. Det ville dog være fornuftigt at titrere til den bedst mulige farve med hver indikator.
Hvis du bruger phenolphthalein, titrerer du, indtil det bare bliver farveløst (ved pH 8, 3), fordi det er så tæt som muligt på ækvivalenspunktet.
På den anden side, ved hjælp af methylorange, ville du titrere, indtil der er det allerførste spor af appelsin i opløsningen., Hvis løsningen bliver rød, kommer du længere fra ækvivalenspunktet.
Stærk syre v svag base
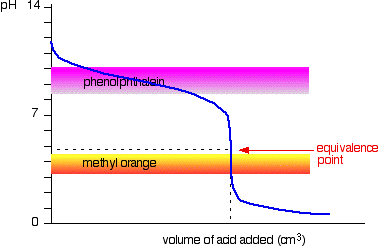
Denne gang er det indlysende, at phenolphtalein ville være fuldstændig ubrugelig. Imidlertid begynder methylorange at ændre sig fra gul til orange meget tæt på ækvivalenspunktet.
Du skal vælge en indikator, der skifter farve på den stejle bit af kurven.
Svag syre v stærk base
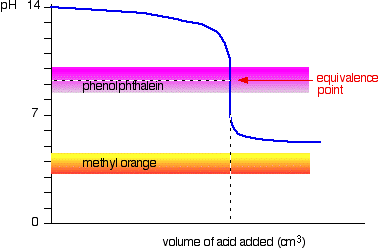
Denne gang, methyl orange er håbløs!, Phenolphthalein ændrer imidlertid farve nøjagtigt, hvor du vil have det.
svag syre v svag base
kurven er for et tilfælde, hvor syren og basen begge er lige svage – for eksempel ethansyre og ammoniakopløsning. I andre tilfælde vil ækvivalenspunktet være ved en anden pH.
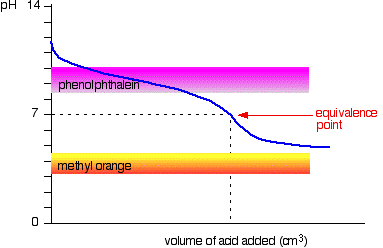
Du kan se, at ingen af indikatorerne er nogen brug. Phenolphthalein vil være færdig med at ændre sig godt før ækvivalenspunktet, og methylorange falder helt ud af grafen.,
det kan være muligt at finde en indikator, der begynder at ændre sig eller slutter ved ækvivalenspunktet, men fordi ækvivalenspunktets pH vil være forskellig fra sag til sag, kan du ikke generalisere.
i det hele taget vil du aldrig titrere en svag syre og en svag base i nærværelse af en indikator.
natriumcarbonatopløsning og fortyndet saltsyre
Dette er et interessant specielt tilfælde., Hvis du bruger phenolphthalein eller methylorange, giver begge et gyldigt titreringsresultat – men værdien med phenolphthalein vil være nøjagtigt halvdelen af methylorange.
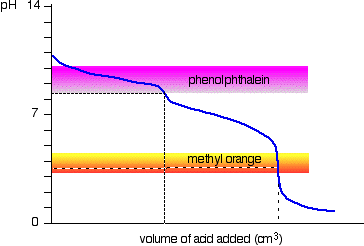
det sker så, at phenolphthalein har afsluttet sin farveændring ved nøjagtigt pH for ækvivalenspunktet for den første halvdel af reaktionen, hvor natriumhydrogencarbonat produceres.
![]()
![]()
methylorange ændrer farve ved nøjagtigt pH for ækvivalenspunktet for reaktionens anden fase.,
![]()
![]()
Spørgsmål for at teste din forståelse
Hvis dette er det første sæt af spørgsmål, du har gjort, kan du læse det indledende side, før du starter. Du skal bruge tilbage-knappen i din bro .ser for at komme tilbage her bagefter.
spørgsmål om indikatorer
svar
Hvor vil du gerne hen nu?
til menuen syre-base balance . . .
til menuen Fysisk Kemi . . .
til hovedmenuen . . .,
















Skriv et svar