Indledning
Replikation i kernen af eukaryote celler beskæftiger tre DNA-polymeraser: – polymerase α, δ og ε (Hubscher et al., 2002; Pavlov et al., 2006b; Kunkel and Burgers, 2008; Loeb and Monnat, 2008; Burgers, 2009; Pavlov and Shcherbakova, 2010; Lange et al., 2011)., DNA-syntese er retningsbestemt, og provenuet fra 5′ til 3′, hvor nucleophilic angreb på α fosfat af en nukleotid af 3 ‘ OH af en primer, der resulterer i inkorporering af en nukleosid monophosphat og frigivelse af pyrofosfat (Steitz, 1999). Alle DNA-polymeraser kræver en primer og en fri 3 ‘ OH for at udføre DNA-syntese, og pol is er ingen undtagelse. Pol α er en heterotetramer sammensat af to-primase underenheder og to-polymerase underenheder., Primaseunderenhederne initierer DNA-replikation ved at syntetisere korte (7-12 ribonukleotider) RNA-primere, som derefter forlænges med polymerase a (Pellegrini, 2012). DNA-polymerase and Og and forlænger primerne genereret af pol α på en nøjagtig og processiv måde (Kunkel, 2004, 2011; Pellegrini, 2012). I gær har DNA-polymerase has vist sig at være essentiel for DNA-syntese af den hængende streng, mens pol appears ser ud til hovedsageligt at fungere ved den førende streng (Pursell et al., 2007; Nick Mcelhinny et al., 2008; Kunkel, 2011; Georgescu et al., 2014)., I modsætning hertil er replikation i mitokondrier ansvaret for en eneste polymerase, DNA-polymerase γ (Lee et al., 2009).
DNA-polymeraser er grupperet i syv familier (a, b, C, d,,, Y og RT). I eukaryoter hører de tre nukleare replikative DNA-polymeraser tilfældigvis til B-familien (Burgers et al., 2001; Patel og Loeb, 2001). Der er nu krystaller strukturer af alle tre replikation af DNA-polymeraser fra gær, som giver for første gang en sammenligning af deres fælles strukturelle elementer, samt en undersøgelse af deres unikke egenskaber (Swan et al., 2009; Perera et al. ,, 2013; Hogg et al., 2014; Jain et al., 2014a). Alle tre replikation af DNA-polymeraser multi-enhed enzymer (Tabel 1) (Johansson og Macneill, 2010; Pavlov og Shcherbakova, 2010; Makarova et al., 2014). Det primære fokus for denne undersøgelse er på deres katalytiske domæne, eller underenhed A.
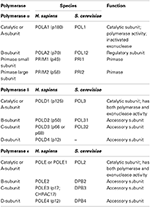
Tabel 1. Eukaryote DNA-polymeraser er multi-subunit en .ymer.,
den Overordnede Struktur af B-Familie-Polymeraser
Alle DNA-polymeraser har en fælles polymerase fold, som har været i forhold til et menneske, højre hånd, der består af tre underdomæner: fingre, håndflade og tommelfinger (Steitz, 1999; Patel og Loeb, 2001). Håndfladen, en stærkt konserveret fold sammensat af fire antiparallelle strands-tråde og to helices, har to strengt konserverede katalytiske aspartater placeret i motiv A, D..lyps og motiv C, DTDS (Delarue et al., 1990; Braith andaite og Ito, 1993)., Dette RRM-ligesom fold er delt af en meget stor gruppe af enzymer, herunder DNA-og RNA-polymeraser, reverse transcriptases, CRISPR polymerase, og selv reverse (3′-5′) transferaser som Thg1 (Anantharaman et al., 2010; Hyde et al., 2010). I modsætning hertil udviser tommelfinger og fingre underdomæner væsentligt mere strukturel mangfoldighed (Steit., 1999). Fingrene gennemgår en konformationsændring ved binding af DNA og det korrekte indkommende nukleotid. Denne bevægelse tillader rester i fingers underdomæne at komme i kontakt med nukleotidet i det spirende basepar., Tommelfingeren holder DNA-duple .et under replikation og spiller en rolle i processivitet (Doubli and og Ellenberger, 1998; Doubli.et al., 1999).
eukaryote DNA-polymeraser α,, Og ε deler homologi med mange arkæale, bakterielle, bakteriofager og virale polymeraser (Delarue et al., 1990; Braith andaite and Ito, 1993; Franklin et al., 2001; Firbank et al., 2008; Wanang og Yang, 2009)., Koonin og samarbejdspartnere bidrog med en detaljeret fylogenetisk analyse af archaeask DNA-polymeraser, og deres forhold til eukaryote polymeraser i denne udgave af Frontiers in Microbiology dedikeret til polymeraser Makarova et al. (2014).
Alle B-familie-polymeraser er sammensat af fem underdomæner: fingrene, tommelfinger, og palm (beskrevet ovenfor), der udgør kernen af det enzym, samt en exonuclease domæne og et N-terminale domæne (NTD) (Franklin et al., 2001; Konia og Konigsberg, 2014) (Figur 1; tabel S1)., E .onuclease-domænet bærer en 3′-5′ korrekturlæsningsaktivitet, som fjerner misincorporerede nukleotider. Det aktive sted E .onuclease er placeret 40-45 Å væk fra det aktive sted for polymerase. NTD synes at være blottet for katalytisk aktivitet. I pol comprises består NTD af tre motiver: den ene har en topologi, der ligner en OB-fold, et enkeltstrenget DNA-bindingsmotiv, og den anden har et RNA-bindende motiv (RNA-Genkendelsesmotiv eller RRM) (s .an et al., 2009). I bakteriofag T4 reducerer mutationer i NTD ekspressionen af polymerasen (Hughes et al., 1987)., I RB69 og T4 binder gp43-polymerasen sit eget messenger RNA, formodentlig gennem NTD og undertrykker oversættelse (Petrov et al ., 2002), hvilket ikke synes at være tilfældet for pol ((s (an et al., 2009). Nye data indikerer, at NTD spiller en rolle i polymerasestabilitet og troskab gennem dets interaktioner med andre domæner (Li et al., 2010; Prindle et al., 2013) (se nedenfor).
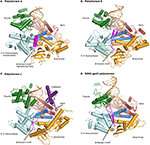
Figur 1. Ternære komplekser af polymeraser α,,, ε og RB69 gp43 er illustreret fra identiske orienteringer til sammenligning., Tommelfingeren (grøn) og fingrene (Mørkeblå) domæner griber duple.nukleinsyren (primer vist i beige, skabelon i orange) mod palmedomænet (rødt). Det N-terminale domæne vises i guld, der støder op til 3′ -5 ‘ e .onuclease-domænet (cyan). (A) Polymerase α (PDBID 4FYD) binder en RNA/DNA-hybrid, hvor den brede, lavvandede mindre rille af A-form-DNA er synlig nær tommelfingeren. 3’ -5 ‘ e .onuclease-domænet er blottet for aktivitet. En spiralformet region (magenta) i det inaktiverede e .onuclease-domæne stabiliserer skabelonens 5 ‘ ende., (B) – Polymerase δ (PDBID 3IAY) rummer en stor β hårnål motiv (magenta), hvilket er vigtigt at skifte de primer strand fra polymerase aktive site til exonuclease aktive site i tilfælde af korrekturlæsning. (C) Polymerase ε (PDBID 4M8O) har et unikt P-domæne (lilla), som giver polymerasen øget processivitet. Interessant nok er Hair-hårnålsmotivet atrofieret i pol ε., (D) Bevarelse af familien B-DNA-polymerase fold, og domæne-organisationen, er tydeligt, når modellen enzym fra bakteriofag RB69 gp43 (PDBID 2OZS) ses sammen med de tre eukaryote replikation polymeraser. Afgrænsningen af domænet for hver polymerase er angivet i tabel S1. Figur blev lavet med PyMOL (Pymol Molecular Graphics System, Version 1.5.0.4 Schr .dinger, LLC.).
Alle pattedyr B-family DNA-polymeraser er kendt for at huse to cystein-rige metal-binding sites (CysA og CysB) i deres C-terminale domæne (CTD) (Figur 2)., CysA antages at være et bindinginkbindende sted, mens CysB er en jernsvovlklynge (Net.et al., 2012). Tab af klyngen i CTD af gær pol δ påvirker negativt interaktioner med dets Tilbehør B-underenhed (Sanche.Garcia et al., 2004). Det zinkbindende motiv blev vist at være vigtigt for interaktion mellem pol with og dens processivitetsfaktor, PCNA (Net.et al., 2012).

Figur 2. Skematisk diagram over de tre Saccharomyces cerevisiae replikative DNA-polymeraser α, and Og ε., DNA-polymerasen fra bakteriofag RB69 er vist til sammenligning.
DNA-Polymerase α
Den katalytiske subunit af DNA-polymerase α er sammensat af 1468 aminosyrer (Tabel 2). Proteinkonstruktionen designet til krystallisation blev afkortet ved N – og C-termini (rester 349-1258) og mangler derfor CTD og dens klynge (figur 2). Konstruktionen blev krystalliseret unliganded, i en binær kompleks med en DNA/RNA hybrid oligonukleotid, og i en ternære kompleks med DNA/RNA og indgående nukleotid (Perera et al., 2013) (Figur 1).,

Tabel 2. Kompilering af DNA-polymeraser af B-familien med kendt struktur.
En Mekanisme for Tilbagetrækning af Polymerase
RNA/DNA oligonukleotid fanget i krystaller, vedtager En a-form kropsbygning, som forventet. Tommelfingerdomænet indgår i flere interaktioner med RNA-primeren, både via hydrofobe kontakter og polære interaktioner (Perera et al., 2013)., Eksperimenter i opløsning har vist, at forlængelsen af RNA-primeren med pol α er begrænset til 10-12 nukleotider, hvilket svarer til en omdrejning af en heli.. Denne observation førte forfatterne til at foreslå en mekanisme til afslutning af primersyntese med pol α, hvor tab af specifikke interaktioner mellem tommelfingeren og RNA ville udløse polymerasen til at frigøre sig fra DNA/RNA-oligonukleotid og tillade en hånd væk til en replikativ polymerase.,
bevægelser i Palmedomænet kan lette translokation af Pol
efter at have krystalliseret en .ymet i tre tilstande (apo, binært og ternært) tillod forfatterne at overlejre alle tre strukturelle modeller. Pol is er den eneste eukaryote familie B DNA-polymerase, for hvilken alle tre stater blev fanget i en krystalstruktur. Den strukturelle superposition afslørede, at ud over de veldokumenterede bevægelser af fingre og tommelfinger-underdomæner, der ledsager substratbinding og nukleotidyloverførsel, gennemgår palm-underdomænet selv en strukturel omlægning (Perera et al.,, 2013). Forfatterne foreslår, at de forskellige konformationer af palmedomænet kunne lette translokation af pol along langs og ud over RNA/DNA-duple .et. Som nævnt ovenfor forventes tab af kontakter til RNA-strengen at udløse frigivelse af primer, som derefter bliver tilgængelig til forlængelse med pol or eller ε.,
Et Andet Protein Fold i den Inaktiverede Exonuclease Underdomæne
korrekturlæsning aktivitet er afskaffet i pol α, på grund af mutationer i alle fire carboxylater (Asp114/Glu116/Asp222/Asp327 i RB69 gp43 svarer til Ser542/Gln544/Tyr644/Asn757 i en struktur-baseret tilpasning) (Tabel 2). Desuden β-hairpin motiv findes i de fleste polymeraser af B-familien (rester 246-267 i RB69 gp43) er erstattet af en spiralformet region i pol-α (rester 667-676; 681-693) (Hogg et al., 2007)., Β hårnålen er en del af exonuclease domæne, og har været vist i T4 og RB69 paul til at deltage i opdelingen af DNA-primer mellem polymerase og exonuclease aktive site (Reha-Krantz, 1988; Stocki et al., 1995; Hogg et al., 2007). I mangel af korrekturlæsningsaktivitet er det ikke overraskende, at dette motiv ikke blev bevaret i pol α. Rester hans 684 og Phe 685 af den spiralformede region i pol stack stak med en thymin og guanin base, henholdsvis på positionerne -3 og -2 i den uparrede 5 ‘ ende af skabelonen(Perera et al ., 2013)., Således, i pol α den region, der svarer til β-hairpin motiv vedtager en anden fold (helices vs. β-strenge), og en anden funktion (stabiliserende den ønskede region i skabelon strand i stedet for at lette aktive site skift). Da pol α er blottet for korrekturlæsningsaktivitet, opstår spørgsmålet om, hvorvidt de korte oligonukleotider korrigeres, og i bekræftende fald ved hvilken DNA-polymerase. Det ser ud til, at korrekturlæsning af primerne syntetiseret ved pol α udføres af pol ((Pavlov et al., 2006a).,
DNA-Polymerase
Human pol is består af fire underenheder, hvorimod Saccharomyces cerevisiae har tre (Gerik et al., 1998; Liu et al., 2000) (tabel 1). Ud over dets funktion i DNA-replikation har pol has vist sig at spille en rolle i DNA-reparation og rekombination (Hubscher et al., 2002; Lee et al., 2012; Tahirov, 2012). P12, den mindste underenhed i human pol and og også underenheden, der ikke ses i spirende gær, nedbrydes som reaktion på DNA-skade (Lee et al., 2014). Den katalytiske underenhed af gær pol ((POL3) består af 1097 rester., Konstruktionen anvendt til krystallisation omfatter rester 67-985 og mangler således CTD (Figur 1; Tabel 2).
Tredje Metal-Ion-i-Polymerase Aktive Site
palm domæne indeholder tre bevaret carboxylater (Asp608, Asp762, og Asp764). De to katalytiske aspartater, Asp608 og Asp764, kontakter to metalioner (Ca2+) på det aktive polymerasested adskilt med 3.7 Å. Intriguingly blev et tredje metal observeret koordineret af Y-phosphatet af det indkommende nukleotid og Glu802, med Glu800 i nærheden., Mutering af begge glutamater til alanin gav en polymerasevariant med reduceret inkorporeringseffektivitet for både korrekte og forkerte nukleotider (s .an et al., 2009). På disse aminosyre positioner, pol-α-og pol-ε også har carboxylat rester (pol δ Glu800/Glu802 svarer til pol α Asp1033/Asp1035, og pol ε Glu945/Asp947). Hvorvidt disse Carbo andylater spiller lignende roller i pol and Og ε, skal stadig undersøges.,
high Fidelity and Proofreading
Human pol is er en high-fidelity polymerase, der katalyserer nukleotidyloverførselsreaktionen med en fejlfrekvens på 1 per 22.000 (Schmitt et al., 2009). Korrekturlæsning øger polymerasens troskab med en faktor på 10-100 (Mcculloch and Kunkel, 2008; Prindle et al., 2013). Pol δ har et polymerase-og e .onuclease-aktivt sted, adskilt af omkring 45 Å (s .an et al., 2009). DNA-polymeraser med korrekturlæsningsaktivitet er i stand til at fornemme misincorporerede nukleotider ved at kontakte den mindre rille af basepar ud over indsættelsesstedet., Proteinet interagerer med universelle hydrogenbindingsacceptorer ved henholdsvis N3-og O2-positionerne af puriner og pyrimidiner (Seeman et al ., 1976; Doubli et et al., 1998; Franklin et al., 2001). Disse hydrogenbindingskontakter bevares, når baseparret vedtager en geometryatson-Crick-geometri og går tabt i tilfælde af mismatch. I RB69 gp43 strækker kontakterne sig til de to første basepar ud over det spirende basepar (Franklin et al., 2001; Hogg et al., 2004, 2005). Kontakterne er meget mere omfattende i pol,, der strækker sig til fem basepar efter indsættelse (s .an et al.,, 2009), som kunne bidrage til dens høje troskab.
Som nævnt ovenfor, β-hairpin segment fra exonuclease domæne spiller en afgørende rolle i delingen af DNA mellem polymerisering og korrekturlæsning steder i T4 og RB69 paul (Stocki et al., 1995; Hogg et al., 2007). I RB69 gp43 vedtager Mo-hårnålsmotivet forskellige konformationer, afhængigt af om komplekset blev opnået med ubeskadiget DNA (Franklin et al., 2001; 2001ahn et al., 2007) eller DNA indeholdende en skade (Freisinger et al., 2004; Hogg et al., 2004)., Det blev fuldt visualiseret kontakte både primer og skabelon tråde i et kompleks med thymine glycol (Aller et al., 2011). Tilsvarende β-hairpin i pol δ stikker ud i den store fordybning i DNA og fungerer som en kile mellem dobbelt-strenget DNA og enkelt-strenget 5’end af den skabelon, strand, som er stabiliseret af to aromatiske rester Phe441 og Tyr446 (Figur 1) (Swan et al., 2009). Placeringen af β-hårnålen er i overensstemmelse med en rolle i aktiv site s .itching.,
Interdomain-kontakter og troskab
mutationer involveret i kræft findes for det meste i e .onuclease-domænet for pol and Og and, hvilket understreger korrekturlæsningens kritiske rolle i sænkning af forekomsten af mutationer (kirke et al., 2013; Henninger og Pursell, 2014). En mutation i humane kolorektale cancerceller lokaliseres til fingers domæne, R689.. den analoge mutation i gær (R696.) resulterer i en mutator fænotype (Daee et al., 2010)., En mutation i nærheden af Arg696 i det stærkt konserverede motiv B i fingers underdomæne af gær pol ((A699.) resulterer også i en mutatorfænotype. Denne region af fingrene ligger tæt på NTD. Muterende Met540 af NTD til alanin afskaffer mutatorfænotypen af A699., hvilket illustrerer, at interaktioner mellem fingrene og NTD kan påvirke polymerasens troskab (Prindle et al., 2013)., Tilsvarende i T4 og RB69 pols NPL-kernemotivet, der involverer rester fra N-terminalen og palmedomænerne, er i kontakt med fingers domænet og blev vist at stabilisere polymerase-DNA-komplekser (Li et al., 2010).
DNA-Polymerase ε
Den katalytiske subunit af DNA-polymerase ε er et produkt af en meget stor gene (2222 aminosyrer i gær; 2286 i mennesker), og det er kun tredje i størrelse efter polymerase ζ (også et medlem af B-familien) og pol θ, en familie, En polymerase (3130 og 2590 aminosyrer, henholdsvis i mennesker) (Lange et al.,, 2011; Hogg og Johansson, 2012) (Figur 1, Tabel 2). Pol is er dobbelt så stor som pol and og består af to tandem polymerase/e .onuclease regioner. N-terminalsegmentet har både polymerase-og korrekturlæsningsaktiviteter, mens C-terminalsegmentet er inaktiveret. De to exonuclease-polymerase moduler er fjernt beslægtede (Tahirov et al., 2009). Selv om den inaktiverede segment antages at spille en strukturel rolle under replikation, er to grupper, der var i stand til at krystallisere katalytisk aktive pol ε konstruktioner (rester 1-1228; 1-1187) mangler hele C-terminal modul (Hogg et al.,, 2014; Jain et al., 2014a). Begge krystalstrukturer var af et ternært kompleks af polymerasen, DNA-primer/skabelon og indgående nukleotid.
et nyt Processivitetsdomæne, der stammer fra Palmedomænet
Pol differs adskiller sig fra pol in, idet det ikke kræver DNA-glidende klemme PCNA for høj processivitet (Hogg og Johansson, 2012). Palm domænet af pol is er væsentligt større (380 rester) end for pol or eller respectively (175 og 203 rester, henholdsvis)., De nylige pol crystal-krystalstrukturer afslørede, at indsættelser i palm-domænet samlet udgør et nyt domæne bestående af tre β-strenge og to helices (rester 533-555; 682-760) (Hogg et al., 2014; Jain et al., 2014a) (Figur 1; tabel S1). Sletning af rester 690-751 resulterede i en variant med nedsat polymeraseaktivitet. Desuden muterer positivt ladede rester (His748, Arg749, og Lys751), der ligger i nærheden af phosphat-rygraden påvirket processivity af enzymet (Hogg et al., 2014)., Det ekstra domæne, der stammer fra håndfladen, blev således navngivet processivity eller P-domænet efter dets funktion. Basen af P-domænet har et metalbindingssted (se nedenfor) (Hogg et al., 2014; Jain et al., 2014a,b).
En Jern-Svovl Klynge inden for Polymerase Domæne
Uventet løsning undersøgelser viste, at den katalytiske subunit af gær-polymerase ε i sig selv indeholder en klynge inden for sin polymerase fold (Jain et al., 2014b), ud over klyngen i CTD (figur 2; Tabel 2)., Den anden klynge inden for pol suggests antyder, at denne polymerase kan være mere følsom over for O .idativ stress (Jain et al., 2014b). Krystalstrukturerne i pol reveal afslørede imidlertid ikke en klynge i polymerasedomænet (Hogg et al., 2014; Jain et al., 2014a; 2014ahn og Doubli and, 2014). To af cysteineresterne er uordnede i de strukturelle modeller, og det resulterende metalbindingssted ser ud til at binde .ink (Hogg et al., 2014; Jain et al., 2014a). Substitution af a med et ikke-nativt .ink i metalbindende proteiner er ikke usædvanligt (Net.et al., 2012) som klynger er labile., Visualisering inden for polymerase domæne af pol may kan nødvendiggøre anaerobe betingelser.
En Kort β-Hairpin Motiv i Exonuclease Domæne
I en DNA-polymerase, der huser både polymerase og exonuclease aktiviteter det bundne DNA er i ligevægt mellem de to aktive centre (Beechem et al., 1998). Koncentrationen af indgående nukleotid og tilstedeværelsen af en beskadiget base eller mispair er to faktorer, der påvirker overførslen af DNA fra polymeraseaktiveringsstedet til det korrekturlæsningsaktive sted., Polymeraser overvåger den mindre rilleside af de nydannede basepar og interagerer med de universelle H-bindingsacceptorer, O3, og N2, som en måde at kontrollere for uoverensstemmelser (Seeman et al., 1976; Franklin et al., 2001). Et unikt træk ved pol is er kontakten til hovedsporsiden af det spirende basepar via en rest fra e .onuclease-domænet, Tyr431. Yderligere analyse er berettiget til at belyse denne tyrosins potentielle rolle i pol ε ‘ s høje troskab.,
i pol δ indsætter β-hårnålsegmentet sig i DNA ‘ et og fungerer som en kile mellem enkeltstrenget og dobbeltstrenget DNA (s .an et al., 2009). I E. coli DNA pol II skifter indsættelsen af en β-tønde positionen af β-hårnålen på en sådan måde, at polymerisation favoriseres frem for korrekturlæsning (.ang og Yang, 2009). Denne modifikation tillader formodentlig denne polymerase at udføre translationssynteseudvidelse., Da pol ε er en præcis DNA-polymerase den antagelse, før viden om krystal struktur ville være, at β-hairpin bør være tættere på pol δ end E. coli Pol II. Overraskende, β-hairpin motiv i pol ε er afkortet for kort til at kontakte DNA (Figur 1). Hvilket proteinmotiv, derefter, kan være at lette det aktive sted at skifte efter sensing af et forkert par? P domæne er en god kandidat, på grund af sine kontakter til både primer og skabelon tråde; restprodukter fra S domæne kunne forstand replikation fejl og dermed kan bidrage til at fremme den aktive site skifte.,
Konklusion
Alle tre eukaryote replikation af DNA-polymeraser bruge et fælles B-family fold, og hver polymerase har indarbejdet ændrede strukturelle elementer, som er unikke og skræddersyet til den enkelte-polymerase er bestemt funktion (for eksempel, ud af den processivity domæne i pol-ε, en processive-polymerase, som ikke bruger PCNA, eller den modificerede region kontakte den 5’end af skabelonen i pol α, et polymerase blottet for korrekturlæsning aktivitet). Folden af B-familiepolymeraser er velegnet til high-fidelity, replikative polymeraser., Men overraskende bruges den også af translesionpolymeraser. Eukaryotisk pol ζ (eller REV3L) er en 353 kDa polymerase, som fungerer i translationssyntese og synes at undertrykke tumorigenese (REVITTSCHIEBEN et al., 2010; Lange et al., 2011; 2011ahn et al., 2011; Hogg and Johansson, 2012; Sharma et al., 2013). Strukturen af E. coli Pol II viste ændringer i NTD, der påvirker den position, β hårnål af exonuclease domæne, og dermed en opdeling af DNA mellem polymerisering og korrekturlæsning steder (Wang og Yang, 2009)., Strukturen af pol may kan afsløre lignende justeringer, som ændrer fold ansat af high-fidelity, replicative polymeraser at gøre en .ymet mindre trofaste og i stand til at udføre translesion syntese.
Erklæring om interessekonflikt
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
Anerkendelse
Dette arbejde blev støttet af tilskud fra National Institutes of Health (NCI R01 CA 52040).
















Skriv et svar