| Université de Sheffield | |
| Département de chimie | VSEPR |
ammoniac a également quatre paires D’électrons et la géométrie de coordination de L’azote est basée sur un arrangement tétraédrique de paires d’électrons. Il n’y a que trois groupes liés, donc il y a une seule paire. Cependant, comme les paires solitaires sont « invisibles », la forme de l’ammoniac est pyramidale.,r>
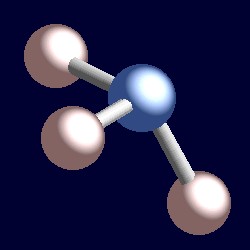
considérons une paire d’électrons de liaison. Les deux électrons sont situés entre deux noyaux, et sont attirés par les deux. Une paire Solitaire est différente. Il est nécessairement seulement attiré par un noyau et la conséquence est qu’il adopte une position effectivement plus proche de ce noyau que les paires d’électrons de liaison. Cela signifie que l’angle solide effectif occupé par une paire isolée est supérieur à celui occupé par une paire de liaisons., Les paires solitaires exigent une plus grande place angulaire et sont situées plus près de leurs atomes que les paires de liaisons. La conséquence de ceci pour l’ammoniac est que la paire solitaire fait de la place pour elle-même en poussant un peu les trois atomes d’hydrogène ensemble et que les angles de Liaison H-N-H sont légèrement inférieurs (106,6°) à l’angle tétraédrique idéal de 109,5°.
















Laisser un commentaire