d Kelly1, G Crotty1, J O’Mullane2, M Stapleton2, B Sweeney1, SS O’Sullivan1
Departments of 1Neurology and 2Biochemistry, Cork University Hospital, Wilton, Cork
Abstract
THE la première étape du dépistage de la maladie potentielle de Wilson est le test de céruloplasmine sérique, selon lequel un taux inférieur à 0,2 g/l suggère la maladie., Nous avons cherché à déterminer quelle proportion de la population irlandaise avait un faible taux de céruloplasmine, si de faibles mesures étaient suivies de manière appropriée et quels étaient les résultats cliniques. Nous avons effectué un examen rétrospectif de toutes les mesures sériques de céruloplasmine entre août 2003 et octobre 2009 dans un grand centre de référence tertiaire du Sud de l’Irlande. Les données cliniques, la céruloplasmine sérique, les tests de la fonction hépatique, le cuivre urinaire et les rapports de biopsie hépatique ont tous été enregistrés lorsque disponibles. 1573 patients ont eu une mesure sérique de la céruloplasmine au cours de la période d’étude de 7 ans. 96 patients (6.,1%) avaient un taux de céruloplasmine < 0,2 g/L et parmi ces patients seulement 3 étaient atteints de la maladie de Wilson. Il n’y avait que 1 nouveau diagnostic. Seulement 27 patients (28,1%) ont subi une forme de test de confirmation. D’après l’expérience de notre centre, la valeur prédictive positive d’un taux de céruloplasmine significativement faible est de 11,1% (IC à 95% de 2,91 à 30,3%). En pratique, une faible mesure de la céruloplasmine sérique n’est souvent pas suivie d’un test de confirmation approprié., La mesure de la céruloplasmine sérique en tant que test diagnostique singulier pour la maladie de Wilson ou dans le cadre de la batterie de tests de dépistage du foie non sélectionnés est inappropriée et à faible rendement.
Introduction
La Maladie de Wilson (DEO) est un défaut autosomique récessif rare dans le transport hépatocellulaire du cuivre trouvé chez 3 personnes sur 100 0001. Il peut entraîner un dépôt chronique de cuivre dans le foie, le cerveau et d’autres tissus, entraînant une hépatotoxicité et des séquelles neuropsychiatrices2., L’American Association for the Study of Liver Disease (AASLD) recommande le dépistage de la maladie du foie chez toute personne âgée de 3 à 55 ans présentant des anomalies hépatiques de cause incertaine, en particulier celles présentant des troubles neurologiques comorbides inexpliqués3. La première étape du dépistage de la maladie deo potentielle est la mesure de la céruloplasmine sérique, car environ 85 à 90% des patients atteints de maladie deo présentent de faibles taux de céruloplasmine sérique4., Cependant, une faible céruloplasmine n’est pas spécifique à la DO; elle peut résulter d’une malabsorption, d’autres maladies du foie, d’entéropathies perdantes en protéines, d’une carence en cuivre acquise et d’une acéruloplasminémie héréditaire5. La céruloplasmine est également un réactif de phase aiguë et peut être élevée dans les états inflammatoires, y compris chez les patients atteints d’hépatite active6. Les États Hyper-oestrogéniques, y compris la grossesse ou l’utilisation de la pilule contraceptive orale, peuvent également augmenter les niveaux de céruloplasmine, car l’ARNm de la céruloplasmine a une région en amont sensible aux œstrogènes pour sa transcription7. Taux de céruloplasmine inférieur à 0.,2g / L ont été démontrés dans une étude pour avoir une sensibilité de plus de 98%, une spécificité de plus de 55% et une valeur prédictive positive de plus de 48% pour le diagnostic de DEO sur des patients vérifiés par génotype8.
cependant, d’autres recherches suggèrent que la valeur prédictive positive de la céruloplasmine< 0,2 g/l lorsqu’elle est utilisée seule chez les patients présentant un dysfonctionnement hépatique peut être aussi faible que 5,9% 1. Pour cette raison, les lignes directrices recommandent un certain nombre de tests de confirmation, y compris un examen à la lampe à fente pour la détection des anneaux de Kayser-Fleischer (KF) et une estimation du cuivre urinaire sur 24 hour3., Des examens supplémentaires peuvent être nécessaires pour ceux dont les résultats sont indéterminés,y compris une biopsie du foie pour déterminer la concentration hépatique de cuivre ou des tests moléculaires pour les mutations ATP7B9, 10. Les directives de pratique clinique de L’Association européenne pour l’étude du foie (EASL) reconnaissent également les limites de la mesure de la céruloplasmine sérique en tant que test unique et recommandent l’utilisation d’une combinaison de tests reflétant le « métabolisme perturbé du cuivre » avec un système de notation diagnostique basé sur leurs résultats11., Notre étude a évalué l’incidence de faibles taux de céruloplasmine dans la population et les indications cliniques pour les tests. Nous avons déterminé si d’autres tests diagnostiques ont été effectués et quelle était la signification clinique de ces résultats.
méthodes
Nous avons effectué un examen rétrospectif de toutes les mesures de céruloplasmine au laboratoire clinique de L’Hôpital Universitaire de Cork qui dessert un vaste réseau de soins primaires, des cliniques spécialisées et un centre de référence neurologique et hépatologique tertiaire de 800 lits entre août 2003 et octobre 2009., La période a été choisie pour inclure le maximum de données disponibles. L’étude a été approuvée par le comité d’éthique de l’hôpital. Les données cliniques, la céruloplasmine sérique, les tests de la fonction hépatique, le cuivre urinaire et les rapports de biopsie hépatique ont tous été enregistrés lorsque disponibles. La néphélométrie était la technique utilisée par le laboratoire de référence pour mesurer la céruloplasmine sérique au cours de la période d’étude. Nous avons traité des valeurs de céruloplasmine inférieures à 0,2 g/L comme potentiellement positives pour la DEO conformément aux lignes directrices publiées3., Un diagnostic de DEO a été déterminé sur la base des résultats des tests de confirmation (urine et cuivre hépatique, examens ophtalmologiques) et de la documentation du dossier médical. Les résultats des tests génétiques ont été enregistrés là où ils étaient disponibles. Les hétérozygotes de DEO ont été définis comme ceux avec une seule mutation causant la maladie en l’absence d’autres caractéristiques de soutien. Les données ont été analysées à L’aide de SPSS version 21.
résultats
Démographie de la population testée
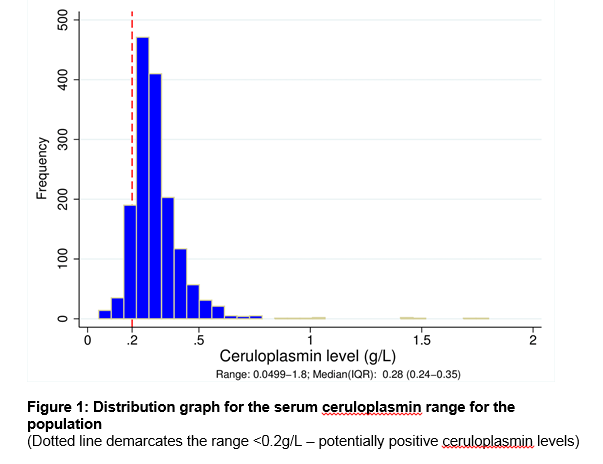
notre laboratoire de Cork city, en Irlande, Sert de centre suprarégional pour une population totale de 1,1 million de personnes., Dans la base de données du laboratoire, 1 573 patients ont subi une mesure de la céruloplasmine sérique au cours de la période d’étude de 7 ans. Le tableau 1 présente les détails démographiques et la source de référence par spécialité clinique. Au total, 476 taux sériques de céruloplasmine (30,3%) ont été prescrits chez des patients âgés de moins de 3 ans ou de plus de 55 ans, un groupe en dehors des recommandations de L’AASLD3. Voir la Figure 1 pour la gamme des niveaux de céruloplasmine dans l’ensemble de la population. Le taux médian de céruloplasmine était de 0,28 g/L (5e centile = 0,18, 95e centile = 0,5 g / L)., Il y avait une différence significative dans le niveau médian pour les hommes et les femmes à 0,27 g/L et 0,3 g/L respectivement (p<0,05). Il y avait une faible corrélation positive entre l’âge et le taux de céruloplasmine avec des âges inférieurs associés à un taux de céruloplasmine inférieur, r =.124, n = 1573, p <.0005.
Tableau 1:
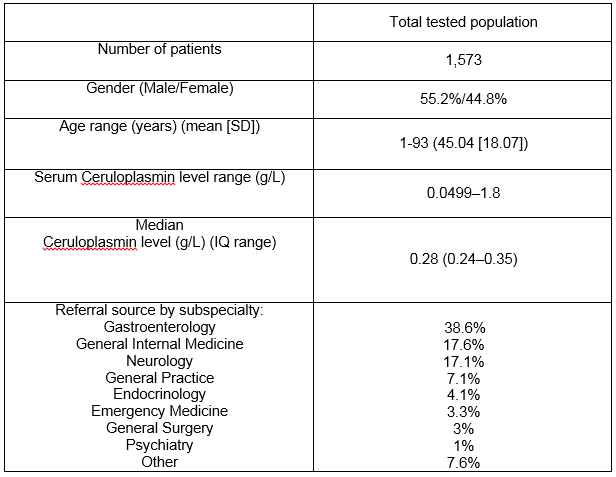
Positif de la céruloplasmine résultats
96 patients (hommes:femmes = 72%:28%) de l’ensemble de la cohorte (6.1%) avait un céruloplasmine niveau <0.,2g/L (voir la Figure 1). Les indications les plus courantes pour le test étaient la présence d’anomalies du test de la fonction hépatique (61,5%), un trouble du mouvement (18,8%) et des troubles psychiatriques (7,3%). 40,6% du groupe ont ensuite reçu un diagnostic définitif de maladie hépatique, la plus fréquente étant la maladie hépatique alcoolique (14,6%) suivie de la stéatose hépatique non alcoolique (8,3%). Seulement 3 des 96 patients (3,1%) étaient atteints de DEO. Deux de ces patients avaient déjà été diagnostiqués et ont fait l’objet d’un nouveau test de surveillance de la maladie. Un patient a reçu un nouveau diagnostic de DEO au cours de la période d’étude., Son excrétion urinaire élevée de cuivre pendant 24 heures, les anneaux de Kayser-Fleisher ainsi que son faible taux sérique de céruloplasmine ont confirmé le diagnostic. Les 3 patients atteints de Do présentaient une céruloplasmine< 0,05 g/l. de plus, 1 personne présentant un tremblement a été identifiée comme porteuse de DO avec une seule mutation ATP7B seulement. Son analyse génétique n’était pas compatible avec un hétérozygote composé et il n’a jamais développé d’autres symptômes cliniques.
Test de confirmation de la maladie de Wilson
Après un résultat positif / évocateur de céruloplasmine, 27/96 patients (28.,1%) ont fait effectuer une certaine forme de test de confirmation pour DEO. 14 patients (14,5%) ont été examinés ophtalmologiquement pour les anneaux de Kayser-Fleisher. 10 patients (10,4%) ont subi une biopsie hépatique pour quantifier le cuivre hépatique. 23 patients (24%) avaient une quantification urinaire du cuivre. La période de suivi moyenne à partir du moment du test initial était de 51,4 mois (30,3 mois). Les surspécialités Non neurologiques et gastroentérologiques étaient beaucoup moins susceptibles de faire des enquêtes de suivi. (p & lt; div id= »fe8aa00a18″>0.01). Seulement 4 des 27 patients (14.,8%) qui ont subi d’autres tests étaient sous la responsabilité des surspécialités non neurologiques/gastroentérologiques.
la céruloplasmine en tant que test diagnostique de dépistage
Discussion
La mesure de la céruloplasmine est souvent demandée lors de l’évaluation et de la prise en charge du patient présentant une élévation des enzymes hépatiques. Dans notre examen de 7 ans de modèles de commande de céruloplasmine, nous avons constaté une mauvaise adhésion aux directives AASLD. Une proportion importante de la population testée était en dehors de la tranche d’âge recommandée par L’AASLD. Il est très rare de présenter la maladie de Wilson après l’âge de 4012., Dans une vaste revue rétrospective des taux de céruloplasmine chez 5023 patients, le nombre nécessaire pour tester la maladie de Wilson à apparition tardive (>40 ans) pour aboutir à 1 nouveau diagnostic était de 284713. Dans de nombreux cas, les anomalies hépatiques n’étaient pas d’étiologie incertaine et les maladies plus courantes n’étaient pas encore exclues. Plusieurs de ceux qui avaient de faibles taux de céruloplasmine avaient une hépatite chronique ou une maladie hépatique induite par l’alcool-conditions associées à des résultats faussement positifs secondaires à une mauvaise fonction synthétique hépatique1., Moins de 30% de la population de l’étude ont fait l’objet d’enquêtes de suivi appropriées pour un résultat positif à la céruloplasmine, telles qu’un examen ophtalmique pour les anneaux KF ou une biopsie hépatique pour la coloration au cuivre. Les mesures de céruloplasmine ont été demandées par une variété de surspécialités, les plus courantes étant la gastro-entérologie, la neurologie et les internistes. La raison la plus courante pour le test était l’évaluation de l’élévation des enzymes hépatiques ou de la maladie hépatique établie. Les médecins qui n’étaient pas gastro-entérologues ou neurologues étaient moins susceptibles d’effectuer des examens de confirmation (p<0,01)., Cela suggère le manque de familiarité des autres surspécialités avec l’algorithme de diagnostic des enquêtes nécessaires pour confirmer ou exclure DEO.
la mesure de la céruloplasmine sérique avec un niveau seuil de moins de 0,2 g/l a eu un faible PPV pour DEO dans notre étude similaire aux travaux publiés antérieurs1. Ceci est lié à la faible probabilité de diagnostic avant le test dans une population non sélectionnée avec une prévalence élevée de maladie du foie avec une étiologie connue. L’abaissement de la plage de référence à 0,14 aurait amélioré les performances de l’essai sans nuire à la sensibilité., Une plus grande précision diagnostique avec ce seuil inférieur a été rapportée dans des études antérieures avec une mise en garde de validation locale nécessaire8. Dans cette étude, des concentrations sériques de céruloplasmine inférieures à 0,20, 0,14 et 0,10 g/L ont montré des valeurs prédictives positives de 48,3%, 100% et 100%, respectivement, dans le groupe de validation, un seuil sérique de céruloplasmine de 0,14 g / L a rendu 100% de sensibilité et de spécificité. Cependant, il est possible que tous les patients atteints de DEO n’aient pas été capturés sur la base de ce test de dépistage., Comme mentionné précédemment, il peut y avoir des résultats faussement négatifs pour DEO en cas d’infection ou d’inflammation14. La grossesse et la thérapie supplémentaire d’oestrogène peuvent avoir un impact similaire15. Les futures demandes/interprétations de tests devraient tenir compte de ces facteurs cliniques atténuants. La méthode d’essai peut influencer les résultats. La céruloplasmine sérique peut être mesurée enzymatiquement par son activité oxydase dépendante du cuivre vers des substrats spécifiques ou par des tests dépendants des anticorps. Ce dernier comprend la néphélométrie, le dosage radio-immunologique et l’immunodiffusion radiale., Les résultats sont généralement similaires, sauf pour les tests anticorps-dépendants et immunodiffusion, qui peuvent surestimer les niveaux de céruloplasmine. La surestimation peut se produire parce que les deux méthodes d’essai ne font pas la différence entre l’apocéruloplasmine (céruloplasmine non liée au cuivre) et l’holocéruloplasmine (céruloplasmine avec son complément complet de 6 atomes de cuivre par molécule)16. La néphélométrie a été la technique utilisée de façon constante tout au long de notre période d’étude.
Il y avait plusieurs limites à cette étude. Nous n’avons pas suivi les patients qui étaient normaux (>0.,2g / L) taux sériques de céruloplasmine pour s’assurer qu’ils n’ont pas développé par la suite de DEO. Ainsi, nous n’avons peut-être pas saisi les caractéristiques de test de tous les patients touchés. Notre capacité à évaluer la céruloplasmine en tant que test diagnostique était limitée car nous ne pouvions inclure que des mesures où des tests de confirmation définitifs ont été effectués. De plus, il est possible que le porteur hétérozygote que nous avons identifié ait en fait de la DEO avec un phénotype moins sévère., Étant donné que la plupart des patients atteints de DEO sont des hétérozygotes composés et qu’il existe de nombreuses mutations spécifiques à la maladie, il peut être difficile de différencier un porteur sain d’un individu affecté17. Le dépistage systématique de tous les patients est d’une utilité clinique limitée et la céruloplasmine ne doit pas être utilisée dans le cadre de la batterie empirique de tests formant le dépistage hépatique. Une utilisation plus judicieuse de la céruloplasmine dans une population sélectionnée avec une probabilité plus élevée de maladie de Wilson avant le test peut accroître son utilité comme outil de dépistage., Les systèmes de notation diagnostique tels que celui proposé par L’EASL11 peuvent aider à stratifier le risque ou à contextualiser un faible résultat sérique en céruloplasmine. Il est clair qu’il est nécessaire d’accroître l’éducation concernant les indications appropriées pour les tests de céruloplasmine dans toutes les spécialités cliniques référentes, mais en particulier les sources non neurologiques et non gastroentérologiques. Les performances des tests peuvent s’améliorer avec des plages de référence inférieures validées localement, l’adhésion aux recommandations et l’utilisation dans une population plus sélectionnée.,
correspondance: s O’Sullivan
Département de Neurologie, Hôpital Universitaire de Cork, Cork
courriel:
Financement
s O’Sullivan a reçu le soutien D’Eisai Pharma, UCB, AbbVie, Lundbeck Pharma et Teva Pharma
- Cauza E, Maier-Dobersberger T, Polli C, Kaserer K, Kramer l, Ferenci P. dépistage de la maladie de Wilson chez les patients atteints de maladies du foie par la céruloplasmine sérique. Journal d’hépatologie. 1997;27:358-62.
- Médicis V, Rossaro L, Sturniolo GC. Maladie de Wilson – une approche pratique du diagnostic, du traitement et du suivi., Maladies digestives et hépatiques: journal officiel de la société italienne de gastroentérologie et de l’Association Italienne pour l’étude du foie. 2007;39:601-9.
- Roberts EA, Schilsky ML. Diagnostic et traitement de la maladie de Wilson: une mise à jour. Hépatologie (Baltimore, Maryland). 2008;47:2089-111.
- stremmel W, MEYERROSE KW, Niederau C, Hefter H, Kreuzpaintner g, Strohmeyer G. Wilson disease: clinical presentation, treatment, and survival. Annales de médecine interne. 1991;115:720-6.
- Hellman NE, Gitlin JD. Métabolisme et fonction de la céruloplasmine. Revue annuelle de la nutrition., 2002;22:439-58.
- Scott J, Gollan JL, Samourian s, la maladie de Sherlock S. Wilson, se présentant comme une hépatite active chronique. Gastroentérologie. 1978;74:645-51.
- Allemand JL, 3ème, Béarn AG. Effet des œstrogènes sur le métabolisme du cuivre dans la maladie de Wilson. Le Journal of clinical investigation. 1961;40:445-53.
- Mak CM, Lam CW, Tam S. précision diagnostique de la céruloplasmine sérique dans la maladie de Wilson: détermination de la sensibilité et de la spécificité par analyse de la courbe ROC chez les sujets génotypés ATP7B. La chimie clinique. 2008;54:1356-62.,
- Ferenci P, Steindl-Munda P, Vogel W, Jessner W, Gschwantler M, Stauber R, Datz C, Hackl F, Wrba F, Bauer P, Lorenz O. valeur diagnostique de la détermination quantitative du cuivre hépatique chez les patients atteints de la maladie de Wilson. Clinique de gastro-entérologie et hépatologie : la pratique clinique journal de l’American Gastroenterological Association. 2005;3:811-8.
- Shah AB, Chernov I, Zhang HT, Ross BM, Das K, Loutsenko S, Pavone l, Evgrafov O, Ivanova-Smolenskaya IA, Annerén G, Westermark K, Urrutia FH, Penchaszadeh GK, Sternlieb I, Scheinberg IH, Gilliam TC, Petrukhin K., Identification et analyse des mutations du gène de la maladie de Wilson (ATP7B): fréquences de population, corrélation génotype-phénotype et analyses fonctionnelles. American journal of Human genetics. 1997;61:317-28.
- EASL lignes Directrices de Pratique Clinique: la maladie de Wilson. Journal d’hépatologie. 2012;56:671-85.
- Gow PJ, Smallwood RA, Angus PW, Smith AL, Wall AJ, Sewell RB. Diagnostic de la maladie de Wilson: une expérience de plus de trois décennies. Intestin. 2000;46:415-9.
- Tapper EB, Rahni DO, Arnaout R, Lai M. la surutilisation de la mesure de la céruloplasmine sérique. Le journal américain de médecine., 2013;126:926.e1-5.
- Goldstein IM, Kaplan HB, Edelson HS, Weissmann G. céruloplasmine: un réactif de phase aiguë qui récupère les radicaux libres dérivés de l’oxygène. Annales de L’Académie des Sciences de New York. 1982;389:368-79.
- Arredondo M, Nunez H, Lopez G, Pizarro F, Ayala m, Araya M. Influence des œstrogènes sur les indicateurs de cuivre: études in vivo et in vitro. Recherche sur les oligo-éléments biologiques. 2010;134:252-64.
- Dufour JF, Kaplan MM. Troubler l’eau: la maladie de Wilson défis ne sera pas bientôt disparaître. Gastroentérologie. 1997;113:348-50.
17. Schilsky ML, Ala A., Le test génétique pour la maladie de Wilson: la disponibilité et l’utilité. Rapports actuels de gastroentérologie. 2010;12:57-61.
Page 341
















Laisser un commentaire