gândiți-vă ce se întâmplă la jumătatea drumului prin schimbarea culorii. În acest moment, concentrațiile acidului și ale ionului său sunt egale. În acest caz, ei vor anula din expresia fel.
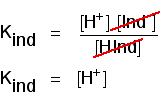
puteți utiliza acest lucru pentru a afla care este pH-ul la acest punct la jumătatea drumului., Dacă vă re-aranja ultima ecuație, astfel încât concentrația ionilor de hidrogen este pe partea stângă, și apoi converti la pH-ul și pKind, veți obține:
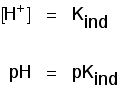
asta înseamnă Că punctul final pentru indicator depinde în întregime de ceea ce pKind este valoarea. Pentru indicatorii ne-am uitat la mai sus, acestea sunt:
| indicator | pKind |
|---|---|
| turnesol | 6.5 |
| metil orange | 3.7 |
| fenolftaleină | 9.,3 |
pH-ul gamă de indicatori
Indicatori nu schimba culoarea brusc la un anumit pH-ului (dat de pKind). În schimb, se schimbă într-un interval îngust de pH.
presupunem că echilibrul este ferm într-o parte, dar acum adăugați ceva pentru a începe să-l schimbați. Pe măsură ce echilibrul se schimbă, veți începe să obțineți din ce în ce mai mult din a doua culoare formată, iar la un moment dat ochiul va începe să o detecteze.de exemplu, să presupunem că ați avut metil portocaliu într-o soluție alcalină, astfel încât culoarea dominantă a fost Galben., Acum începeți să adăugați acid, astfel încât echilibrul să înceapă să se schimbe.la un moment dat va fi suficientă forma roșie a portocalei metil prezente, încât soluția va începe să ia o nuanță portocalie. Pe măsură ce continuați să adăugați mai mult acid, roșul va deveni în cele din urmă atât de dominant încât nu puteți vedea nici un galben.
Nu este o treptată schimbare lină de la o culoare la alta, are loc într-un interval de pH. Ca un dur „regula degetului mare”, vizibilă schimbare are loc aproximativ 1 unitate de pH fiecare parte a pKind valoare.,
valorile exacte pentru trei indicatori ne-am uitat la sunt:
| indicator | pKind | pH-ului |
|---|---|---|
| turnesol | 6.5 | 5 – 8 |
| metil orange | 3.7 | 3.1 – 4.4 |
| fenolftaleină | 9.3 | 8.3 – 10.0 |
turnesol schimbare de culoare se întâmplă peste o gamă neobișnuit de largă, dar este util pentru detectarea acizi și baze în laborator pentru că își schimbă culoarea în jurul valorii de pH-ul 7., Portocala metil sau fenolftaleina ar fi mai puțin utile.
Acest lucru este mai ușor de văzut grafic.
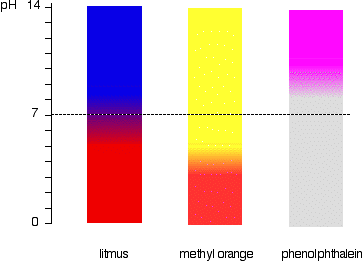
de exemplu, metil portocaliu ar fi galben în orice soluție cu un pH mai mare de 4,4. Nu a putut distinge între un acid slab cu un pH de 5 sau un alcalin puternic cu un pH de 14.
Alegerea indicatorilor pentru titrări
Amintiți-vă că punctul de echivalență de titrare este în cazul în care trebuie amestecate două substanțe în exact ecuația proporții., Evident, trebuie să alegeți un indicator care își schimbă culoarea cât mai aproape posibil de acel punct de echivalență. Aceasta variază de la titrare la titrare.
acid puternic v bază puternică
următoarea diagramă arată curba pH-ului pentru adăugarea unui acid puternic la o bază puternică. Suprapuse pe acesta sunt intervalele de pH pentru metil portocaliu și fenolftaleină.
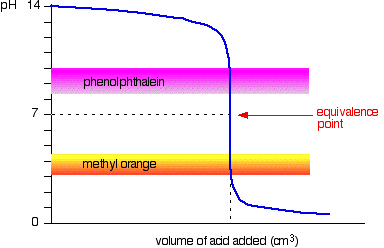
puteți vedea că nici un indicator nu își schimbă culoarea la punctul de echivalență.,cu toate acestea, graficul este atât de abrupt în acel moment încât nu va exista practic nici o diferență în volumul de acid adăugat, indiferent de indicatorul pe care îl alegeți. Cu toate acestea, ar avea sens să titrați la cea mai bună culoare posibilă cu fiecare indicator.dacă utilizați fenolftaleină, veți titra până când devine incolor (la pH 8,3), deoarece este cât se poate de aproape de punctul de echivalență.
pe de altă parte, folosind portocaliu metil, ați titra până când există prima urmă de portocaliu în soluție., Dacă soluția devine roșie, ajungeți mai departe de punctul de echivalență.
acid tare v bază slabă
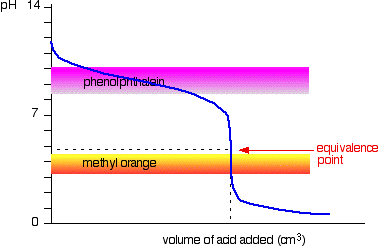
de Această dată, este evident că fenolftaleină ar fi complet inutil. Cu toate acestea, metil portocaliu începe să se schimbe de la galben la portocaliu foarte aproape de punctul de echivalență.
trebuie să alegeți un indicator care își schimbă culoarea pe bitul abrupt al curbei.
acid Slab v puternică bază
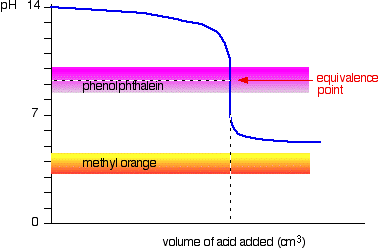
de Această dată, metil orange este fără speranță!, Cu toate acestea, fenolftaleina își schimbă culoarea exact acolo unde doriți.
acid Slab v bază slabă
curba este pentru un caz în care acidul și baza sunt ambele la fel de slabe – de exemplu, ethanoic acid și soluție de amoniac. În alte cazuri, punctul de echivalență va fi la un alt pH.
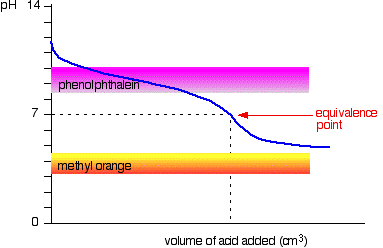
puteți vedea că nici un indicator nu este nici o utilizare. Fenolftaleina va fi terminat schimbarea cu mult înainte de punctul de echivalență, iar portocala metil cade de pe grafic cu totul.,poate fi posibil să găsiți un indicator care începe să se schimbe sau se termină să se schimbe la punctul de echivalență, dar deoarece pH-ul punctului de echivalență va fi diferit de la caz la caz, nu puteți generaliza.în ansamblu, nu ați titra niciodată un acid slab și o bază slabă în prezența unui indicator.
soluție de carbonat de sodiu și acid clorhidric diluat
acesta este un caz special interesant., Dacă utilizați fenolftaleină sau metil portocaliu, ambele vor da un rezultat Valabil de titrare – dar valoarea cu fenolftaleină va fi exact jumătate din cea de metil portocaliu.
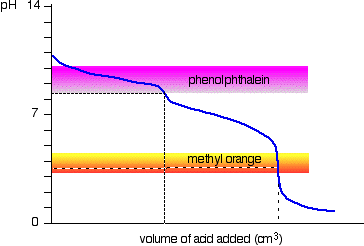
Se întâmplă ca fenolftaleină-a terminat schimbare de culoare la exact pH-ul la punctul de echivalență din prima jumătate de reacție în care hidrogencarbonat de sodiu este produs.
![]()
![]()
metil orange își schimbă culoarea la exact pH-ul la punctul de echivalență a doua etapă de reacție.,
![]()
![]()
Întrebări pentru a testa înțelegerea dvs.
Dacă acesta este primul set de întrebări pe care le-am făcut, vă rugăm să citiți pagina introductivă înainte de a începe. Va trebui să utilizați butonul înapoi din browserul dvs. pentru a reveni aici după aceea.
întrebări privind indicatorii
răspunsuri
unde doriți să mergeți acum?
în meniul echilibrelor acido-bazice . . .
la meniul de Chimie Fizică . . .
la meniul principal . . .,
















Lasă un răspuns