Introducere
Replicare în nucleul celulelor eucariote are trei ADN polimeraze: polimeraza α, δ și ε (Hubscher et al., 2002; Pavlov și colab., 2006b; Kunkel și Burgers, 2008; Loeb și Monnat, 2008; Burgers, 2009; Pavlov și Shcherbakova, 2010; Lange și colab., 2011)., Sinteza ADN-ului este direcțională și încasările de la 5′ la 3′, unde atac nucleofil asupra α fosfat de nucleotide de 3 ‘ OH a unui grund rezultate în încorporarea de un nucleozid monofosfat și eliberarea de pirofosfat (Steitz, 1999). Toate polimerazele ADN necesită un primer și un 3 ‘ OH liber pentru a efectua sinteza ADN, iar pol α nu face excepție. Pol α este un heterotetramer compus din două subunități de primază și două subunități de polimerază., La primase subunități inițiază replicarea ADN-ului prin sintetizarea scurt (7-12 ribonucleotides) ARN grunduri, care sunt apoi extinse de polimeraza α (Pellegrini, 2012). ADN polimeraza δ și ε alungesc primerii generați de pol α într-o manieră precisă și procesivă (Kunkel, 2004, 2011; Pellegrini, 2012). În drojdie, ADN polimeraza δ a fost dovedit a fi esențial pentru sinteza ADN-ului a rămas strand întrucât pol ε apare în principal funcția de conducere strand (Pursell et al., 2007; Nick Mcelhinny și colab., 2008; Kunkel, 2011; Georgescu et al., 2014)., În schimb, în replicarea mitocondriilor este responsabilitatea unei singure polimeraze, ADN polimeraza γ (Lee și colab., 2009).ADN polimerazele sunt grupate în șapte familii (A, B, C, D, X, Y și RT). În eucariote, cele trei polimeraze ADN replicative nucleare aparțin familiei B (Burgers et al., 2001; Patel și Loeb, 2001). Acum există structuri de cristale ale tuturor celor trei polimeraze ADN replicative din drojdie, care permit pentru prima dată o comparație a elementelor structurale comune, precum și un studiu al caracteristicilor lor unice (Swan et al., 2009; Perera și colab.,, 2013; Hogg și colab., 2014; Jain și colab., 2014a). Toate cele trei polimeraze ADN replicative sunt enzime multi-subunitare (Tabelul 1) (Johansson și Macneill, 2010; Pavlov și Shcherbakova, 2010; Makarova și colab., 2014). Principalul obiectiv al acestei revizuiri este domeniul catalitic sau subunitatea A.
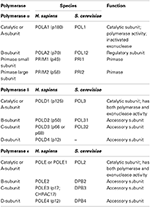
Tabelul 1. ADN-polimerazele eucariote sunt enzime multi-subunitare.,
Structura Generală a B de Familie Polimerazele
Toate ADN polimerazele comun polimeraza ori, care a fost comparat cu un om de dreapta, compus din trei subdomenii: degetele, palma, iar degetul mare (Steitz, 1999; Patel și Loeb, 2001). Palma, un înalt conservată ori compusă din patru antiparalel β fire și două spirale, două porturi strict conservate catalitic aspartates situat într-UN motiv, DXXLYPS și motivul C, DTD (Delarue et al., 1990; Braithwaite și Ito, 1993)., Acest RRM-ca ori este împărtășită de un grup foarte mare de enzime, inclusiv ADN-ul și ARN-polimeraze, inversa transcriptases, CRISPR-polimerazei, și chiar inversa (3′-5′) transferazele, cum ar fi Thg1 (Anantharaman et al., 2010; Hyde și colab., 2010). În schimb, subdomeniile thumb și fingers prezintă o diversitate structurală substanțial mai mare (Steitz, 1999). Degetele suferă o schimbare conformațională la legarea ADN-ului și a nucleotidei corecte de intrare. Această mișcare permite reziduurilor din subdomeniul degetelor să vină în contact cu nucleotida din perechea de bază în curs de formare., Degetul mare ține duplexul ADN în timpul replicării și joacă un rol în procesivitate (Doublié și Ellenberger, 1998; Doublié et al., 1999).ADN-polimerazele eucariote α, δ și ε împărtășesc omologia cu multe polimeraze arhaice, bacteriene, bacteriofage și virale (Delarue et al., 1990; Braithwaite și Ito, 1993; Franklin și colab., 2001; Firbank și colab., 2008; Wang și Yang, 2009)., Koonin și colaboratorii au contribuit cu o analiză filogenetică detaliată a ADN polimerazelor arhaeale și a relației lor cu polimerazele eucariote în această problemă a frontierelor în Microbiologie dedicată polimerazelor Makarova et al. (2014).toate polimerazele din familia B sunt compuse din cinci subdomenii: degetele, degetul mare și palma (descrise mai sus) care constituie nucleul enzimei, precum și un domeniu exonuclează și un domeniu N-terminal (NTD) (Franklin et al., 2001; Xia and Konigsberg, 2014) (Figura 1; Tabelul S1)., Domeniul exonucleazei poartă o activitate de corectare 3 ‘-5’, care elimină nucleotidele necorespunzătoare. Situsul activ al exonucleazei este situat la 40-45 Å de situsul activ al polimerazei. NTD pare a fi lipsit de activitate catalitică. În pol δ NTD-ul cuprinde trei motive: unul are o topologie asemănătoare unui pliu OB, un motiv de legare a ADN-ului monocatenar, iar altul poartă un motiv de legare a ARN-ului (motiv de recunoaștere a ARN-ului sau RRM) (Swan et al., 2009). În bacteriofagul T4, mutațiile în NTD scad expresia polimerazei (Hughes et al., 1987)., În RB69 și T4, polimeraza gp43 leagă propriul ARN mesager, probabil prin NTD și reprimă traducerea (Petrov et al., 2002), ceea ce nu pare a fi cazul pol δ (Swan et al., 2009). Noile date indică faptul că NTD joacă un rol în stabilitatea și fidelitatea polimerazei prin interacțiunile sale cu alte domenii (Li et al., 2010; Prindle și colab., 2013) (a se vedea mai jos).
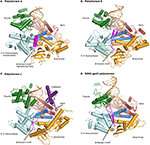
Figura 1. Complexele ternare ale polimerazelor α, δ, ε și RB69 gp43 sunt ilustrate din orientări identice pentru comparație., Domeniile degetului mare (verde) și degetelor (Albastru închis) prind acidul nucleic duplex (primer prezentat în bej, șablon în portocaliu) împotriva domeniului palmei (roșu). Domeniul n-terminal apare în aur, adiacent domeniului exonuclează 3 ‘ -5 ‘ (cyan). (A) polimeraza α (PDBID 4fyd) leagă un hibrid ARN/ADN, unde canelura mică și superficială a ADN-ului de formă A este evidentă în apropierea degetului mare. Domeniul exonucleazei 3 ‘ -5 ‘ este lipsit de activitate. O regiune elicoidală (magenta) în domeniul exonucleazei inactivate stabilizează 5 ‘ end-ul șablonului., (B) Polimeraza δ (PDBID 3IAY) adăpostește o mare β ac de păr motiv (magenta), ceea ce este important în trecerea de grund strand din polimeraza-ul activ la exonuclease-ul activ în caz de corectură. (C) polimeraza ε (PDBID 4M8O) deține un domeniu p unic (purpuriu), care conferă polimerazei o procesivitate crescută. Interesant este că motivul β ac de păr este atrofiat în pol ε., (D) Conservarea familie B de ADN polimeraza ori, de domeniu și de organizare, este evidentă atunci când modelul enzimei de bacteriofag RB69 gp43 (PDBID 2OZS) este considerat, împreună cu trei eucariote osteoblasti polimeraze. Delimitarea domeniului pentru fiecare polimerază este dată în tabelul S1. Figura a fost făcută cu PyMOL (Pymol Molecular Graphics System, versiunea 1.5.0.4 Schrödinger, LLC.).
Toate mamiferele de familie B de ADN polimerazele sunt cunoscute să port două bogat în cisteină metalice site-uri de legare (CysA și CysB) lor C-terminal (CTD) (Figura 2)., Se presupune că CysA este un sit de legare a zincului, în timp ce CysB este un cluster de sulf de fier (Netz et al., 2012). Pierderea clusterului în CTD de drojdie pol δ afectează negativ interacțiunile cu subunitatea B accesorie (Sanchez Garcia et al., 2004). Motivul de legare a zincului s-a dovedit a fi important pentru interacțiunea pol δ cu factorul său de procesivitate, PCNA (Netz et al., 2012).

Figura 2. Diagrama schematică a celor trei polimeraze ADN replicative Saccharomyces cerevisiae α, δ și ε., ADN polimeraza din bacteriofagul RB69 este prezentată pentru comparație.
ADN polimerază α
subunitatea catalitică a ADN polimerazei α este compusă din 1468 aminoacizi (Tabelul 2). Proteina construct conceput pentru cristalizare a fost trunchiat la N – și C-terminale (reziduuri 349-1258) și, prin urmare, nu are CTD și cluster (Figura 2). Construcția a fost cristalizată fără limite, într-un complex binar cu o oligonucleotidă hibridă ADN/ARN și într-un complex ternar cu ADN/ARN și nucleotide primite (Perera et al., 2013) (Figura 1).,

Tabelul 2. Compilarea polimerazelor ADN din familia B a structurii cunoscute.
un mecanism de dezangajare a polimerazei
OLIGONUCLEOTIDA ARN / ADN captată în cristale adoptă o conformație în formă A, așa cum era de așteptat. Domeniul thumb se angajează în interacțiuni multiple cu primerul ARN, atât prin contacte hidrofobe, cât și prin interacțiuni polare (Perera et al., 2013)., Experimentele în soluție au arătat că extensia grundului ARN de pol α este limitată la 10-12 nucleotide, ceea ce se ridică la o rotire a unei helixuri. Această observație a determinat autorii să sugereze un mecanism de terminare a sintezei primerului prin pol α în care pierderea interacțiunilor specifice între degetul mare și ARN ar declanșa polimeraza să se desprindă de oligonucleotida ADN/ARN și să permită o mână către o polimerază replicativă.,
mișcările în domeniul palmei pot facilita translocarea Pol α
având cristalizarea enzimei în trei stări (apo, binar și ternar) a permis autorilor să suprapună toate cele trei modele structurale. Pol α este singura polimerază ADN din familia eucariotă B pentru care toate cele trei stări au fost capturate într-o structură cristalină. Suprapunerea structurală a arătat că, pe lângă mișcările bine documentate ale subdomeniilor degetelor și degetului mare care însoțesc legarea substratului și transferul nucleotidil, subdomeniul palmei în sine suferă o rearanjare structurală (Perera et al.,, 2013). Autorii propun că diferitele conformații ale domeniului palm ar putea facilita translocarea pol α de-a lungul și dincolo de duplexul ARN/ADN. După cum sa menționat mai sus, pierderea contactelor cu catena ARN este prevăzută să declanșeze eliberarea primerului, care apoi devine disponibil pentru extensie prin pol δ sau ε.,
O Proteină Diferită Ori în Inactivat Exonuclease Subdomeniu
corectura activitate este abolită în pol α, din cauza mutații în toate cele patru carboxylates (Asp114/Glu116/Asp222/Asp327 în RB69 gp43 corespund Ser542/Gln544/Tyr644/Asn757 într-o structură pe bază de aliniere) (Tabelul 2). Mai mult decât atât, β-ac de păr motiv găsite în cele mai multe polimerazele din familia B (reziduuri 246-267 în RB69 gp43) este înlocuit cu un elicoidale regiune în pol α (reziduuri 667-676; 681-693) (Hogg et al., 2007)., Β ac de păr este parte a exonuclease domeniu și a fost demonstrat în T4 și RB69 pols de a participa la împărțirea ADN primer între polimeraza și exonuclease-ul activ (Reabi-Krantz, 1988; Stocki et al., 1995; Hogg și colab., 2007). În absența activității de corectură, nu este surprinzător faptul că acest motiv nu a fost reținut în pol α. Reziduurile sale 684 și Phe 685 din regiunea elicoidală în stiva pol α cu o bază de timină și guanină, respectiv, la pozițiile -3 și -2 în 5 ‘ end nepereche ale șablonului (Perera et al ., 2013)., Astfel, în pol α regiune corespunde β-ac de păr motiv adoptă o altă ori (elice vs β fire) și o funcție diferită (stabilizarea nepereche a șablonului fir, mai degrabă decât facilitarea activă a site-ului de comutare). Deoarece pol α este lipsit de activitate de corectură, se pune întrebarea dacă oligonucleotidele scurte sunt corectate și, dacă da, prin care ADN polimerază. Se pare că corectura primerilor sintetizați de pol α este realizată de pol δ (Pavlov et al., 2006a).,
ADN-Polimerazei δ
Om pol δ este compus din patru subunități întrucât Saccharomyces cerevisiae are trei (Gerik et al., 1998; Liu și colab., 2000) (Tabelul 1). În plus față de funcția sa în replicarea ADN-ului pol δ sa dovedit a juca un rol în repararea și recombinarea ADN-ului (Hubscher et al., 2002; Lee și colab., 2012; Tahirov, 2012). P12, cea mai mică subunitate din pol δ uman și, de asemenea, subunitatea care nu este văzută în drojdia în devenire, este degradată ca răspuns la deteriorarea ADN-ului (Lee et al., 2014). Subunitatea catalitică a drojdiei pol δ (POL3) este compusă din reziduuri 1097., Construcția utilizată pentru cristalizare cuprinde reziduurile 67-985 și astfel lipsește CTD (Figura 1; Tabelul 2).
O a Treia Ion Metalic în Polimeraza Activă a Site-ului
palma de domeniu conține trei conservate carboxylates (Asp608, Asp762, și Asp764). Cei doi aspartați catalitici, Asp608 și Asp764, contactează doi ioni metalici (Ca2+) în situsul activ al polimerazei, separați de 3,7 Å. Intrigant de o treime din metal a fost observată coordonat de γ fosfat de intrare de nucleotide și Glu802, cu Glu800 în apropiere., Mutații atât glutamatii a alanin-a dat o polimeraza varianta cu reducerea încorporarea eficienta pentru ambele corecte și incorecte de nucleotide (Swan et al., 2009). La aceste pozițiile aminoacizilor, pol α și pol ε, de asemenea, au carboxilat reziduuri (pol δ Glu800/Glu802 corespund pol α Asp1033/Asp1035, și pol ε Glu945/Asp947). Rămâne de investigat dacă acești carboxilați joacă roluri similare în pol α și ε.,
înaltă fidelitate și corectură
pol uman δ este o polimerază de înaltă fidelitate, catalizând reacția de transfer nucleotidil cu o frecvență de eroare de 1 la 22.000 (Schmitt et al., 2009). Corectura stimulează fidelitatea polimerazei cu un factor de 10-100 (Mcculloch și Kunkel, 2008; Prindle et al., 2013). Pol δ conține un situs activ de polimerază și exonuclează, separate de aproximativ 45 Å (Swan et al ., 2009). Polimerazele ADN cu activitate de corectură sunt capabile să simtă nucleotide greșite prin contactarea canelurii minore a perechilor de baze dincolo de locul de inserție., Proteina interacționează cu acceptorii universali ai legăturii de hidrogen la pozițiile N3 și O2 ale purinelor și, respectiv, pirimidinelor (Seeman et al., 1976; Doublié și colab., 1998; Franklin și colab., 2001). Aceste contacte de legătură de hidrogen sunt păstrate atunci când perechea de bază adoptă o geometrie Watson-Crick și se pierde în cazul unei nepotriviri. În RB69 gp43, contactele se extind la primele două perechi de baze dincolo de perechea de bază în curs de formare (Franklin et al., 2001; Hogg și colab., 2004, 2005). Contactele sunt mult mai extinse în pol δ, extinzându-se la cinci perechi de baze post-inserție (Swan et al.,, 2009), care ar putea contribui la fidelitatea sa ridicată.
după Cum sa menționat mai sus, β-ac de păr segment de exonuclease domeniu joacă un rol critic în partiția de ADN între polimerizare și corectură site-uri în T4 și RB69 pols (Stocki et al., 1995; Hogg și colab., 2007). În RB69 gp43 motivul β-ac de păr adoptă conformații diferite, în funcție de faptul dacă complexul a fost obținut cu ADN nedeteriorat (Franklin et al., 2001; Zahn și colab., 2007) sau ADN care conține o deteriorare (Freisinger et al., 2004; Hogg și colab., 2004)., A fost vizualizată complet contactând atât primerul, cât și șuvițele de șablon într-un complex cu timină glicol (Aller et al., 2011). În mod similar, β ac de păr în pol δ iese în concavității majore ale ADN-ului și acționează ca o pană între ADN dublu catenar și singur-stranded 5 la sfârșitul componenta șablon, care este stabilizat de două aromatice reziduuri Phe441 și Tyr446 (Figura 1) (Swan et al., 2009). Poziția acului β este în concordanță cu un rol în comutarea activă a site-ului.,
Interdomain Contacte și Fidelitate
Mutații implicate în cancer sunt în mare parte găsite în exonuclease domeniu de pol δ și ε, subliniind rolul esențial de corectură în scăderea incidenței mutațiilor (Biserica et al., 2013; Henninger și Pursell, 2014). O mutație într-umane cancer colorectal celule localizează la degetele de domeniu, R689W. Aceeași mutație în drojdie (R696W) rezultatele într-un fenotip mutator (Daee et al., 2010)., O mutație în vecinătatea Arg696 în motivul B foarte conservat al subdomeniului degetelor de drojdie pol δ (A699Q) are ca rezultat și un fenotip mutator. Această regiune a degetelor se află în imediata apropiere a NTD. Mutația Met540 a NTD la alanină elimină fenotipul mutator al A699Q, ilustrând că interacțiunile dintre degete și NTD pot afecta fidelitatea polimerazei (Prindle et al., 2013)., În mod similar, în T4 și RB69 pols NPL core motiv, care implică reziduuri de N-terminal și palma domenii, este în contact cu degetele de domeniu și a fost demonstrat pentru a stabiliza polimeraza-ADN-ul complexe (Li et al., 2010).
ADN polimeraza ε
subunitatea catalitică a ADN polimerazei ε este produsul unei gene foarte mari (2222 aminoacizi în drojdie; 2286 la om), și este doar a treia ca mărime după polimeraza ζ (de asemenea, un membru al familiei B) și pol θ, o familie a polimerază (3130 și 2590 aminoacizi, respectiv, la om) (Lange et al.,, 2011; Hogg și Johansson, 2012) (Figura 1; Tabelul 2). Pol ε este de două ori mai mare decât pol δ și este compus din două regiuni Tandem polimerază/exonuclează. Segmentul n-terminal găzduiește atât activitățile de polimerază, cât și cele de corectare, în timp ce segmentul C-terminal este inactivat. Cele două module exonuclează-polimerază sunt legate la distanță (Tahirov et al., 2009). Deși inactivat segment este de presupus să joace un rol structural în timpul reproducerii, două grupuri au reușit să cristalizeze catalitic activ pol ε constructe (reziduuri 1-1228; 1-1187) lipsit de întreaga C-terminal module (Hogg et al.,, 2014; Jain și colab., 2014a). Ambele structuri cristaline erau dintr-un complex ternar al polimerazei, grundului/șablonului ADN și nucleotidului de intrare.
Un Roman Processivity Domeniu care Provin de la Palma de Domeniu
Pol ε diferă de la pol δ în care ea nu are nevoie de ADN-ul clema de alunecare PCNA de mare processivity (Hogg și Johansson, 2012). Domeniul palmelor pol ε este substanțial mai mare (380 reziduuri) decât cel al pol α sau δ (175 și, respectiv, 203 reziduuri)., Recent pol ε structuri cristaline a arătat că inserții în palma domeniu formează un nou domeniu format din trei β fire și două helixuri (reziduuri 533-555; 682-760) (Hogg et al., 2014; Jain și colab., 2014a) (Figura 1; Tabelul S1). Eliminarea reziduurilor 690-751 a dus la o variantă cu scăderea activității polimerazei. Mai mult decât atât, mutant încărcat pozitiv reziduuri (His748, Arg749, și Lys751), situat în apropiere de fosfat vertebrală a afectat processivity a enzimei (Hogg et al., 2014)., Domeniul suplimentar provenit din palm a fost numit astfel procesivitatea sau domeniul P, după funcția sa. Baza domeniului P găzduiește un sit de legare metalică (vezi mai jos) (Hogg et al., 2014; Jain și colab., 2014a, b).
un Cluster de sulf de fier în domeniul polimerazei
în mod neașteptat, studiile de soluție au arătat că subunitatea catalitică a polimerazei de drojdie ε în sine conține un cluster în pliul său de polimerază (Jain et al., 2014b), pe lângă clusterul din CTD (Figura 2; Tabelul 2)., Al doilea cluster din pol ε sugerează că această polimerază poate fi mai sensibilă la stresul oxidativ (Jain et al., 2014b). Cu toate acestea, structurile cristaline ale pol ε nu au evidențiat un cluster în domeniul polimerazei (Hogg et al., 2014; Jain și colab., 2014a; Zahn și Doublié, 2014). Două dintre reziduurile de cisteină sunt dezordonate în modelele structurale, iar locul de legare a metalului rezultat pare să lege zincul (Hogg et al., 2014; Jain și colab., 2014a). Înlocuirea a cu un zinc non-nativ în proteinele de legare a metalelor nu este neobișnuită (Netz et al., 2012) ca clustere sunt labile., Vizualizarea domeniului polimerazei pol ε poate necesita condiții anaerobe.
Un Scurt β-Ac de păr Motiv în Exonuclease Domeniu
În orice ADN polimeraza adăpostirea atât de polimerizare și exonuclease activități legate de ADN este în echilibru între cele două centre active (Beechem et al., 1998). Concentrația de intrare de nucleotide și prezența unui defect de bază sau mispair sunt doi factori care influențează transferul de ADN de la reacția de polimerizare a activa site-ul la corectură-ul activ., Polimerazele monitorizează partea minoră a canelurii perechilor de baze nou formate și interacționează cu acceptorii universali de legătură H, O3 și N2, ca o modalitate de verificare a neconcordanțelor (Seeman et al., 1976; Franklin și colab., 2001). O caracteristică unică a pol ε este contactul cu partea principală a canelurii perechii de bază în curs de formare printr-un reziduu din domeniul exonucleazei, Tyr431. Analiza ulterioară este justificată pentru a elucida rolul potențial al acestei tirozine în fidelitatea ridicată a pol ε.,
în pol δ segmentul β-ac de păr se introduce în ADN și acționează ca o pană între ADN-ul monocatenar și dublu catenar (Swan et al., 2009). În ADN-ul E. coli pol II, inserția unui butoi β schimbă poziția acului β astfel încât polimerizarea să fie favorizată față de corectură (Wang și Yang, 2009). Această modificare permite probabil ca această polimerază să efectueze extensia sintezei de translație., Din pol ε este o precisă ADN polimeraza ipoteza înainte de cunoașterea structura de cristal ar fi că β ac de păr ar trebui să fie mai aproape de pol δ decât cea de E. coli Pol II. Surprinzător, β-ac de păr motiv în pol ε este trunchiat, prea scurt pentru a contacta ADN (Figura 1). Care motiv de proteine, atunci, ar putea facilita comutarea site-ului activ la detectarea unei erori? Domeniul P este un candidat bun, din cauza contactelor sale atât la primer și toroane șablon; reziduurile din domeniul P ar putea simți erori de replicare și, astfel, poate ajuta la facilitarea comutarea site-ul activ.,
Concluzii
Toate cele trei eucariote de replicație a ADN polimerazele folosesc o comună B-familia ori, și de fiecare polimeraza are încorporată modificate elemente structurale care sunt unice și adaptate pentru fiecare polimerazei specifice funcției (de exemplu, adăugarea de processivity domeniu în pol ε, un processive polimeraza care nu utilizează PCNA, sau modificate regiune contactarea 5 la sfârșitul modelul de la pol α, o polimeraza lipsit de corectură activitate). Pliul polimerazelor din familia B este foarte potrivit pentru polimerazele replicative de înaltă fidelitate., Dar, în mod surprinzător, este folosit și de polimerazele de translație. Eucariote pol ζ (sau REV3L) este un 353 kDa polimeraza care funcționează în translesion sinteza și pare a suprima tumorigeneză (Wittschieben et al., 2010; Lange și colab., 2011; Zahn și colab., 2011; Hogg și Johansson, 2012; Sharma și colab., 2013). Structura E. coli Pol II a relevat modificări în NTD care afectează poziția acului β al domeniului exonucleazei și, astfel, împărțirea ADN-ului între locurile de polimerizare și corectură (Wang și Yang, 2009)., Structura de pol ζ poate dezvălui similare ajustări, care modifică ori angajați de înaltă fidelitate, osteoblasti polimeraze pentru a face enzima mai puțin credincios și capabil de a efectua translesion sinteza.
Declarație privind conflictul de interese
autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
confirmare
această lucrare a fost susținută printr-un grant de la National Institutes of Health (nci R01 ca 52040).
















Lasă un răspuns