pe măsură ce temperatura crește, la fel și rata reacțiilor enzimatice. O creștere de zece grade Celsius a temperaturii va crește activitatea majorității enzimelor cu 50% până la 100%. Variațiile temperaturii de reacție la fel de mici ca 1 sau 2 grade pot introduce modificări de 10% până la 20% în rezultate. Această creștere este doar până la un anumit punct până când temperatura ridicată rupe structura enzimei. Odată ce enzima este denaturată, aceasta nu poate fi reparată., Deoarece fiecare enzimă este diferită în structura și legăturile sale între aminoacizi și peptide, temperatura pentru denaturare este specifică pentru fiecare enzimă. Deoarece majoritatea enzimelor animale devin rapid denaturate la temperaturi de peste 40°C, majoritatea determinărilor enzimatice sunt efectuate oarecum sub această temperatură.
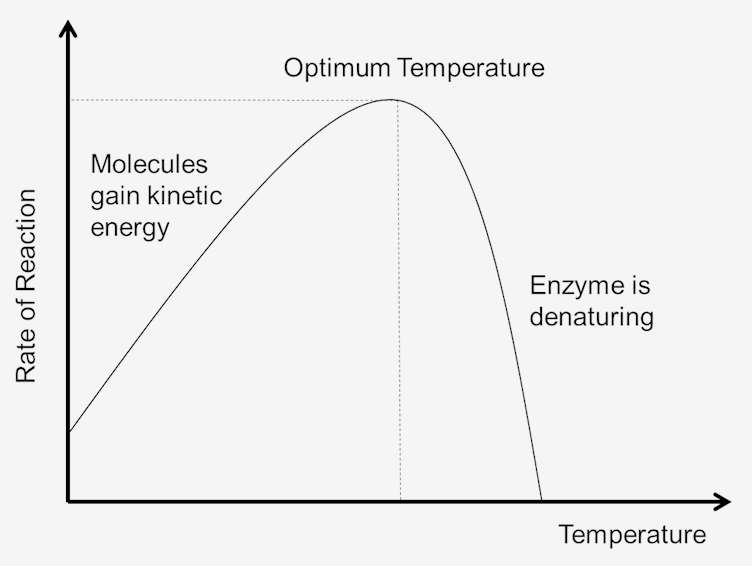 Figura 1. Efectul temperaturii asupra vitezei de reacție.într-o perioadă de timp, enzimele vor fi dezactivate la temperaturi chiar moderate. Depozitarea enzimelor la 5°C sau mai jos este, în general, cea mai potrivită. Temperaturile mai scăzute duc la reacții chimice mai lente., Enzimele vor deveni în cele din urmă inactive la temperaturi de îngheț, dar își vor restabili cea mai mare parte a activității enzimatice atunci când temperaturile cresc din nou, în timp ce unele enzime își pierd activitatea atunci când sunt înghețate.
Figura 1. Efectul temperaturii asupra vitezei de reacție.într-o perioadă de timp, enzimele vor fi dezactivate la temperaturi chiar moderate. Depozitarea enzimelor la 5°C sau mai jos este, în general, cea mai potrivită. Temperaturile mai scăzute duc la reacții chimice mai lente., Enzimele vor deveni în cele din urmă inactive la temperaturi de îngheț, dar își vor restabili cea mai mare parte a activității enzimatice atunci când temperaturile cresc din nou, în timp ce unele enzime își pierd activitatea atunci când sunt înghețate.
energia cinetică și energia internă
temperatura unui sistem este într-o oarecare măsură o măsură a energiei cinetice a moleculelor din sistem. Coliziunile dintre toate moleculele cresc odată cu creșterea temperaturii. Acest lucru se datorează creșterii vitezei și a energiei cinetice care urmează creșterii temperaturii. Cu viteze mai rapide, va fi mai puțin timp între coliziuni., Acest lucru duce la mai multe molecule care ajung la energia de activare, ceea ce crește rata reacțiilor. Deoarece moleculele se mișcă și mai repede, coliziunile dintre enzime și substraturi cresc și ele. Astfel, cu cât energia cinetică este mai mică, cu atât temperatura sistemului este mai mică și, de asemenea, cu cât energia cinetică este mai mare, cu atât temperatura sistemului este mai mare.pe măsură ce temperatura sistemului este crescută, energia internă a moleculelor din sistem va crește., Energia internă a moleculelor poate include energia de translație, energia vibrațională și energia de rotație a moleculelor, energia implicată în legarea chimică a moleculelor, precum și energia implicată în interacțiunile nonbonding. O parte din această căldură poate fi transformată în energie potențială chimică. Dacă această creștere a energiei potențiale chimice este suficient de mare, unele dintre legăturile slabe care determină forma tridimensională a proteinelor active pot fi rupte. Acest lucru ar putea duce la denaturarea termică a proteinei și astfel inactivarea proteinei., Astfel, prea multă căldură poate determina scăderea ratei unei reacții catalizate de enzime, deoarece enzima sau substratul devine denaturat și inactiv.
temperatura optimă
fiecare enzimă are un interval de temperatură în care se obține o viteză maximă de reacție. Acest maxim este cunoscut sub numele de temperatura optimă a enzimei. Temperatura optimă pentru majoritatea enzimelor este de aproximativ 98,6 grade Fahrenheit (37 grade Celsius). Există, de asemenea, enzime care funcționează bine la temperaturi mai scăzute și mai ridicate., De exemplu, animalele arctice au enzime adaptate la temperaturi optime mai scăzute; animalele din climatul deșertului au enzime adaptate la temperaturi mai ridicate. Cu toate acestea, enzimele sunt încă proteine și, ca toate proteinele, încep să se descompună la temperaturi de peste 104 grade Fahrenheit. Prin urmare, intervalul de activitate enzimatică este determinat de temperatura la care enzima începe să se activeze și de temperatura la care proteina începe să se descompună.,pentru a discuta mai multe detalii despre servicii, vă rugăm să ne contactați sunând la 1-631-562-8517 sau prin e-mail la [email protected].
















Lasă un răspuns