US Pharm. 2010;35(5):36-41.o relație între diabet zaharat (DM) și demență este incontestabilă, numeroase studii concluzionând că DM crește riscul de declin cognitiv și demență, inclusiv boala Alzheimer (AD).1-5 nu numai că DM crește riscul de demență, ci crește de fapt rata de dezvoltare a demenței de două până la trei ori.,3 mecanismul acestei afectări nu este pe deplin înțeles, dar se presupune că hiperglicemia, rezistența la insulină, stresul oxidativ, produsele finale avansate de glicare și citokinele inflamatorii conduc colectiv la disfuncții cognitive.5 de fapt, diabetul a fost descris ca un „tip special de îmbătrânire accelerată” în 1976 datorită numeroaselor sale complicații asociate.,5 suprapunerea aparentă dintre DM și demență a dus la sugestia că AD nu este doar o tulburare neurologică, ci mai degrabă o tulburare neuroendocrină, cu Steen et al coining termenul de diabet de tip 3 pentru a descrie această boală hibridă.,6
privire de Ansamblu de Insulină Rezistența/Toleranța Alterată la Glucoză
Fiziopatologie: Atât toleranța alterată la glucoză—definit ca o glucozei plasmatice de 140 mg/dL la 199 mg/dL după un orale test de toleranță la glucoză și alterarea glicemiei à jeun—definit ca o glucozei plasmatice à jeun de 100 mg/dL la 125 mg/dL—se diagnosticul de prediabet (precursor de tip 2 DM ), ca este un hemoglobina A1C de 5,7% la 6,4%.7 fiziopatologia prediabetului este aceeași cu cea a T2DM, care este diagnosticată după o glucoză din sânge de 126 mg/dL sau mai mare sau un A1C de 6.,5% sau mai mare (test repetat pentru confirmare).7 în ambele condiții, rezistența la insulină se dezvoltă în țesuturile periferice, unde insulina este necesară pentru absorbția glucozei (și anume mușchi, ficat și grăsime), iar pancreasul este obligat să furnizeze din ce în ce mai multă insulină pentru a depăși această rezistență.8 în această etapă, pacienții sunt adesea hiperinsulinemici; cu toate acestea, în timp, pancreasul nu poate satisface cerințele țesuturilor, iar celulele beta producătoare de insulină ale pancreasului eșuează încet, producând din ce în ce mai puțină insulină.,8 fără suficientă insulină, concentrațiile de glucoză din sânge cresc, ducând la prediabet și, la până la 70% dintre pacienții cu prediabet, T2DM.9 complicațiile hiperglicemiei sunt numeroase și cuprind un risc crescut de complicații macrovasculare (inclusiv infarct miocardic, accident cerebrovascular și boală vasculară periferică) și complicații microvasculare (inclusiv nefropatie, neuropatie și retinopatie).7
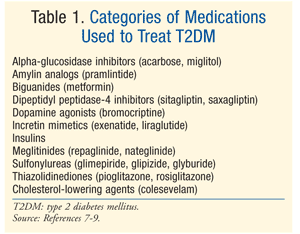
tratament: există multe terapii pentru a trata DM., Tratamentul inițial atât pentru prediabet, cât și pentru T2DM este modificarea stilului de viață care implică dietă, exerciții fizice și scădere în greutate.7 Asociația Americană pentru diabet (ADA) recomandă, de asemenea, luarea în considerare a metforminei la pacienții cu prediabet care prezintă un risc ridicat de a dezvolta diabet.7 metformina este recomandată ca terapie farmacologică inițială pentru T2DM.7 adesea, este necesară o terapie farmacologică suplimentară pentru a atinge obiectivele glicemice ADA, inclusiv un A1C <7%.,7 Există numeroase clase de medicamente pentru T2DM (tabelul 1), iar alegerea agentului pentru normalizarea glicemiei depinde de o serie de factori specifici pacientului și medicamentelor. Este important de menționat că mulți pacienți cu T2DM vor necesita în cele din urmă insulină exogenă pentru a obține și menține euglicemia, deoarece funcția celulelor beta scade progresiv.
imagine de Ansamblu a AD
Fiziopatologie: AD este cea mai comună formă de demență la persoanele în vârstă, reprezentând 60% la 80% din toate cazurile.,10 două semne histopatologice ale AD sunt plăcile neuritice și încurcăturile neurofibrilare.11 plăci constau din proteine beta-amiloide insolubile. Tangles, care sunt intracelulare, sunt compuse din proteine tau fosforilate. Proteina Tau este importantă pentru asamblarea microtubulilor, iar atunci când această proteină este fosforilată anormal, funcția neuronală este întreruptă. Încurcările neurofibrilare afectează cel mai frecvent neuronii colinergici.12 în plus, întreruperea principalului neurotransmițător excitator, glutamatul, contribuie la patologia AD., În AD, există o supraactivare a glutamatului, semnalizând un proces cunoscut sub numele de excitotoxicitate, care duce la formarea plăcii, hiperfosforilarea proteinei tau și moartea celulelor.12 în rezumat, excitotoxicitatea și formarea plăcilor neuritice și a încurcărilor neurofibrilare perturbă căile neurotransmițătorilor, ducând la afectarea învățării și a memoriei asociate cu AD.tratamentul: terapiile farmacologice disponibile aprobate de FDA pentru AD sunt rezumate în tabelul 2.,11,12 deși există încă multe de învățat în ceea ce privește terapiile care tratează sau modifică patologia AD, terapiile disponibile în prezent implică utilizarea inhibitorilor de acetilcolinesterază, dintre care există patru și antagonistul receptorului N-metil-D-aspartat memantină.

Insulină și Creierul
Deși este necesar pentru glucoză transport în țesuturile periferice, insulina nu par a fi necesare pentru transportul de glucoză în creier sau pentru cerebrală metabolismul glucozei., În timp ce transportul glucozei către creier nu este dependent de insulină, insulina însăși este transportată prin bariera hemato–encefalică (BBB) prin procesele de transport mediate de receptorul insulinei.13 Acest mecanism de transport este saturabilă; la perioade prelungite de excesul de concentrații de insulină (hiperinsulinemie) în periferie, cum ar fi cele observate în prediabet si dz de tip 2, acest receptor-mediată mecanism de transport dereglează, reducând, astfel, transportul de insulină în creier și în lichidul cefalorahidian.,în plus față de insulină, factorul de creștere asemănător insulinei de tip 1 (IGF-1) este prezent în creier și este necesar pentru creșterea și funcția normală a sistemului nervos central (SNC).14 receptorii de insulină și IGF-1 sunt localizați în întregul creier pe neuroni și astrocite (celule în formă de stea din SNC care ajută la susținerea neuronilor din creier). Două zone ale creierului care sunt cruciale pentru învățare și memorie, hipocampul și hipotalamusul, conțin concentrații mari de receptori de insulină.5 la șobolani, s-a demonstrat că administrarea insulinei intracerebroventriculare îmbunătățește memoria.,15 în plus, s-a constatat că administrarea intranazală a insulinei la om crește performanța memoriei.După cum s-a menționat anterior, insulina nu este necesară pentru metabolismul glucozei cerebrale; cu toate acestea, pot exista zone specifice în creier în care insulina declanșează procese metabolice care implică glucoza. În studiile la șobolan, sa demonstrat că insulina influențează utilizarea glucozei în hipotalamus și locus coeruleus, două domenii importante pentru învățare și memorie.,17 de asemenea, sa demonstrat că învățarea facilitează exprimarea crescută a receptorilor de insulină ai SNC, ceea ce duce la postularea faptului că prezența și activitatea insulinei în creier contribuie și joacă un rol esențial în învățare și memorie. Insulina poate contribui, de asemenea, la modularea neurotransmițătorilor SNC, în special acetilcolina și norepinefrina, ambele fiind esențiale pentru cunoașterea normală și sănătatea creierului.,18
rezistența la insulină și demența
Prezentare generală: se pare că există multe defecte în semnalizarea insulinei în creierul pacienților cu AD, ceea ce duce la scăderea utilizării glucozei și a metabolismului energetic.6,19 deoarece T2DM este asociat cu rezistența periferică la insulină, AD este asociat cu rezistența la insulină a creierului.20 la începutul anului AD, se pare că există o absorbție inadecvată a insulinei și o semnalizare în creier, un semn al rezistenței la insulină.5,19,21,22 creșterea receptorilor de insulină au fost observate în creierul pacienților cu AD, probabil ca o compensație pentru rezistența la insulină.,21
În general, această afectare a semnalizării insulinei are multe efecte în aval în AD. O teorie este că concentrațiile scăzute de insulină din SNC determină o scădere a nivelului de acetilcolină și a fluxului sanguin cerebral.13 în plus, modificările concentrațiilor insulinei pot favoriza formarea beta-amiloidului și a proteinei tau.2 în creier, enzima degradantă a insulinei (IDE) este implicată în degradarea și clearance-ul proteinelor beta-amiloide.21 nivelurile ridicate de insulină inhibă IDE și pot duce la o scădere a clearance-ului beta-amiloid, crescând ulterior depunerea cerebrală a beta-amiloidului.,5,19,21
recent ceramidele, o familie de lipide, au atras atenția asupra rolului lor potențial în rezistența la insulină și demență.23,24 ceramide sunt generate în prezența inflamației, care este frecventă în obezitate, T2DM și AD.Deoarece ceramida traversează cu ușurință BBB, expunerea determină metabolismul energetic afectat și modificări ale expresiei genei insulinei, contribuind la rezistența la insulină.23,24 aceasta este în prezent o zonă activă de interes, cercetătorii demonstrând că inhibarea sintezei ceramidei a împiedicat rezistența la insulină mediată de obezitate.,Insulina intranazală: după cum sa menționat anterior, administrarea intranazală a insulinei îmbunătățește performanța memoriei la om.16 au fost efectuate mai multe studii privind insulina intranazală. La administrare de 20 de unități de intranazal insulină două ori pe zi la subiecți umani, Reger et al constatat că, în comparație cu placebo, grupul tratat cu insulină reținute mai multe informații verbale și a arătat îmbunătățit atenția și starea funcțională.,25 acești cercetători au remarcat, de asemenea, că glucoza plasmatică în repaus și insulina nu s-au schimbat cu utilizarea intranazală a insulinei, indicând faptul că administrarea intranazală asigură accesul direct la insulină la SNC fără efecte periferice.25,26
agoniști PPAR-gama: studiați extensiv pentru tratamentul rezistenței periferice la insulină, tiazolidindionele rosiglitazonă și pioglitazonă sunt investigate pentru rolul lor în tratarea AD. Tiazolidindionele sunt agoniști ai receptorului activat de proliferatorul peroxizomilor (PPAR) – gamma., PPAR-gamma este implicat în metabolismul glucozei și lipidelor și modulează inflamația, un contribuitor cunoscut la AD.22,27 tiazolidindionele sunt sensibilizante la insulină, care lucrează pentru a reduce rezistența la insulină; de asemenea, par să scadă inflamația.21,26 În mai multe studii clinice controlate cu placebo, pacienții tratați cu rosiglitazonă s-au ameliorat memoria și funcția cognitivă.21,22,28 deși au fost efectuate doar studii mici de pioglitazonă, acest medicament a fost, de asemenea, asociat cu îmbunătățiri ale memoriei și cunoașterii.,Cu toate că pioglitazona și rosiglitazona prezintă o permeabilitate scăzută la BBB, fiecare dintre aceste medicamente a fost documentat la nivelul creierului după administrarea orală.22 deși aceste medicamente pot juca un rol în prevenirea sau tratamentul AD, acestea nu sunt în prezent aprobate de FDA pentru pacienții cu AD, iar beneficiile și riscurile potențiale ale acestora trebuie luate în considerare în mod individual.exercițiul Aerobic: poate cea mai eficientă și cea mai neglijată metodă de reducere a rezistenței la insulină este activitatea fizică., Obezitatea a fost asociată cu un risc crescut de rezistență la insulină, diabet, demență și AD.Exercițiul 29,30 îmbunătățește sensibilitatea la insulină și scade nivelul insulinei periferice.Activitatea fizică 26,31, independentă de greutate, este asociată cu un risc mai mic de AD, făcându-l singura terapie neuroprotectoare dovedită.29-31 un posibil mecanism al acestei neuroprotecții este că exercițiul promovează clearance-ul proteinelor beta-amiloide și crește factorul neurotrofic derivat din creier, un factor de creștere vital cunoașterii și supraviețuirii neuronale care este redus în AD.,32
rolul farmacistului
farmaciștii joacă un rol esențial în educarea pacienților cu privire la noile terapii; de asemenea, trebuie să fie la curent cu noile descoperiri sau afecțiuni medicale care sunt frecvent prezentate în știri. Diabetul de tip 3 este o astfel de afecțiune. Deși rămân multe de învățat despre această potențială legătură Nouă între diabet și afectarea cunoașterii, publicul va cere opinia furnizorilor de servicii medicale. În plus, mulți pacienți cu diabet zaharat vor fi interesați să învețe mai mult și vor apela la farmaciștii lor pentru informații., Prin urmare, farmaciștii ar trebui să discute înțelegerea actuală a acestei afecțiuni cu pacienții lor și, de asemenea, să-i sfătuiască cu privire la strategii care le pot reduce riscul, având în vedere comorbiditățile individuale.studiul intensiv este în curs de desfășurare în încercarea de a caracteriza mai bine diabetul de tip 3 și de a dezvolta strategii preventive și terapeutice. Până în prezent, nu există tratamente specifice cu eficacitate dovedită în prevenirea declinului cognitiv sau a AD la pacienții cu DM., Prin urmare, managementul insuficienței cognitive la pacienții cu DM este identic cu cel al pacienților fără DM, cu atenție specifică controlului glicemic și factorilor de risc cardiovascular. Aceasta este aceeași abordare deja esențială pentru prevenirea complicațiilor legate de DM. În timp ce unele grupuri de pacienți par să prezinte un risc crescut de insuficiență cognitivă, majoritatea pacienților cu DM nu au asociații clinice bine definite., Deși nu sunt disponibile opțiuni specifice de tratament, abordarea logică actuală este de a atinge controlul glicemic și de a gestiona cu prudență factorii de risc cardiovascular, cum ar fi hiperlipidemia și hipertensiunea.
1. Stewart R, Liolitsa D. diabet zaharat de tip 2, tulburări cognitive și demență. Diabet Med.
2. Xu WL, von Strauss E, Qiu CX, și colab. Diabetul necontrolat crește riscul bolii Alzheimer: un studiu de cohortă bazat pe populație. Diabetologia. 2009;52:1031-1039.
3. Arvanitakis Z, Wilson RS, Bennett DA. Diabetul zaharat, demența și funcția cognitivă la persoanele în vârstă., J Nutr Sănătate Îmbătrânire. 2006;10:287-291.
4. De asemenea, este important să se ia în considerare și alte aspecte. Efectul pe termen lung al diabetului zaharat și tratamentul acestuia asupra funcției cognitive. În Engl J Med. 2007;356:1842–1852.
5. Whitmer RA. Diabetul de tip 2 și riscul de insuficiență cognitivă și demență. Curr Neurol Neurosci Rep. 2007;7:373-380.
6. Steen E, Terry BM, Rivera EJ, și colab. Insulina afectată și expresia factorului de creștere asemănător insulinei și mecanismele de semnalizare în boala Alzheimer—este acest diabet de tip 3? J Alzheimers Dis. 2005;7:63-80.
7. Asociația Americană De Diabet. Standarde de îngrijire medicală în diabet—2010., Îngrijirea Diabetului.
8. Triplitt Cl, Reasner CA, Isley WL. Diabet zaharat. În: DiPiro JT, Talbert RL, Yee GC, și colab., eds. Principii de farmacoterapie & practică. A 7-a ed. New York, NY: McGraw Hill Medical; 2008: 1205-1241.
9. Nathan DM, Buse JB, Davidson MD, și colab. Managementul Medical al hiperglicemiei în diabetul de tip 2: un algoritm de consens pentru inițierea și ajustarea terapiei: o declarație de consens a Asociației Americane de diabet și a Asociației Europene pentru studiul diabetului. Îngrijirea Diabetului.
10. Hebert LE, Scherr PA, Bienias JL și colab., Boala Alzheimer în populația SUA: estimări ale prevalenței folosind recensământul din 2000. Arch Neurol. 2003;60:1119-1122.
11. Cummings J. boala Alzheimer. În Engl J Med. 2004;351:56-67.
12. Slattum PW, Swerdlow RH, Hill AM. Boala Alzheimer. În: DiPiro JT, Talbert RL, Yee GC, și colab., eds. Principii de farmacoterapie & practică. A 7-a ed. New York, NY: McGraw Hill Medical; 2008: 1051-1065.
13. Craft S, Watson GS. Insulina și boala neurodegenerativă: mecanisme comune și specifice. Lancet Neurol. 2004;3:169-178.
14. de la Monte SM, Wands JR., Revizuirea exprimării, semnalizării și disfuncționalității factorului de creștere asemănător insulinei și insulinei în sistemul nervos central: relevanță pentru boala Alzheimer. J Alzheimers Dis. 2005;7:45-61.
15. Parcul CR, Seeley RJ, Craft S, Woods SC. Insulina intracerebroventriculară îmbunătățește memoria într-o sarcină de evitare pasivă. Physiol Se Comportă. 2000;68:509-514.
16. Fehm HL, Perras B, Smolnik R, și colab. Manipularea căilor neuropeptidergice la om: o abordare nouă a neurofarmacologiei? Eur J Pharmacol. 2000;405:43-54.
17. Zhao WQ, Alkon dl. Rolul insulinei și al receptorului insulinei în învățare și memorie., Mol Cell Endocrinol. 2001;177:125-134.
18. Kopf S, Baratti C. Efectele posttraining administrarea de insulină pe de retenție de o acomodare răspuns la șoareci: participarea unei centrale mecanism colinergic. Neurobiol Învață Mem.
19. Revill P, Moral MA, Prous JR. semnalarea insulinei afectate și patogeneza bolii Alzheimer. Droguri Astăzi (Barc). 2006;42:785-790.
20. Moroz N, Tong M, Longato L, și colab. Neurodegenerare limitată de tip Alzheimer în obezitatea experimentală și diabetul zaharat de tip 2. J Alzheimers Dis. 2008;15:29-44.
21. Haan MN., Terapia insight: diabetul zaharat de tip 2 și riscul bolii Alzheimer cu debut tardiv. Nat Clin Pract Neurol. 2006;2:159-166.
22. Landreth G, Jiang Q, Madrekar S, și colab. Agoniștii PPARgamma ca terapeutici pentru tratamentul bolii Alzheimer. Neurotherapeutics. 2008;5:481-489.
23. Lyn-Cook LE, Lawton M, Tong M, și colab. Ceramida hepatică poate Media rezistența la insulină a creierului și neurodegenerarea în diabetul de tip 2 și steatohepatita non-alcoolică. J Alzheimers Dis.
24. Tong M, de la Monte SM. Mecanisme de neurodegenerare mediată de ceramidă. J Alzheimers Dis.
25., Reger MA, Watson GS, Green PS. Insulina intranazală îmbunătățește cunoașterea și modulează beta-amiloidul în AD timpuriu. Neurologie. 2008;70:440-448.
26. Craft S. sindromul de rezistență la insulină și boala Alzheimer: efecte legate de vârstă și obezitate asupra memoriei, amiloidului și inflamației. Îmbătrânirea Neurobiolului. 2005; 26 (supl 1):65-69.
27. Jiang Q, Heneka M, Landreth GE. Rolul peroxisome proliferator-activated receptor gamma (PPARgamma) în boala Alzheimer: implicații terapeutice. Medicamente pentru SNC. 2008;22:1-14.
28. Watson GS, Cholerton BA, Reger MA, și colab., Cunoașterea conservată la pacienții cu boală Alzheimer precoce și insuficiență cognitivă ușoară amnezică în timpul tratamentului cu rosiglitazonă: un studiu preliminar. Am J Geriatr Psihiatrie. 2005;13:950-958.
29. Luchsinger JA, Mayeux R. adipozitate și boala Alzheimer. Curr Alzheimer Res. 2007; 4: 127-134.
30. Whitmer RA. Epidemiologia adipozității și demenței. Curr Alzheimer Res. 2007; 4: 117-122.
31. Watson GS, Craft S. rolul rezistenței la insulină în patogeneza bolii Alzheimer: implicații pentru tratament. Medicamente pentru SNC. 2003;17:27-45.
32. Cole GM, Frautschy SA., Rolul insulinei și semnalizării factorului neurotrofic în îmbătrânirea creierului și boala Alzheimer. Exp Gerontol. 2007;42:10-21.
















Lasă un răspuns