Managementul materne alloimmunization
Ca o regulă, seriale materne titruri de anticorpi sunt monitorizate până la o critică titru de 1:32, care indică faptul că un risc ridicat de hydrops fetale a fost atins. În acest moment, fătul necesită o monitorizare foarte intensă pentru semne de anemie și hidrops fetale., În aloimunizarea Kell, hidrops pot apărea la titruri materne scăzute din cauza eritropoiezei suprimate și, astfel, un titru de 1:8 a fost sugerat ca fiind critic. Prin urmare, valorile delta-OD 450 sunt, de asemenea, nesigure în prezicerea severității bolii în aloimunizarea Kell. titrurile materne nu sunt utile în prezicerea debutului anemiei fetale după prima gestație afectată. Diferențe mari de titruri pot fi observate la același pacient între diferite laboratoare, iar o tehnică mai nouă de gel produce rezultate mai mari decât metoda tubulară mai veche., Prin urmare, trebuie utilizată metodologia standard a tubului pentru a determina titrul critic, iar o modificare de mai mult de 1 diluție reprezintă o creștere reală a titrului de anticorpi materni. Pentru toți anticorpii responsabili de boala hemolitică a nou-născutului (HDN), o creștere de 4 ori a oricărui titru de anticorpi este de obicei considerată o schimbare semnificativă care necesită evaluarea fetală. când este indicat, amniocenteza poate fi efectuată încă de la 15 săptămâni de gestație (rareori necesară în prima sarcină afectată înainte de 24 de săptămâni de gestație) pentru a determina genotipul fetal și pentru a evalua severitatea., Materne și paterne probele de sânge ar trebui să fie trimise la laboratorul de referință cu lichid amniotic eșantion pentru a elimina rezultate fals-pozitive (de la materne pseudogene sau Ccde gene) și rezultate fals negative (de la o rearanjare la RHD gene locus în tatăl).determinarea genotipului Fetal Rh în plasma maternă a devenit rutină în multe țări europene și este oferită în Statele Unite., ADN-ul fără celule fetale reprezintă 3% din totalul ADN-ului plasmatic matern circulant, se găsește încă din 38 de zile de gestație și este derivat din apoptoza stratului citotrofoblast placentar. Timpul mediu de înjumătățire al ADN-ului fetal circulant este în medie mai mic de 30 de minute, iar plasma maternă este supusă filtrării și microcentrifugării pentru a îndepărta toate elementele celulare înainte de testare. Acest lucru elimină rezultatele fals pozitive din celulele fetale grefate ale sarcinilor anterioare în organele limfoide materne.,ADN-ul fetal fără celule este supus unei reacții în lanț a polimerazei în timp real (PCR) pentru prezența secvențelor specifice genei RHD și sa dovedit a fi exactă în 99,5% din cazuri. Gena SRY (la fătul masculin) și polimorfismele ADN din populația generală (la fătul feminin) sunt utilizate ca controale interne pentru a confirma originea fetală a ADN-ului fără celule. Un panou de 92 polimorfisme cu un singur nucleotid (SNPs) este comparat între proba maternă din stratul buffy și plasmă., O diferență de peste 6 SNP confirmă prezența ADN-ului fetal și validitatea testului la un făt feminin. Rezultatele fals negative fiind cele mai nedorite și consecvente se datorează fenotipurilor d parțiale sau slabe. Acestea sunt detectate prin utilizarea a cel puțin doi primeri Exon specifici RHD și rulate în duplicate. din fericire, Testarea ADN-ului fetal fără celule pentru determinarea genotipului pentru alte antigene ale globulelor roșii,cum ar fi c, C, E, E și Kell, se dovedește a fi extrem de fiabilă și precisă., amniocenteza serială este începută la intervale de 10-14 zile pentru a monitoriza severitatea bolii la făt. Toate încercările trebuie făcute pentru a evita trecerea transplacentară a acului care poate duce la hemoragie fetomaternală (FMH) și la o creștere suplimentară a titrului de anticorpi. Valorile serial delta – OD 450 sunt reprezentate grafic pe diagrama Queenan sau pe graficul liley extins pentru a evalua riscul de hidrops fetale. Ultrasonografia precoce este efectuată pentru a stabili vârsta gestațională corectă., Monitorizarea ultrasonografică frecventă este, de asemenea, efectuată pentru a evalua bunăstarea fetală și pentru a detecta anemia moderată și semnele precoce ale hidropilor.viteza Doppler a arterei cerebrale medii sistolice de vârf (MCA) s-a dovedit a fi un instrument de screening fiabil pentru detectarea anemiei fetale și a înlocuit amniocenteza. MCA este ușor de vizualizat cu Doppler cu flux de culoare; Doppler pulsat este apoi utilizat pentru a măsura viteza sistolică de vârf doar distal la bifurcația sa din artera carotidă internă., Deoarece viteza MCA crește odată cu înaintarea vârstei gestaționale, rezultatul este raportat în multipli de mediană (mame). În studiile recente, sensibilitatea pentru detectarea anemiei fetale moderate și severe sa dovedit a fi de 100%, cu o rată fals pozitivă de 10% la 1,5 MOM. Sa demonstrat că reduce necesitatea unor proceduri de diagnostic invazive, cum ar fi amniocenteza și cordocenteza cu mai mult de 70%. studiile MCA Doppler pot fi începute încă de la 18 săptămâni de gestație, dar nu sunt fiabile după 35 de săptămâni de gestație., De asemenea, a fost folosit în timp transfuzia fetală ulterioară și pentru a diagnostica anemia din mai multe cauze, cum ar fi transfuzia twin-twin. Panta MCA din citirile săptămânale 3 este acum utilizată pentru a prezice riscul fetal pentru anemie severă (vezi imaginea de mai jos).
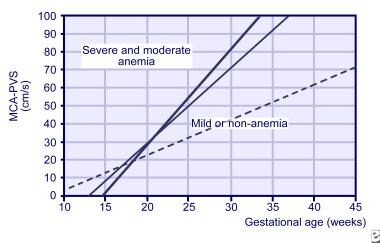 pante pentru viteza sistolică maximă în artera cerebrală medie (MCA) pentru fetușii normali (linie punctată), fetușii ușor anemici (linie subțire) și fetușii cu anemie severă (linie groasă)., cu dobândirea de experiență în efectuarea studiului Doppler MCA, amniocenteza serială pentru detectarea anemiei fetale a fost utilizată într-o măsură mai mică. în perioada în care transfuzia peritoneală intrauterină a fost singurul mijloc de tratament, nou-născuții au fost livrați în mod obișnuit la 32 de săptămâni de gestație. Această abordare a dus la o incidență ridicată a bolii membranei hialine și a transfuziilor de schimb., Odată cu apariția transfuziei intravasculare (IVT) in utero, abordarea generală a fătului grav afectat este de a efectua IVT după cum este necesar până la 35 de săptămâni de gestație, cu livrare planificată la termen. Stabilirea maturității pulmonare este dificilă la acești fetuși din cauza contaminării lichidului amniotic cu sânge rezidual în timpul transfuziei; cu toate acestea, dacă nașterea este planificată înainte de 34 de săptămâni de gestație, este indicată administrarea de steroizi materni pentru a spori maturitatea pulmonară fetală.,
pante pentru viteza sistolică maximă în artera cerebrală medie (MCA) pentru fetușii normali (linie punctată), fetușii ușor anemici (linie subțire) și fetușii cu anemie severă (linie groasă)., cu dobândirea de experiență în efectuarea studiului Doppler MCA, amniocenteza serială pentru detectarea anemiei fetale a fost utilizată într-o măsură mai mică. în perioada în care transfuzia peritoneală intrauterină a fost singurul mijloc de tratament, nou-născuții au fost livrați în mod obișnuit la 32 de săptămâni de gestație. Această abordare a dus la o incidență ridicată a bolii membranei hialine și a transfuziilor de schimb., Odată cu apariția transfuziei intravasculare (IVT) in utero, abordarea generală a fătului grav afectat este de a efectua IVT după cum este necesar până la 35 de săptămâni de gestație, cu livrare planificată la termen. Stabilirea maturității pulmonare este dificilă la acești fetuși din cauza contaminării lichidului amniotic cu sânge rezidual în timpul transfuziei; cu toate acestea, dacă nașterea este planificată înainte de 34 de săptămâni de gestație, este indicată administrarea de steroizi materni pentru a spori maturitatea pulmonară fetală.,
În plus, lichidul amniotic în exces de bilirubină cauza falsă altitudine pe fluorescență depolarizare TDx pulmonare fetale testul de maturitate, versiunea II (TDX-FLMII); prin urmare, alte teste pentru a determina pulmonare fetale maturitate ar trebui să fie utilizate, cum ar fi spectroscopia în infraroșu, lamelar body count, phosphatidylglycerol cuantificare sau lecitina/sfingomielina (L/S) raport.Liley a descris pentru prima dată transfuzia intraperitoneală (IPT) în 1963. Un ac Tuohy este introdus în cavitatea peritoneală fetală sub îndrumare ultrasonografică., Un cateter epidural este filetat prin ac. Un mediu radiopatic este injectat în peritoneul fetal. Plasarea corectă este confirmată prin delimitarea în afara intestinului sau sub diafragmă sau prin difuzie în ascite fetale.,ss mult de 4-zile-vechi, grupa O, Rh negativ, Kell negativ, leukoreduced, iradiate cu 25 Gy pentru prevenirea bolii grefă contra gazdă, și comparat cu ser matern sunt injectate în 10 mL alicote la un volum calculat prin următoarea formulă:
IPT volumul = (gestație în săptămâni – 20) × 10 mL
Reziduale hemoglobinei (Hb) în care fătul este estimat pentru a permite spațierea corectă a IPT și selecție de gestație de livrare prin următoarea formulă:
Hb g/dL = 0.,85/125 × a/b × 120 – c/120
În formulă, o reprezintă cantitatea de donator RBC Hb transfuzat, b este estimarea greutății fetale, și c este intervalul în zile de la data de transfuzie la data de donator Hb estimare.IPT se repetă atunci când se estimează că Hb fetal a scăzut la 10 g/dl. De obicei, un al doilea IPT se efectuează la 10 zile după prima transfuzie pentru a ridica Hb peste 10 g/dl. Apoi, o altă transfuzie se efectuează la fiecare 4 săptămâni până la momentul livrării planificate la 34-35 de săptămâni de gestație., Mișcările diafragmatice fetale sunt necesare pentru ca absorbția RBC să aibă loc. Această abordare nu are nicio valoare pentru un făt muribund care nu respiră. Complicațiile materne includ infecția și hemoragia transplacentară, în timp ce complicațiile fetale sunt supratransfuzia, exsanguinarea, tamponada cardiacă, infecția, travaliul prematur și boala grefă versus gazdă. Ratele de supraviețuire după IPT s-au apropiat de aproximativ 75% cu ajutorul ultrasonografiei.,direct IVT a devenit o cale preferată de intervenție fetală din cauza ratei mai mari de complicații și a eficacității limitate a IPT la un făt hidropic. Rodeck a efectuat cu succes IVT în 1981. Cu ghidarea ultrasonografică, un ac de calibru 20-22 este introdus într-o venă ombilicală la introducerea cordonului în placentă sau în porțiunea sa intrahepatică și se obține o probă de sânge fetal. Proba de sânge este confirmată a fi de origine fetală prin testul rapid de denaturare alcalină., Se efectuează toate testele fetale relevante (de exemplu, tipul de sânge, testul direct al anticorpilor, numărul reticulocitelor, numărul de trombocite, nivelul Hb, nivelul Hct, nivelul albuminei serice, nivelul eritropoietinei). Dacă nivelul Hb este mai mic de 11 g/dL sau dacă nivelul Hct este mai mic de 30%, se începe o IVT. Poziția acului este confirmată prin observarea turbulenței în vasul fetal la injectarea de soluție salină. Fătul este frecvent paralizat cu pancuroniu și i se administrează fentanil 10 mcg/kg pentru a preveni deplasarea acului prin mișcări fetale., Medicația maternă variază de la anestezie locală, până la indometacin de rutină și sedare conștientă, până la analgezie epidurală spinală. transfuzia se efectuează în alicote de 10 mL la un volum de aproximativ 50 mL/kg greutate corporală estimată folosind ultrasonografie sau până când se atinge un nivel de Hct de 40%. Procedura este întreruptă prompt dacă se observă decompensarea cardiacă la rezultatele ultrasonografiei., Fetușii anemici sever nu tolerează corecția acută a Hct la valorile normale, iar Hct inițial nu trebuie crescut cu mai mult de 4 ori la momentul primei IVT. Acestea ar trebui apoi monitorizate la fiecare 2-7 zile. IVT se repetă atunci când atinge o valoare care reflectă anemia critică la făt. Se poate anticipa o pierdere de 1% din celulele transfuzate pe zi. unele centre efectuează transfuzii repetate la intervale de 10 zile, 2 săptămâni și la fiecare 3 săptămâni. Alții transfuzează pe baza unei scăderi anticipate a hemoglobinei fetale de 0, 4 g/dL/zi, 0, 3 g/dL/zi și 0.,2 g/dL/zi pentru primul, al doilea și, respectiv, al treilea interval de transfuzie. Viteza maximă a MCA sistolică a fost utilizată la momentul celei de-a doua transfuzii, cu un prag de 1, 32 MOM. După prima transfuzie intrauterină, prezența globulelor roșii cu hemoglobină adultă suprimă eritropoieza și îmbunătățește eliberarea de oxigen, care este responsabilă pentru corelația slabă dintre viteza maximă MCA și severitatea anemiei fetale. Unele centre au descoperit un efect benefic al transfuziei combinate IVT și IPT asupra intervalului de repetare a transfuziei., în plus față de complicațiile IPT, au fost raportate bradicardie fetală tranzitorie, hematom cordonal, compresie a venei ombilicale și moarte fetală în timpul IVT. Cu toate acestea, IVT are multe avantaje, inclusiv corectarea imediată a anemiei și rezolvarea hidrops fetale, rata redusă de hemoliză și hiperinsulinemie ulterioară, și accelerarea creșterii fetale pentru fetusi nonhidropice, care sunt adesea retardat de creștere. IVT este singura intervenție disponibilă pentru fetușii hidropici muribunzi și pentru cei cu placentă anterioară. Riscul pierderii fetale este de aproximativ 0, 8% cu IVT față de 3.,5% pe procedură pentru IPT, iar rata globală de supraviețuire este de 88%.RBC-urile materne recent spălate au fost utilizate cu succes ca sursă de RBC-uri antigen-negative în caz de incompatibilitate rară, dar au fost utilizate în mod obișnuit din cauza beneficiilor cum ar fi scăderea riscului de sensibilizare la noi antigene de celule roșii, un timp de înjumătățire circulant mai lung fiind proaspăt și riscul scăzut de transmitere a agenților virali. Mama poate dona o unitate de celule roșii după primul trimestru.,în cazul imaturității pulmonare și delta-OD 450 în zona afectată a curbei Queenan, administrarea orală a 30 mg de fenobarbital la mamă de 3 ori pe zi, urmată de inducție într-o săptămână, reduce nevoia de transfuzie de schimb la nou-născutul afectat. Algoritmi excelenți pentru gestionarea primei sarcini afectate și a sarcinii la o mamă cu făt afectat anterior sunt subliniați într-o revizuire a lui Moise (vezi imaginile de mai jos).
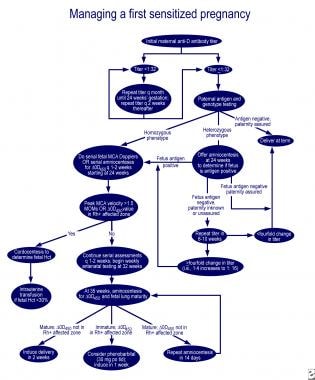 Managementul primei sarcini afectate.,
Managementul primei sarcini afectate., 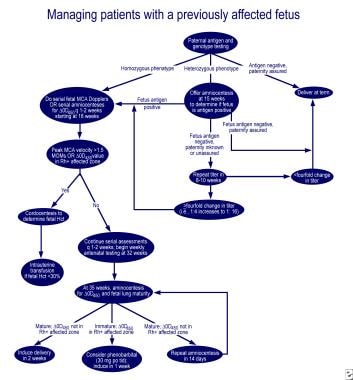 Managementul femeilor însărcinate cu făt afectat anterior. încercările inițiale de a suprima producția de anticorpi Rh cu hapten Rh, stroma RBC Rh pozitivă și administrarea de prometazină nu au avut succes. Plasmafereza extensivă cu înlocuire parțială utilizând albumină 5% (schimb plasmatic terapeutic) și imunoglobulină intravenoasă (IGIV) sau administrarea de IGIV la 1 g/kg greutate corporală săptămânal s-a dovedit a fi moderat eficace., Mecanismul de acțiune pare să fie blocarea receptorilor Fc în placentă, reducând transportul anticorpilor către făt, receptorii Fc pe fagocitele din sistemul reticuloendotelial fetal și inhibarea feedback-ului sintezei anticorpilor materni. Cu toate acestea, citotoxicitatea mediată de celule dependentă de anticorpi și creșterea de rebound a concentrației de anticorpi, modificarea fluxului sanguin placentar în timpul procedurii și hemoragia postpartum au fost observate după schimbul plasmatic.,
Managementul femeilor însărcinate cu făt afectat anterior. încercările inițiale de a suprima producția de anticorpi Rh cu hapten Rh, stroma RBC Rh pozitivă și administrarea de prometazină nu au avut succes. Plasmafereza extensivă cu înlocuire parțială utilizând albumină 5% (schimb plasmatic terapeutic) și imunoglobulină intravenoasă (IGIV) sau administrarea de IGIV la 1 g/kg greutate corporală săptămânal s-a dovedit a fi moderat eficace., Mecanismul de acțiune pare să fie blocarea receptorilor Fc în placentă, reducând transportul anticorpilor către făt, receptorii Fc pe fagocitele din sistemul reticuloendotelial fetal și inhibarea feedback-ului sintezei anticorpilor materni. Cu toate acestea, citotoxicitatea mediată de celule dependentă de anticorpi și creșterea de rebound a concentrației de anticorpi, modificarea fluxului sanguin placentar în timpul procedurii și hemoragia postpartum au fost observate după schimbul plasmatic.,
mai recent studiu retrospectiv cuprinzând 5 femei gravide cu grave HDFN din cauza RBC alloimmunization raportat tratarea cu succes combinat cu un regim terapeutic cu plasmă schimb, IVIG, și transfuzia intrauterină (IUT) de timpuriu în sarcini. Femeile au suferit 3 proceduri de schimb de plasmă în săptămânile 10-13 de sarcină, urmând perfuzii săptămânale de IVIG; fetușii au primit unități RBC care au corespuns complet fenotipului matern cu grupurile de antigen D, C, E, K, Fy, Jk și S. Toate femeile au născut sugari sănătoși la 33-38 săptămâni de gestație., cu toate acestea, aceste tehnici amână doar necesitatea prelevării de probe de sânge ombilical percutanat (pub) și IVT până la 20-22 săptămâni de gestație, când aceste proceduri pot fi efectuate cu un risc mai acceptabil. O revizuire a utilizării IVIG arată utilitatea sa în prevenirea apariției hidropilor fetali și în întârzierea necesității IUT., Astfel, o abordare combinată de plasmafereza, care începe la 12 săptămâni de gestație de 3 ori în acea săptămână, urmată de IVIG la o doză de încărcare de 2 g/kg după cel de-al treilea plasmafereza, și apoi a continuat IGIV 1 g/kg/săpt până la 20 de săptămâni de gestație a fost sugerat pentru risc la fetusi înainte de 20 săptămâni de gestație și, de asemenea, poate fi folosit mai târziu în gestație dacă IVT nu poate fi efectuat sau dacă hydrops este nu raspund la IVT., un raport a indicat că tratamentul fetusilor cu aloimunizare severă folosind IVT combinat cu terapia IVIG fetală la 1 g/kg/doză începând cu A treia IVT a ajutat la reducerea frecvenței IVT și îmbunătățirea semnelor de hidrops. Un raport de caz arată tratamentul cu succes al anemiei severe și hidrops la un făt cu aloimunizare datorată anticorpului anti-m cu injecții IVIG intraperitoneale fetale 2 g/kg administrate săptămânal începând cu 30 de săptămâni. Cu toate acestea, acesta a fost un raport de caz și este necesar un studiu controlat randomizat înainte ca acest lucru să devină standard de îngrijire.,
Similare regimuri de teste și tratament sunt utilizate în gestionarea de sarcini afectate de nonRhD alloimmunization, cum ar fi anti-Rhc, anti-K (K1), și anti-M. Odată ce mama este diagnosticata cu un anticorp asociate cu boala hemolitica, indirect Coombs titrul este efectuată, împreună cu patern de testare pentru a implicat antigen și zygosity. Titrurile Materne se repetă (lunar până la 28 de săptămâni de gestație și apoi la fiecare 2 săptămâni) până când se atinge un prag pentru anemia fetală (1:8 pentru Kell și 1:32 pentru odihnă).,tastarea antigenului Fetal se efectuează prin amniocenteză sau ADN fetal fără celule în plasma maternă dacă se constată că tatăl este heterozigot (100% pentru K1, 65% pentru M). Atunci când fătul este cunoscut a fi antigen pozitiv, se efectuează supravegherea pentru anemia fetală severă, cu screening săptămânal MCA Doppler încă din 16-18 săptămâni și IUT se efectuează dacă depășește 1,5 MOM cu o livrare de 38 de săptămâni de gestație. s-a demonstrat că aloanticorpii materni la leucocitele paterne au ca rezultat blocarea Fc și reducerea severității anemiei hemolitice fetale., Acest lucru poate fi folosit în viitor.
Managementul nou-născutului sensibilizat
boala hemolitică ușoară reprezintă 50% dintre nou-născuții cu rezultate pozitive ale testului direct al anticorpilor. Cele mai multe dintre aceste nou-nascuti nu sunt anemic (cablul de hemoglobina >14 g/dL) și au un minim de hemoliza (cablul de bilirubina < 4 mg/dL). În afară de fototerapia timpurie, acestea nu necesită transfuzii. Cu toate acestea, acești nou-născuți sunt expuși riscului de a dezvolta anemie severă târzie cu 3-6 săptămâni de viață. Prin urmare, monitorizarea nivelurilor lor de Hb după externarea din spital este importantă.,boala hemolitică moderată reprezintă aproximativ 25% dintre nou-născuții afectați. Boala hemolitică moderată a nou-născutului se caracterizează prin anemie moderată și niveluri crescute de bilirubină din cordonul ombilical. Acești sugari nu au icter clinic la naștere, dar dezvoltă rapid hiperbilirubinemie neconjugată în primele 24 de ore de viață. Frotiul periferic prezintă numeroase RBC nucleate, trombocite scăzute și, ocazional, un număr mare de granulocite imature., Aceste nou-născuți au adesea hepatosplenomegalie și prezintă riscul de a dezvolta encefalopatie bilirubină fără tratament adecvat. Transfuzia de schimb precoce cu RBC-uri proaspete Rh-negative de tip o cu fototerapie intensivă este de obicei necesară. Utilizarea IVIG în doze de 0,5-1 g/kg într-un regim cu doză unică sau multiplă a reușit să reducă în mod eficient nevoia de transfuzie de schimb., un studiu prospectiv randomizat, controlat, a arătat o doză precoce de IVIG 1 g/kg la vârsta de 12 ore pentru a reduce durata fototerapiei și a șederii în spital și pentru a preveni transfuzia de schimb la nou-născuții cu izoimunizare Rh moderată până la severă. Acești nou-născuți sunt, de asemenea, expuși riscului de a dezvolta anemie hiporegenerativă târzie a copilăriei la 4-6 săptămâni de viață. Cu toate acestea, un studiu randomizat, dublu-orb, controlat cu placebo, nu a reușit să demonstreze beneficiul terapiei profilactice IVIG 0.,75 g / kg în decurs de 4 ore de la vârsta de nou-născuți grav afectați care au fost tratați cu transfuzie intrauterină pentru izoimunizarea Rh. boala hemolitică severă reprezintă restul de 25% din nou-născuții alloimunizați care sunt fie născuți morți, fie hidropici la naștere. Hidrops fetale este predominant cauzată de un sindrom de scurgere capilară din cauza hipoxie tisulară, hipoalbuminemie secundară disfuncției hepatice, și insuficiență cardiacă de mare de ieșire de la anemie., Aproximativ jumătate dintre acești fetuși devin hidropici înainte de gestația săptămânilor 34 și au nevoie de monitorizare și gestionare intensivă a gestației aloimunizate, așa cum s-a descris mai devreme. Ușoară hydrops implică ascita inversează cu IVTs în doar 88% din cazurile cu supraviețuire îmbunătățită, dar severe hydrops provocând scalp edem și ascită severă și exsudat pleural inversă în 39% din cazuri și sunt asociate cu o supraviețuire redusă.Managementul incompatibilității ABO
Managementul hiperbilirubinemiei este o preocupare majoră la nou-născuții cu incompatibilitate ABO., Criteriile pentru transfuzia de schimb și fototerapia sunt similare cu cele utilizate în aloimunizarea Rh. IVIG a fost, de asemenea, foarte eficient atunci când a fost administrat la începutul cursului. Tin (SN) porfirină un inhibitor puternic al oxigenazei heme, enzima care catalizează etapa de limitare a ratei în producția de bilirubină din heme, s-a dovedit a reduce producția de bilirubină și a reduce nevoia de transfuzie de schimb și durata fototerapiei la nou-născuții cu incompatibilitate ABO.la nou-născuți au fost studiate protoporfirina sau mezoporfirina de staniu sau zinc., Acestea trebuie administrate intramuscular într-o doză bazată pe greutatea corporală, iar eficacitatea lor pare să fie dependentă de doză în toate sarcinile. Posibilele lor efecte toxice includ fotosensibilizarea pielii, deficitul de fier și posibila inhibare a producției de monoxid de carbon. Utilizarea lor în boala hemolitică Rh a nou-născutului nu a fost raportată. Utilizarea lor de rutină nu poate fi recomandată încă din cauza lipsei datelor de siguranță pe termen lung.
















Lasă un răspuns