wraz ze wzrostem temperatury, tak samo jak szybkość reakcji enzymatycznych. Wzrost temperatury o dziesięć stopni Celsjusza zwiększy aktywność większości enzymów o 50% do 100%. Zmiany temperatury reakcji tak małe jak 1 lub 2 stopni mogą wprowadzać zmiany od 10% do 20% w wynikach. Wzrost ten jest tylko do pewnego momentu, aż podwyższona temperatura złamie strukturę enzymu. Po denaturacji enzymu nie można go naprawić., Ponieważ każdy enzym różni się swoją strukturą i wiązaniami między aminokwasami i peptydami, temperatura denaturacji jest specyficzna dla każdego enzymu. Ponieważ większość enzymów zwierzęcych ulega szybkiej denaturacji w temperaturze powyżej 40°C, większość oznaczeń enzymów jest przeprowadzana nieco poniżej tej temperatury.
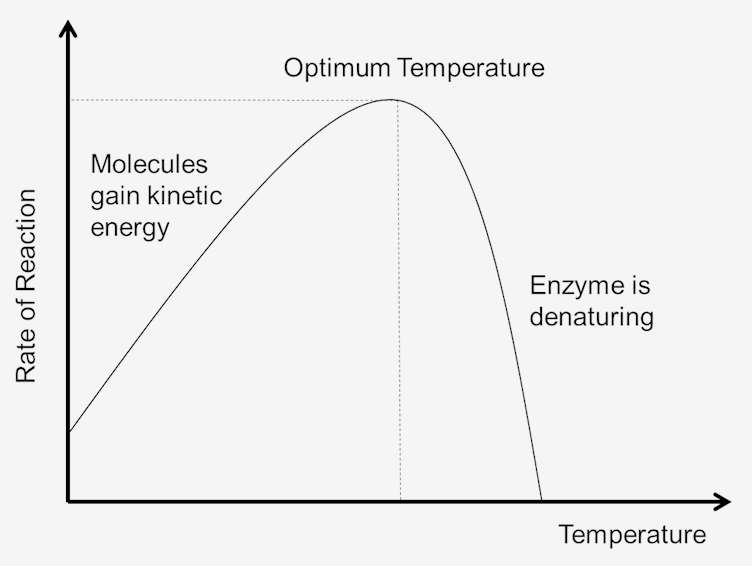 Rysunek 1. Wpływ temperatury na szybkość reakcji.
Rysunek 1. Wpływ temperatury na szybkość reakcji.
przez pewien czas enzymy będą dezaktywowane nawet w umiarkowanych temperaturach. Przechowywanie enzymów w temperaturze 5°C lub niższej jest na ogół najbardziej odpowiednie. Niższe temperatury prowadzą do wolniejszych reakcji chemicznych., Enzymy w końcu staną się nieaktywne w temperaturze zamarzania, ale przywrócą większość aktywności enzymatycznej, gdy temperatura ponownie wzrośnie, podczas gdy niektóre enzymy tracą aktywność po zamrożeniu.
energia kinetyczna i energia wewnętrzna
temperatura układu jest w pewnym stopniu miarą energii kinetycznej cząsteczek w układzie. Kolizje między wszystkimi cząsteczkami zwiększają się wraz ze wzrostem temperatury. Wynika to ze wzrostu prędkości i energii kinetycznej, która następuje po wzroście temperatury. Przy szybszych prędkościach czasu między kolizjami będzie mniej., Powoduje to, że więcej cząsteczek osiąga energię aktywacji, co zwiększa szybkość reakcji. Ponieważ cząsteczki poruszają się szybciej, kolizje między enzymami i substratami również się zwiększają. Zatem im niższa energia kinetyczna, tym niższa temperatura układu i, podobnie, im wyższa energia kinetyczna, tym wyższa temperatura układu.
wraz ze wzrostem temperatury układu wzrośnie energia wewnętrzna cząsteczek w układzie., Energia wewnętrzna cząsteczek może obejmować energię translacyjną, energię wibracyjną i energię obrotową cząsteczek, energię zaangażowaną w wiązanie chemiczne cząsteczek, a także energię zaangażowaną w interakcje niezwiązane. Część tego ciepła może być przekształcona w energię potencjału chemicznego. Jeśli ten wzrost energii potencjału chemicznego jest wystarczająco duży, niektóre słabe wiązania, które determinują trójwymiarowy kształt aktywnych białek, mogą zostać zerwane. Może to prowadzić do termicznej denaturacji białka, a tym samym inaktywacji białka., W ten sposób zbyt dużo ciepła może spowodować zmniejszenie szybkości reakcji katalizowanej enzymem, ponieważ enzym lub substrat staje się denaturowany i nieaktywny.
optymalna temperatura
każdy enzym ma zakres temperatur, w którym osiąga się maksymalną szybkość reakcji. To maksimum jest znane jako optymalne temperatury enzymu. Optymalna temperatura dla większości enzymów wynosi około 98,6 stopni Fahrenheita (37 stopni Celsjusza). Istnieją również enzymy, które działają dobrze w niższych i wyższych temperaturach., Na przykład zwierzęta arktyczne mają enzymy przystosowane do niższych optymalnych temperatur; zwierzęta w klimatach pustynnych mają enzymy przystosowane do wyższych temperatur. Jednak enzymy są nadal białkami i jak wszystkie białka, zaczynają rozkładać się w temperaturze powyżej 104 stopni Fahrenheita. Dlatego zakres aktywności enzymu zależy od temperatury, w której enzym zaczyna się aktywować i temperatury, w której białko zaczyna się rozkładać.,
usługi pokrewne
Kinetyka enzymatyczna
testy Enzymologiczne
w celu omówienia szczegółów usługi prosimy o kontakt pod numerem telefonu 1-631-562-8517 lub e-mail na adres [email protected].
















Dodaj komentarz