| Uniwersytet w Sheffield | |
| Wydział Chemii | VSEPR |
amoniak ma również cztery pary elektronowe, a geometria koordynacji azotu opiera się na czworościennym układzie par elektronowych. Istnieją tylko trzy połączone grupy, dlatego istnieje jedna samotna para. Ponieważ jednak samotne pary są „niewidoczne”, kształt amoniaku jest piramidalny.,R>
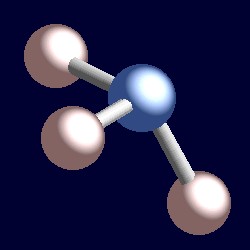
rozważ Wiązanie pary elektronów. Dwa elektrony znajdują się między dwoma jądrami i są przyciągane przez oba. Samotna para jest inna. Jest on koniecznie przyciągany tylko do jednego jądra, a konsekwencją jest to, że przyjmuje pozycję efektywnie bliżej tego jednego jądra niż wiązania par elektronów. Oznacza to, że efektywny kąt bryłowy zajmowany przez samotną parę jest większy niż ten zajmowany przez parę wiązań., Pary samotne wymagają większej przestrzeni kątowej i znajdują się bliżej swoich atomów niż pary wiązań. Konsekwencją tego dla amoniaku jest to, że samotna para robi miejsce dla siebie, spychając trzy atomy wodoru trochę razem, a kąt wiązania H-N-H jest nieco mniejszy (106,6°) niż idealny kąt czworościenny 109,5°.
















Dodaj komentarz