wprowadzenie
chloroplasty reprezentują strukturalną cechę komórek roślinnych i wspierają przetrwanie roślin poprzez ich główny metabolizm i funkcje wysokiego poziomu (Kirk and Tilney-Bassett, 1978; Mullet, 1988; López-Juez and Pyke, 2005). Podczas wegetatywnego wzrostu roślin, komórki liści zawierają wysoce jednorodną populację chloroplastów pod względem wielkości i kształtu., Liczba chloroplastów w komórce jest osiągana przez binarne rozszczepienie istniejących wcześniej organelli i podział na dwie komórki potomne podczas podziału komórki (Birky, 1983; Possingham and Lawrence, 1983). Tak więc regulacja liczby chloroplastów w danym typie komórkowym jest kluczowa dla funkcji komórkowej i dziedziczenia genetycznego chloroplastów.
aby zbadać charakter oznaczania liczby chloroplastów w komórkach roślinnych, dużą rolę odegrały komórki mezofilu liściowego przedstawicieli gatunków ., Komórki te są ważne fizjologicznie dla fotosyntezy i wykazują wysoki stopień jednorodności strukturalnej i funkcjonalnej. Wczesne systematyczne analizy obserwacji izolowanych tkanek i komórek (Boasson and Laetsch, 1969; Possingham and Saurer, 1969; Boffey et al., 1979; Lamppa et al.,, 1980; Thomas and Rose, 1983; Pyke and Leech, 1991) dostarczyły wielu przydatnych informacji na temat oznaczania liczby chloroplastów, w tym pojęcia, że chloroplasty (plastidy) nie są syntetyzowane de novo, ale replikują się przez podział i obserwacji, że liczba chloroplastów mezofilu liściowego jest wrażliwa na różne czynniki środowiskowe i endogenne roślin. W odniesieniu do tego ostatniego, w szpinaku światło ma pozytywny wpływ na podział chloroplastów podczas hodowli dysków liściowych w porównaniu z ciemnymi lub ciemnymi warunkami (Possingham i Lawrence, 1983)., W pierwszych liściach pszenicy objętość komórek jest dodatnio skorelowana z proliferacją chloroplastów (Ellis and Leech, 1985; Pyke and Leech, 1987). W Arabidopsis tło genetyczne wpływa na proliferację chloroplastów; średnia liczba chloroplastów na komórkę w pierwszych liściach wynosi 121 w ekotypie Landsberg erecta (Ler) i 83 w ekotypie Wassilewskija (ws) (Pyke and Leech, 1994; Pyke et al., 1994)., Komórki mezofilu liściowego przyczyniły się również do zrozumienia genetycznej kontroli podziału chloroplastów; na przykład mutanty przesiewowe upośledzone w proliferacji chloroplastów i charakteryzujące funkcje genów zaangażowane w podział chloroplastów ujawniły ponad 20 genów kodujących elementy maszyn do podziału chloroplastów lub czynniki regulacyjne chloroplastów (Gao and Gao, 2011; Miyagishima et al., 2011; Basak and Møller, 2013; Osteryoung and Pyke, 2014; Li et al., 2017).
natomiast badania nad replikacją chloroplastów w komórkach nie-mezofilowych (np.,, komórki bruzd w naskórku liści; Itoh i in., 2018) są rzadkie. Ostatnio stwierdzono, że regulacja podziału chloroplastów różni się między tkankami liści (Fujiwara et al., 2018; Itoh et al., 2018), choć szczegółowy mechanizm pozostaje nieznany. Dodatkowo, podczas gdy analizy hodowanych w zawiesinie komórek BY-2 i protoplastów mezofilu liściowego w tytoniu i merystem wierzchołkowym pędu i komórkami pierwotnymi liści u Arabidopsis (Nebenführ et al., 2000; Sheahan et al.,, 2004; Seguí-Simarro i Staehelin, 2009) dostarczyli głównych spostrzeżeń, w jaki sposób podział chloroplastów (plastid) jest regulowany w roślinach jest nadal niejasny. Tak więc, pomimo znacznych wysiłków, fundamentalne pytania w badaniach nad chloroplastami pozostają, takie jak (i) jak koordynowana jest liczba chloroplastów na komórkę w tkankach roślinnych i (ii) jak reguluje się podział chloroplastów w podziale komórki.,
Historia badań nad liczbą chloroplastów komórek osłonowych
GCS w naskórku pędu zazwyczaj zawierają chloroplasty i kontrolują wymianę gazową między mezofilem liściowym a atmosferą (Sachs, 1875; Taiz et al., 2015; zob. rys. 1a). Pierwsze badanie liczby chloroplastów GC w liściach przeprowadzono ponad sto lat temu w naturalnie uprawianych roślinach Drosera (Macfarlane, 1898)., Badanie to wykazało, że podobnie jak inne cechy strukturalne roślin i komórek, liczba chloroplastów GC na komórkę w domniemanym hybrydzie pochodzącym z krzyżówki Drosera filiformis i Drosera intermedia była pośrednia między dwoma gatunkami, co sugeruje, że liczba chloroplastów GC może być wykorzystana do określenia genetycznego składu rośliny. Następnie odnotowano istotne obserwacje dotyczące różnic w liczbie chloroplastów GC wśród gatunków roślin (Sakisaka, 1929) i stosunkowo stabilnej liczby chloroplastów w GCs w naskórku liści morwy (Morus spp.,; Hamada i Baba, 1930) oraz w dojrzałych liściach kilku gatunków kapustnych (Iura, 1934). Ponadto analiza roślin buraka cukrowego (Beta vulgaris) wykazała, że liczba chloroplastów GC w liściach jest dodatnio skorelowana z poziomem ploidy jądrowej roślin (Mochizuki i Sueoka, 1955). Następnie przeprowadzono bardziej dogłębne i kompleksowe analizy z wykorzystaniem różnych próbek roślinnych w celu zbadania związku liczby chloroplastów i wielkości jamy ustnej z poziomem ploidy (np. Frandsen, 1968)., Mochizuki i Sueoka, 1955; Frandsen, 1968), ujawniając, że średnia liczba chloroplastów GC w liściach lub liścieniach u około 80 gatunków, wariantów lub mieszańców wynosiła od 2,8 do 40,0 w diploidach (2×) i 5,0 do 73,5 w tetraploidach (2×).4×). Ponadto, zdarzenia powielania całego genomu w roślinach (to znaczy, 1× do 2×, 2× do 4×, itp.) spowodował ok.,7-krotny wzrost liczby chloroplastów GC o wysokiej wierności (recenzja w Butterfass, 1973). Wyniki te zachęcały do badań poziomu ploidów w różnych tkankach i roślinach uzyskanych za pomocą hodowli tkankowej, krzyżowania lub naturalnej uprawy, w połączeniu z chemicznymi (np. kolchicyna) lub radioterapii (np. Jacobs and Yoder, 1989; Singsit and Veilleux, 1991; Qin and Rotino, 1995)., Podczas gdy liczba chloroplastów GC była badana w biologii jamy ustnej (Lawson, 2009) i cytologii w celu zrozumienia namnażania chloroplastów( Butterfass, 1979; patrz poniżej), w dużej mierze służyła jako niezawodny i wygodny marker do wykrywania mieszańców, gatunków i wariantów oraz do szacowania ploidalnych poziomów docelowych tkanek roślinnych.
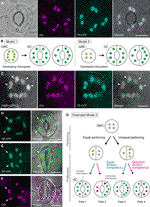
Rysunek 1 uproszczone modele i dowody mikroskopowe do kontroli liczby chloroplastów w komórkach Stomat guard (GCs)., A) typowa stoma (para GC) w naskórku osiowym ostrza liści Arabidopsis wyrażająca ukierunkowaną na stomę fuzję peptydu tranzytowego (TP) z białkiem fluorescencyjnym cyjanowym (CFP; TP-CFP). B) dwa modele oznaczania liczby chloroplastów w GCs, obejmujące zarówno podział chloroplastów (model 1), jak i proliferację i podział chloroplastów (model 2) podczas rozwoju GC z komórek macierzystych straży (GMCs). C) para GC w naskórku osiowym ogonka liściowego Arabidopsis wyrażająca TP-CFP i FtsZ1 połączone z Zielonym białkiem fluorescencyjnym (GFP; FtsZ1-GFP)., (D–F) pary GC w naskórku osiowym ostrza liści Arabidopsis z (D, E) lub bez (F) ekspresją TP połączoną z żółtym białkiem fluorescencyjnym (YFP; TP-YFP). F) jako marker chloroplastu zastosowano Autofluorescencję chlorofilu (Chl)., G) rozszerzony model 2, przedstawiający udział równego i nierównego podziału chloroplastów w wyniku podziału GMC i późniejszego podziału chloroplastów GC z równą (linia niebieska) lub selektywną (linia czerwona) kompetencją podziału, co skutkowałoby czterema typami oznaczania liczby chloroplastów (losy 1-4) podczas późnego rozwoju liści Arabidopsis. (A, C–F) mikroskopię Epifluorescencyjną przeprowadzono za pomocą odwróconego mikroskopu Olympus Ix71 z wykorzystaniem materiałów roślinnych, jak wcześniej opisano (Fujiwara et al., 2017, Fujiwara et al., 2018)., Sygnały fluorescencyjne chlorofilu, CFP, GFP i YFP są pseudokolorowe odpowiednio w magenta, cyjan, Zielony (tylko w połączonym obrazie)i zielony. Oznaczenia w panelach są następujące: grot strzałkowy, pierścień FtsZ1; strzałka, powiększony chloroplast GC; linia przerywana, kształt komórki. Bar podziałki = 10 µm.
zastosowanie komórek osłonowych liści do analizy kontroli liczby chloroplastów
komórki mezofilowe liści są od dawna wykorzystywane jako podstawowy model do analizy liczby chloroplastów., Chociaż mają one zalety w badaniu wpływu warunków środowiskowych na podział chloroplastów (np. sygnalizacja świetlna cytokininy; Boasson and Laetsch, 1969; Possingham and Lawrence, 1983; Okazaki et al., 2009; Chiang et al., 2012), są one pod pewnymi względami ograniczone. Po pierwsze, komórki mezofilu liści różnią się wielkością i kształtem i są rozmieszczone głęboko w liściu, co utrudnia manipulowanie nienaruszonymi tkankami., Po drugie, podatność proliferacji chloroplastów mezofilu liściowego na stres środowiskowy i warunki wzrostu roślin może zapobiec wiarygodnym porównaniom między badaniami. Liczba chloroplastów liścia na komórkę w Ekotypie Arabidopsis Columbia (Col) była różnie opisywana jako 76 (Kinsman and Pyke, 1998), 80-100 (Stokes et al., 2000), 70 (Tirlapur and König, 2001), 41 (Yoder et al., 2007), 40-60 (Okazaki et al., 2009), oraz 30-40 (Kawade et al., 2013)., Co więcej, ocena udziału podziału chloroplastów w końcowej liczbie chloroplastów w komórce mezofilu podczas rozwoju liści jest prawie niemożliwa, chociaż uważa się, że zależy to od równowagi między szybkością podziału komórek a szybkością podziału chloroplastów. Aby odkryć mechanizm kontroli liczby chloroplastów w komórkach liści wegetatywnych, wymagany jest modelowy system, który przezwycięży powyższe problemy.
, GCs są bardzo jednolite pod względem wielkości i kształtu w obrębie tkanki, a ich rozproszone, ale gęste rozmieszczenie w zewnętrznej warstwie pędów ułatwia ich wykrywanie za pomocą mikroskopii świetlnej i fluorescencyjnej. GCs pochodzą również z komórek protodermalnych w merystemie pędu lub z embrionalnych komórek naskórka, a ich sekwencja rozwojowa poprzez merystemoidy (prekursor stomatologiczny z aktywnością merystematyczną) i komórki macierzyste straży (GMCs; prekursor par GC) jest ustalona szczegółowo (Zhao and Sack, 1999; Nadeau and Sack, 2002; Kalve et al., 2014)., Późny rozwój jamy ustnej obejmuje pojedynczą rundę symetrycznego podziału GMC, co umożliwia ocenę rozkładu chloroplastów i podziału przed i po cytokinezie. Z punktu widzenia praktycznych eksperymentów, Leaf GCs nadają się do mikroskopii. Wcześniej wykazano, że liczba chloroplastów na komórkę w GCs liści Sinapis alba była mniej dotknięta różnymi warunkami świetlnymi niż w komórkach mezofilu liściowego (Wild and Wolf, 1980)., Ponadto różnica w liczbie chloroplastów GC w ogonkach liściowych jest stosunkowo niewielka wśród trzech Ekotypów Arabidopsis Col, Ler i WS (Fujiwara et al., 2018). Ponadto endoreduplikacja, która wpływa na rozwój komórek mezofilu liściowego, bruku i trichomu, nie została wykryta w liściach Arabidopsis GCS (Melaragno et al., 1993), który zapewniłby interpretację danych o liczbie chloroplastów na poziomie 2C komórek., Łącznie raporty te sugerują, że Leaf GCs są potencjalnie doskonałym modelem do systematycznej analizy dynamiki liczby chloroplastów w określonej linii komórkowej.
Arabidopsis Leaf Guard Cells as a Model for Studying the Control of Chloroplast Number
w historii badań nad chloroplastami GC, liczenie chloroplastów na poziomie stomatalnym (GC pair) pełniło równie ważną rolę w określaniu liczby chloroplastów, jak liczenie na indywidualnym poziomie GC. Obie metody dają tę samą średnią liczbę chloroplastów (Butterfass, 1973)., Gdy przedmiotem zainteresowania jest zmienność rozkładu chloroplastów w sparowanym GCs i jego mechanizm leżący u podstaw, istotne są szczegółowe informacje o chloroplastach na poziomie poszczególnych komórek, tj. ich wielkości, kształtu i lokalizacji wewnątrzkomórkowej. Chloroplast (plastid) proliferacja podczas różnicowania GMC-GC była wcześniej badana w kilku gatunkach roślin (Butterfass, 1973, Butterfass 1979)., W badaniach tych zaproponowano dwa modele określania końcowej liczby chloroplastów w GCs u różnych gatunków roślin( rysunek 1B): jeden (model 1; buraki cukrowe) obejmuje tylko podział chloroplastów w podziale GMC, a drugi obejmuje nie tylko podział chloroplastów, ale także proliferację chloroplastów podczas rozwoju GC.
w dobie genetyki molekularnej, genomiki, obrazowania komórek i innych analiz interdyscyplinarnych istnieje wiele możliwości dalszej charakterystyki mechanizmu podziału chloroplastów., Arabidopsis leaf GCs może być jednym z najlepszych systemów modelowych do tego celu. Kilka badań zbadało liczbę chloroplastów GC w liściach lub liścieniach Arabidopsis (Hoffmann, 1968; Pyke and Leech, 1994; Pyke et al., 1994; Robertson et al., 1995; Keech et al., 2007; Chen et al., 2009; Yu i in., 2009; Higaki et al., 2012; Fujiwara i in., 2018). Te GCs wykazują skromną liczbę chloroplastów, średnio od 3,5 do 5,5. Do tej pory nie badano zmian w liczbie chloroplastów (plastid) podczas rozwoju jamy ustnej., Jednak mikroskopowe dowody z analiz rozwoju jamy ustnej (np. Zhao and Sack, 1999; Hachez et al., 2011), a nasze wstępne obserwacje wskazują, że GMCs może zawierać mniejszą liczbę rozwijających się chloroplastów niż GCS i że proliferacja chloroplastów może wystąpić podczas różnicowania GC. Aby to przetestować, tworzenie chloroplastów podział maszyny W GCs monitorowano z sondy ftsz1 stapiane z Zielonym białkiem fluorescencyjnym (Ftsz1-GFP) (Fujiwara et al., 2008)., Transgeniczna linia, jednocześnie wyrażając peptyd tranzyt (TP)-fused CFP i FtsZ1-GFP do wizualizacji stroma i ftsz1 pierścień, odpowiednio, zbadano mikroskopii epifluorescencji (Fujiwara et al., 2017). Stosowano powiększające się ogonki liściowe (piąte liście 4-tygodniowych sadzonek). W rezultacie wykryto GCs z symetrycznie zwężającymi się chloroplastami (ryc. 1C). Te chloroplasty tworzyły pierścień ftsz1, chloroplastowy pierścień podziału na powierzchni stromalnej wewnętrznej błony otoczki w komórkach mezofilu liściowego i bruku (Vitha et al., 2001; Fujiwara et al.,, 2008), w miejscu zwężenia równikowego. Zgodny ze wzorem stomatologicznym w rozwoju liści Arabidopsis (Donnelly et al., 1999; Andriankaja i in., 2012), chloroplasty dzielące wykryto w późnym, jak i wczesnym stadium ekspansji liści. Tak więc model 2 jest najprawdopodobniej najlepiej pasujący do liści Arabidopsis GCS.
zależność między proliferacją i ekspansją chloroplastów w komórkach osłonowych liści Arabidopsis
ponadto, nieoczekiwany fenotyp morfogenezy chloroplastów GC zaobserwowano w dojrzałych GCs (ryc. 1D, E)., Kiedy peelingi naskórkowe w pełni rozszerzonych liści (trzeci-czwarty ostrza liści 4-tygodniowych sadzonek) z linii TP-fused Yellow fluorescencyjne proteiny (YFP) zostały mikroskopowo scharakteryzowane (linia FL6-5; Fujiwara et al., 2018), niektóre aparaty szparkowe wykazywały nierówne wzorce rozkładu chloroplastów w parach GC, podczas gdy większość aparatów szparkowych wykazywała równe lub podobne wzorce rozkładu chloroplastów (Robertson et al., 1995; Fujiwara et al., 2018)., W obrębie pary GC stomii rozmiar chloroplastów w GC zawierających mniejszą liczbę chloroplastów był większy niż w innych GCs w parze zawierającej większą liczbę chloroplastów(rysunki 1D, E). W ten sposób GCs prawdopodobnie utrzymuje całkowitą objętość chloroplastu na komórkę na stałym poziomie podczas wzrostu komórki. Powiększone chloroplasty reprezentowały fenotyp końcowy i nie mogły już dzielić się na rozszerzone liście. Wyniki te zostały potwierdzone w kilku niezależnych eksperymentach, niezależnie od ekspresji TP-fused fluorescencyjnego białka do znakowania stroma (rysunek 1F).,
Ten fenotyp chloroplastu GC jest interpretowany jako mechanizm kompensacji ekspansji chloroplastów, który został dobrze udokumentowany w komórkach mezofilu liściowego wadliwych w kontroli podziału chloroplastów (Pyke and Leech, 1994; Pyke et al., 1994). Do tej pory tylko jedno badanie (Ellis and Leech, 1985) wykazało ujemną korelację między liczbą chloroplastów a wielkością chloroplastów w komórkach mezofilu liściowego pszenicy, podczas gdy wiele badań wykazało dodatnią korelację między objętością komórek a liczbą chloroplastów w normalnych komórkach mezofilu liściowego (Leech and Pyke, 1988; Pyke, 1997)., Podczas gdy nierównowaga w liczbie chloroplastów GC występuje przy niskiej częstotliwości (Fujiwara et al., 2018), heterogeniczność chloroplastów w parach GC wskazuje, że nierówne dzielenie chloroplastów może wywołać różnicowy wzrost chloroplastów między dzikimi komórkami liściowymi u Arabidopsis, pomimo symetrycznego podziału komórek.
efekt kompensacji chloroplastów w GCs może być mniej rygorystyczny niż w komórkach mezofilu liściowego., GCs może być w stanie wytrzymać niedobór lub całkowitą utratę całkowitej objętości chloroplastu na komórkę w poważnie upośledzonych mutantów podziału chloroplastów, takich jak Arabidopsis arc6 i atminE1 i tomato suffulta, podczas gdy wiele zmutowanych GCS wykazało zmniejszoną liczbę chloroplastów i powiększony rozmiar chloroplastu podobnie do komórek mezofilu liściowego (Robertson et al., 1995; Forth and Pyke, 2006; Chen et al., 2009; Fujiwara et al., 2018)., W późnym podziale chloroplastów, arc5, zmniejszenie liczby chloroplastów GC nie wiązało się ze znaczącym wzrostem wielkości chloroplastów, w przeciwieństwie do komórek mezofilu liściowego (Pyke and Leech, 1994). Niższy stopień ekspansji chloroplastów w GCs niż w komórkach mezofilowych (Pyke and Leech, 1994; Barton et al., 2016), a zmiany w ekspansji chloroplastów wśród GCs, mogą leżeć u podstaw tak szerokiego dopuszczalnego zakresu całkowitej objętości chloroplastów na GC., Ponadto czas podziału chloroplastów podczas różnicowania GMC-GC może znacząco wpłynąć na końcowy fenotyp chloroplastu GC. Chociaż dalsza szczegółowa charakterystyka jest wymagana do rozwiązania tego problemu, wydaje się prawdopodobne, że Arabidopsis leaf GCs reprezentuje system do zbadania niewykorzystanych aspektów kontroli liczby chloroplastów w komórkach roślinnych.,
Model roboczy do oznaczania liczby chloroplastów w komórkach osłonowych liści Arabidopsis
na podstawie powyższego proponujemy model roboczy (rozszerzony model 2) do analizy liczby chloroplastów w GCs (rysunek 1G). Ostateczna liczba chloroplastów na GC jest określana przez podział chloroplastów w podziale GMC i proliferację chloroplastów w GCs. Podczas podziału GMC chloroplasty mogą ulegać podziałowi równemu lub nierównemu. Podczas proliferacji chloroplastów, chloroplasty GC będą się namnażać z podziałem równym (linia niebieska) lub selektywnym (linia magenta)., Na przykład, jeśli jednakowo podzielone chloroplasty posiadają równoważną kompetencję podziału, to w parze GC (Fate 1) zachodzą równe liczby chloroplastów. Jeśli chloroplasty nierównomiernie podzielone posiadają równoważną zdolność podziału, chloroplasty zwiększają się w tym samym tempie w obrębie pary GC (Fate 3). Jeśli w GCs nastąpi selektywny podział chloroplastów, równowaga liczby chloroplastów w parze GC zmieni się po podziale GMC (losy 2 i 4)., Obecnie trudno jest znaleźć poparcie dla „selektywnego podziału chloroplastów”, ale jeśli losy 1 i 4 faktycznie przeważają w GCs, to mogą posiadać mechanizm kontrolujący całkowitą objętość chloroplastów na komórkę, jak w komórkach mezofilu liściowego. Model ten porusza dwie kwestie: (i) czy chloroplasty GC są właściwie podzielone na komórki potomne i jak je podzielić? Oraz (ii) czy podział chloroplastów GC jest koordynowany?,
w odniesieniu do kwestii (i), czy dziedziczenie chloroplastów następuje przez losowy rozkład wielu chloroplastów w cytoplazmie lub przez pozytywny mechanizm podziału chloroplastów(s) było długotrwałym problemem (Butterfass, 1969; Birky, 1983; Hennis and Birky, 1984; Nebenführ, 2007; Sheahan et al., 2016). Co ciekawe, u Arabidopsis arc6, liść lub liścień GCs mają od zera do trzech chloroplastów, a w niedoborze chloroplastów GCS, nie-fotosyntetyczne plastidy nadal istnieją w formach pęcherzykowych do wydłużonych (Robertson et al., 1995; Chen et al., 2009; Fujiwara et al., 2018)., W arc6 nie znaleziono GCs pozbawionych plastydów per se i nie ma na to wyjaśnienia, pomimo zakłócenia aparatu podziału chloroplastów (Vitha et al., 2003). W związku z tym ważne będzie zbadanie replikacji i morfologii chloroplastów arc6 w badaniach rodowodu jamy ustnej. Badania mutantów Arabidopsis mogą również dać inną wskazówkę na ten problem., Obserwacja, że 18% liścieni GCs w zmięty leaf (crl) Mutant zawiera żadnych struktur plastydowych w cytoplazmie, podczas gdy 100% komórek mezofilu liści zawiera jeden do czterech powiększonych chloroplastów (Asano et al., 2004; Chen et al., 2009), ma ogromne znaczenie. CRL jest chloroplastowym białkiem otoczkowym o nieznanej funkcji. Zrozumienie funkcji białka CRL może zapewnić wgląd w mechanizm(y) podziału chloroplastów., Analiza proliferacji i podziału chloroplastów w komórkach mezofilu liściowego w mutantach łukowych Arabidopsis i innych liniach transgenicznych promowała badania nad proliferacją i podziałami plastydów nie-mezofilowych. Podobnie wyniki uzyskane w GCs mogą być przenoszone do innych systemów komórkowych.
Uwaga końcowa
model GC otwiera wiele perspektyw dla rozwoju biologii chloroplastów. Na przykład, podczas gdy układy cytoszkieletowe są znane z regulacji morfologii chloroplastów, ruchu i podziału (Sheahan et al.,, 2016; wada, 2016; Erickson and Schattat, 2018), rola każdego genu regulacyjnego w proliferacji chloroplastów i partycjonowaniu w roślinach nie spotkała się z dużym zainteresowaniem. Z drugiej strony, gdy staje się możliwe do upośledzenia liczby chloroplastów GC lub morfologii poprzez różne strategie eksperymentalne, nowe spostrzeżenia w kontroli molekularnej morfogenezy chloroplastów w komórkach rodowodu jamy ustnej mogą być dostarczone. Dodatkowo, w połączeniu z ilościowymi analizami liczby chloroplastów podczas rozwoju jamy ustnej, modelowanie matematyczne może zaoferować nową drogę dla tych badań., W artykule przedstawiono aktualną wiedzę na temat sposobu kontrolowania liczby chloroplastów GC i podkreślono potencjalną przydatność GCS liści Arabidopsis do zrozumienia proliferacji i podziału chloroplastów.
Oświadczenie o dostępności danych
wszystkie zbiory danych dla tego badania są zawarte w artykule / materiale uzupełniającym.
wkład autora
MF MF I AS przeprowadziły eksperymenty. Analizy przeprowadziły AS I RI. Wszyscy autorzy przeczytali i zatwierdzili ostateczny manuskrypt.,
finansowanie
prace te zostały wsparte przez Ministerstwo Edukacji, Kultury, Nauki i technologii Japonii w ramach projektu KAKENHI (grant nr 19K05831 dla MF i 18k06314 dla RI).
konflikt interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
autorzy dziękują Dr Nobuyuki Kanzawa (Sophia University) za porady dotyczące pracy.
, The partitioning of cytoplasmic organelles at cell division. Int. REV. Cytol.15, 49-86.
Google Scholar
beczka oleju, T. (1969). Dystrybucja plastydów w mitozie komórek zamkowych haploidalnej koniczyny Szwedzkiej (Trifolium hybridum L.). Planta 84, 230-234. doi: 10.1007/BF00388108
PubMed Abstract | CrossRef Full Text/Google Scholar
beczka oleju, T. (1973). Control of plastid division by means of nuclear DNA amount. Protoplazma 76, 167-195. doi: 10.,1007/BF01280696
CrossRef Full Text | Google Scholar
Qin, X., Rotino, G. L. (1995). Chloroplast number in guard cells as ploidy indicator of in vitro-grown androgenic pepper plantlets. Plant Cell Tissue Organ Cult. 41, 145–149. doi: 10.1007/BF00051583
CrossRef Full Text | Google Scholar
Sachs, J. (1875). Textbook of Botany. Oxford: Clarendon Press.
Google Scholar
Thomas, M. R., Rose, R. J. (1983)., Liczba plastydów i zmiany strukturalne plastydów związane z kulturą protoplastów mezofilu tytoniowego i regeneracją roślin. Planta 158, 329-338 doi: 10.1007 / BF00397335
PubMed Abstract | CrossRef Full Text | Google Scholar
Tirlapur, U. K., König, K. (2001). Femtosekundowe lasery bliskiej podczerwieni jako nowatorskie narzędzie do nieinwazyjnego obrazowania poklatkowego podziału chloroplastów w żywych komórkach osłonki pęczka Arabidopsis w czasie rzeczywistym o wysokiej rozdzielczości. Planta 214, 1-10. doi: 10.,1007/s004250100597
PubMed Abstract | CrossRef Full Text/Google Scholar
Wild, A., Wolf, G. (1980). Wpływ różnych intensywności światła na częstotliwość i wielkość aparatów szparkowych, wielkość komórek, liczbę, wielkość i zawartość chloroplastów w mezofilu i komórkach opiekuńczych podczas ontogenezy liści pierwotnych Sinapis alba. Z. Pflanzenphysiol. Bd. 97, 325–342. doi: 10.1016/S0044-328x(80)80006-7
CrossRef Full Text/Google Scholar
















Dodaj komentarz