Zarządzanie matczynej alloimmunizacji
z reguły, seryjne miana przeciwciał matczynych są monitorowane aż do krytycznego miana 1:32, co wskazuje, że wysokie ryzyko hydrops płodu został osiągnięty. W tym momencie płód wymaga bardzo intensywnego monitorowania objawów niedokrwistości i hydropsów płodu., W Kell alloimmunizacji, hydrops może występować przy niskich miana matki z powodu tłumionej erytropoezy, i, tak, miana 1: 8 został zasugerowany jako krytyczny. Stąd wartości delta-od 450 są również niewiarygodne w przewidywaniu nasilenia choroby w Kell alloimmunizacji.
miana matki nie są przydatne w przewidywaniu wystąpienia niedokrwistości płodu po pierwszej dotkniętej ciąży. Duże różnice w mianie można zaobserwować u tego samego pacjenta między różnymi laboratoriami, a nowsza technika żelu daje wyższe wyniki miana niż starsza metoda rurki., W związku z tym do określenia miana krytycznego należy zastosować standardową metodologię probówki, a zmiana o więcej niż 1 rozcieńczenie oznacza prawdziwy wzrost miana przeciwciał matczynych. Dla wszystkich przeciwciał odpowiedzialnych za chorobę hemolityczną noworodka (HDN), 4-krotne zwiększenie miana przeciwciał jest zazwyczaj uważane za znaczącą zmianę, która wymaga oceny płodu.
jeśli wskazane, amniopunkcję można wykonać już w 15.tygodniu ciąży (rzadko konieczne w pierwszej zakażonej ciąży przed 24. tygodniem ciąży) w celu określenia genotypu płodu i oceny ciężkości., Próbki krwi matki i ojca należy przesłać do laboratorium referencyjnego z próbką płynu owodniowego w celu wyeliminowania wyników fałszywie dodatnich (z genu pseudogenu matki lub Ccde) i fałszywie ujemnych (z przegrupowania w locus genu RHD u ojca).
oznaczanie genotypu Rh w osoczu matki stało się rutynowe w wielu krajach europejskich i jest oferowane w Stanach Zjednoczonych., DNA wolne od komórek płodu stanowi 3% całkowitego krążącego DNA osocza matki, znajduje się już w 38 dniu ciąży i pochodzi z apoptozy warstwy cytotropowej łożyska. Średni okres półtrwania krążącego DNA płodu wynosi średnio mniej niż 30 minut, a osocze matki jest poddawane filtracji i mikrocentryfugacji w celu usunięcia wszystkich elementów komórkowych przed badaniem. Eliminuje to fałszywie dodatnie wyniki z wszczepionych komórek płodowych poprzednich ciąż w narządach limfatycznych matki.,
wolne od komórek DNA płodu poddawane jest reakcji łańcuchowej polimerazy w czasie rzeczywistym (PCR) na obecność sekwencji specyficznych dla genu RHD i stwierdzono, że jest dokładne w 99,5% przypadków. Gen SRY (u płodu męskiego) i polimorfizmy DNA w populacji ogólnej (u płodu żeńskiego) są stosowane jako kontrola wewnętrzna w celu potwierdzenia pochodzenia płodowego wolnego od komórek DNA. Porównano 92 polimorfizmy jednonukleotydowe (SNP) pomiędzy próbką matki z powłoki buffy i osocza., Różnica ponad 6 SNP potwierdza obecność DNA płodu i ważność testu u płodu żeńskiego. Wyniki fałszywie ujemne są najbardziej niepożądane i następcze ze względu na częściowe lub słabe fenotypy D. Są one wykrywane przy użyciu co najmniej dwóch specyficznych dla RHD egzonów i uruchamiane w duplikatach.
na szczęście badania DNA płodu bez komórek w celu określenia genotypu dla innych antygenów czerwonych krwinek, takich jak c,C, e, E i Kell, również okazały się wysoce wiarygodne i dokładne.,
seryjna amniopunkcja rozpoczyna się w odstępach 10-14 dni w celu monitorowania ciężkości choroby u płodu. Należy podjąć wszelkie próby uniknięcia przeszczepu igły, co może prowadzić do krwotoku płodowego (FMH) i dalszego wzrostu miana przeciwciał. Szeregowe wartości delta-od 450 są wykreślane na wykresie Queenana lub rozszerzonym wykresie Lileya w celu oceny ryzyka wodopoju płodu. Wczesne ultrasonografia jest wykonywana w celu ustalenia prawidłowego wieku ciążowego., Częste monitorowanie ultrasonograficzne jest również wykonywane w celu oceny dobrego samopoczucia płodu i wykrycia umiarkowanej niedokrwistości i wczesnych objawów hydrops.
peak systolic middle cerebral artery (MCA) Doppler velocity okazał się niezawodnym narzędziem przesiewowym do wykrywania niedokrwistości płodu i zastąpił amniopunkcję. MCA jest łatwo wizualizowane za pomocą color-flow Doppler; pulsed Doppler jest następnie używany do pomiaru szczytowej prędkości skurczowej tylko dystalnej do jego rozwidlenia od tętnicy szyjnej wewnętrznej., Ponieważ prędkość MCA wzrasta wraz z postępującym wiekiem ciążowym, wynik jest zgłaszany w wielokrotności mediany (MOMs). W ostatnich badaniach wykazano, że czułość do wykrywania umiarkowanej i ciężkiej niedokrwistości płodu wynosi 100% , z fałszywie dodatnim wskaźnikiem 10% przy 1,5 MOM. Wykazano, że zmniejsza potrzebę inwazyjnych procedur diagnostycznych, takich jak amniopunkcja i kordocenteza o ponad 70%.
badania dopplerowskie MCA można rozpocząć już w 18.tygodniu ciąży, ale nie są one wiarygodne po 35. tygodniu ciąży., Był również używany do czasu późniejszej transfuzji płodu i diagnozowania niedokrwistości z wielu przyczyn, takich jak w transfuzji bliźniaczej. Nachylenie MCA z 3-tygodniowych odczytów jest teraz używany do przewidywania ryzyka płodu dla ciężkiej niedokrwistości(patrz obrazek poniżej).
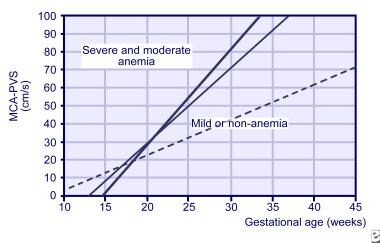 nachylenia dla szczytowej prędkości skurczowej w tętnicy środkowej mózgu (MCA) dla prawidłowych płodów (linia przerywana), łagodnie anemicznych płodów (cienka linia) i poważnie anemii płodów (gruba linia).,
nachylenia dla szczytowej prędkości skurczowej w tętnicy środkowej mózgu (MCA) dla prawidłowych płodów (linia przerywana), łagodnie anemicznych płodów (cienka linia) i poważnie anemii płodów (gruba linia)., dzięki nabyciu doświadczenia w prowadzeniu badania MCA dopplerowskiego w mniejszym stopniu zastosowano seryjną amniopunkcję do wykrywania niedokrwistości płodu.
w okresie, gdy jedyną metodą leczenia była wewnątrzmaciczna transfuzja otrzewnowa, noworodki były rutynowo poród w 32.tygodniu ciąży. Takie podejście spowodowało wysoką częstość występowania choroby błony szklistej i transfuzji wymiennych., Wraz z pojawieniem się transfuzji wewnątrznaczyniowej (IVT) w macicy, ogólne podejście do poważnie dotkniętego płodu jest wykonywanie IVT zgodnie z wymaganiami do 35 tygodnia ciąży, z porodem planowanym w terminie. Ustalenie dojrzałości płuc jest trudne w tych płodach z powodu zanieczyszczenia płynu owodniowego z resztkową krwią podczas transfuzji; jednak, jeśli poród jest planowany przed 34 tygodniem ciąży, wskazane jest podawanie steroidów matczynych w celu zwiększenia dojrzałości płuc płodu.,
ponadto nadmiar stężenia bilirubiny w płynie owodniowym powoduje fałszywe podniesienie depolaryzacji fluorescencyjnej TDX testu dojrzałości płodu w płucach, Wersja II (TDX-FLMII); w związku z tym należy stosować inne testy w celu określenia dojrzałości płodu w płucach, takie jak spektroskopia w podczerwieni, liczba ciał blaszkowych, ilość fosfatydyloglicerolu lub stosunek lecytyny/sfingomyeliny (L/S).
Liley po raz pierwszy opisał transfuzję dootrzewnową (IPT) w 1963 roku. Igła Tuohy jest wprowadzana do jamy otrzewnej płodu pod kierunkiem ultrasonograficznym., Cewnik zewnątrzoponowy jest gwintowany przez igłę. Radiopaque medium wstrzykuje się do otrzewnej płodu. Prawidłowe umiejscowienie jest potwierdzone przez wytyczenie poza jelitem lub pod przeponą lub przez dyfuzję w wodobrzuszu płodu.,ss niż 4-dniowe, grupa o, Rh-ujemne, Kell-ujemne, leukoreduced, napromieniowane 25 Gy w celu zapobiegania chorobie przeszczep przeciwko gospodarzowi i dopasowane krzyżowo z surowicą matki są wstrzykiwane w 10 mL alikwotów do objętości obliczonej według następującego wzoru:
objętość IPT = (ciąża w tygodniach-20) × 10 mLp
hemoglobina resztkowa (HB) u płodu jest oceniana w celu umożliwienia prawidłowego rozmieszczenia ipt i wyboru ciąży porodu według następującego wzoru:
HB g / dl = 0.,85/125 × A / b × 120-C/120
we wzorze a oznacza ilość przetoczonego Hb przez dawcę RBC, B jest szacowaną masą ciała płodu, a c jest odstępem w dniach od czasu przetoczenia do czasu oszacowania Hb przez dawcę.
IPT powtarza się, gdy szacuje się, że stężenie hemoglobiny u płodu zmniejszyło się do 10 g / dL. Zwykle drugi IPT jest wykonywany 10 dni po pierwszej transfuzji w celu podwyższenia stężenia hemoglobiny powyżej 10 g / dL. Następnie kolejna transfuzja jest wykonywana co 4 tygodnie do czasu planowanego porodu w 34-35 tygodniu ciąży., Ruchy przeponowe płodu są niezbędne w celu absorpcji RBC do wystąpienia. Takie podejście nie ma żadnej wartości dla umierającego płodu. Powikłania macierzyńskie obejmują infekcję i krwotok przezbłonowy, podczas gdy powikłania płodowe to przetransfuzja, wykrwawienie, tamponada serca, infekcja, poród przedwczesny i choroba przeszczep przeciwko gospodarzowi. Wskaźniki przeżycia po IPT zbliżyły się do około 75% za pomocą ultrasonografii.,
bezpośrednia IVT stała się preferowaną drogą interwencji płodu ze względu na większą częstość powikłań i ograniczoną skuteczność IPT u płodu hydropicznego. Rodeck po raz pierwszy z powodzeniem wykonał IVT w 1981 roku. Za pomocą wskazówek ultrasonograficznych igła o rozmiarze 20-22 jest wprowadzana do żyły pępowinowej przy wprowadzaniu sznura do łożyska lub do jego części wewnątrzwątrobowej i pobiera się próbkę krwi płodu. Próbka krwi jest potwierdzona jako pochodzenia płodowego przez szybki test denaturacji zasadowej., Wykonuje się wszystkie istotne badania płodu (np. grupa krwi, bezpośredni test przeciwciał, liczba retikulocytów, liczba płytek krwi, stężenie Hb, stężenie Hct, stężenie albumin w surowicy, stężenie erytropoetyny). Jeśli stężenie hemoglobiny jest mniejsze niż 11 g/dL lub jeśli stężenie Hct jest mniejsze niż 30%, rozpoczyna się IVT. Pozycja igły jest potwierdzona poprzez odnotowanie turbulencji w naczyniu płodu po wstrzyknięciu soli fizjologicznej. Płód jest często sparaliżowany pancuronium i podaje się fentanyl w dawce 10 µg / kg, aby zapobiec przemieszczeniu igły przez ruchy płodu., Leki dla matki różnią się od znieczulenia miejscowego, do rutynowej indometacyny i świadomej sedacji, do znieczulenia zewnątrzoponowego kręgosłupa.
transfuzję przeprowadza się w podwielokrotnościach 10 mL do objętości około 50 mL/kg szacowanej masy ciała przy użyciu ultrasonografii lub do osiągnięcia poziomu Hct 40%. Procedura jest natychmiast przerwana w przypadku stwierdzenia dekompensacji czynności serca na podstawie wyników badania ultrasonograficznego., Płody z ciężką niedokrwistością nie tolerują ostrej korekty Hct do wartości prawidłowych, a początkowa Hct nie powinna być zwiększana więcej niż 4-krotnie w czasie pierwszego IVT. Następnie należy je monitorować co 2-7 dni. IVT powtarza się, gdy osiągnie wartość, która odzwierciedla krytyczną niedokrwistość u płodu. Można spodziewać się utraty 1% przetoczonych komórek na dobę.
niektóre ośrodki wykonują powtarzające się transfuzje w odstępach 10 dni, 2 tygodni i co 3 tygodnie. Inne transfuzje oparte na przewidywanym spadku hemoglobiny płodu 0,4 g / dL / dzień, 0,3 g/dL / dzień i 0.,2 g / dL / dobę dla odpowiednio pierwszej, drugiej i trzeciej transfuzji. Szczytowa prędkość skurczowa MCA została wykorzystana do czasu drugiej transfuzji, z progiem 1,32 MOM. Po pierwszej transfuzji wewnątrzmacicznej obecność czerwonych krwinek z hemoglobiną dorosłych hamuje erytropoezę i poprawia dostarczanie tlenu, co jest odpowiedzialne za słabą korelację między prędkością szczytową MCA a nasileniem niedokrwistości płodu. Niektóre ośrodki odkryły korzystny wpływ skojarzonej transfuzji IVT i IPT na interwał do powtarzania transfuzji.,
oprócz powikłań związanych z IPT, podczas IVT zgłaszano przemijającą bradykardię płodu, krwiak rdzenia, ucisk żyły pępowinowej i zgon płodu. Jednak IVT ma wiele zalet, w tym natychmiastową korekcję niedokrwistości i rozdzielczość hydropów płodu, zmniejszoną szybkość hemolizy i późniejszej hiperinsulinemii oraz przyspieszenie wzrostu płodu dla płodów niehydropicznych, które często są opóźnione w rozwoju. IVT jest jedyną dostępną interwencją dla żuchwowych płodów wodnych i tych z łożyskiem przednim. Ryzyko utraty płodu wynosi około 0,8% W przypadku IVT vs 3.,5% na zabieg dla IPT, A całkowity wskaźnik przeżycia wynosi 88%.
ostatnio przemyte matczyne RBC były z powodzeniem stosowane jako źródło antygen-ujemnych RBC w przypadku rzadkiej niezgodności, ale również były rutynowo stosowane ze względu na korzyści, takie jak zmniejszone ryzyko uczulenia na nowe antygeny czerwonokrwinkowe, dłuższy okres półtrwania w obiegu jest świeży i zmniejszone ryzyko przenoszenia czynników wirusowych. Matka może przekazać jednostkę czerwonych krwinek po pierwszym trymestrze ciąży.,
w przypadku niedojrzałości płuc i delta-OD 450 w dotkniętej strefie krzywej Queenana, doustne podawanie 30 mg fenobarbitalu matce 3 razy dziennie, a następnie indukcja w ciągu jednego tygodnia, zmniejsza potrzebę transfuzji wymiennej u chorego noworodka. Doskonałe algorytmy postępowania w pierwszej ciąży i ciąży u matki z wcześniej dotkniętym płodem przedstawiono w recenzji autorstwa Moise (patrz zdjęcia poniżej).
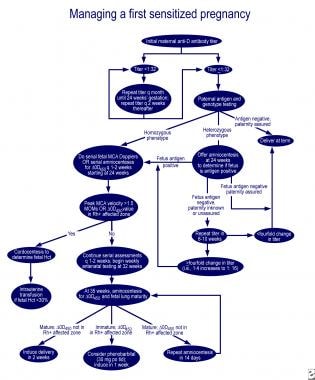 Postępowanie w pierwszej zakażonej ciąży.,
Postępowanie w pierwszej zakażonej ciąży., 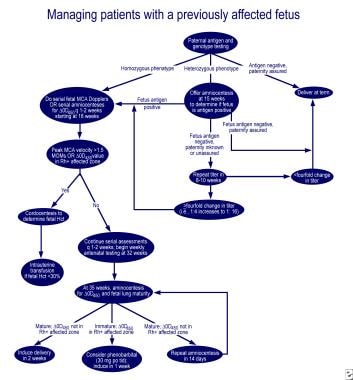 Postępowanie u kobiet w ciąży z wcześniej dotkniętym płodem.
Postępowanie u kobiet w ciąży z wcześniej dotkniętym płodem. początkowe próby zahamowania wytwarzania przeciwciał Rh za pomocą haptenu Rh, Rh-dodatniego fragmentu RBC i podania prometazyny zakończyły się niepowodzeniem. Rozległa plazmafereza z częściową wymianą przy użyciu 5% albumin (terapeutyczna wymiana osocza) i dożylnej immunoglobuliny (IVIG) lub podawanie IVIG w dawce 1 g/kg masy ciała tygodniowo okazało się umiarkowanie skuteczne., Mechanizm działania wydaje się być zablokowanie receptorów Fc w łożysku, zmniejszenie transportu przeciwciał przez płód, receptory Fc na fagocytach w układzie siateczkowo-śródbłonkowym płodu i hamowanie sprzężenia zwrotnego syntezy przeciwciał matczynych. Jednakże, cytotoksyczność zależna od przeciwciał i odbicie wzrost stężenia przeciwciał, zmiana przepływu krwi przez łożysko podczas zabiegu i krwotok poporodowy odnotowano po wymianie osocza.,
nowsze retrospektywne badanie obejmujące 5 ciężarnych kobiet z ciężką HDFN spowodowaną alloimmunizacją RBC wykazało skuteczne leczenie skojarzonym schematem terapeutycznej wymiany osocza, IVIG i transfuzji wewnątrzmacicznej (IUT) we wczesnym okresie ciąży. Kobiety poddano 3 zabiegom wymiany osocza w 10-13 tygodniu ciąży, po czym cotygodniowe wlewy dożylne; płody otrzymywały jednostki RBC, które w pełni odpowiadały fenotypowi matki z grupami antygenów D, C, E, K, Fy, Jk i S. Wszystkie kobiety urodziły zdrowe niemowlęta w 33-38 tygodniu ciąży.,
jednak techniki te tylko opóźniają konieczność pobierania próbek krwi pępowinowej (PUBS) i IVT do 20-22 tygodnia ciąży, kiedy procedury te mogą być wykonywane przy bardziej akceptowalnym ryzyku. Przegląd stosowania IVIG pokazuje jego przydatność w zapobieganiu pojawieniu się wodopłotów płodu i opóźnianiu potrzeby IUT., W związku z tym, w przypadku płodów zagrożonych przed 20 tygodniem ciąży sugerowano połączenie plazmaferezy, która rozpoczyna się w 12 tygodniu ciąży 3 razy w tym tygodniu, a następnie IVIG w dawce nasycającej 2 g/kg mc.po trzeciej plazmaferezie, a następnie kontynuuje IVIG 1 g/kg mc. do 20 tygodnia ciąży i może być również stosowany w późniejszym okresie ciąży, jeśli IVT nie może być wykonany lub jeśli hydrops nie reaguje na IVT.,
jeden raport wskazywał, że leczenie płodów z ciężką alloimmunizacją za pomocą IVT w połączeniu z leczeniem IVIG płodu w dawce 1 g/kg / dawkę rozpoczynającą się od trzeciego IVT pomogło w zmniejszeniu częstości IVT i poprawie objawów nawodnienia. Raport przypadku pokazuje udane leczenie ciężkiej niedokrwistości i hydropsów u płodu z alloimmunizacją spowodowaną przeciwciałem anty-m z dootrzewnowymi iniekcjami IVIG płodu 2 g/kg podawanymi co tydzień, począwszy od 30 tygodni. Jednak był to raport przypadku, a randomizowane kontrolowane badanie jest potrzebne, zanim stanie się to standardem opieki.,
podobne schematy testów i leczenia są stosowane w leczeniu ciąż dotkniętych alloimmunizacją nonRhD, takich jak anty-Rhc, anty-K (K1) i anty-M. gdy matka zostanie zdiagnozowana z przeciwciałem związanym z chorobą hemolityczną, pośredni mian Coombsa jest wykonywany, wraz z testami ojcowskimi na obecność antygenu i zygozakowatości. Miana matki są powtarzane (co miesiąc do 28 tygodnia ciąży, a następnie co 2 wk), aż do osiągnięcia progu anemii płodu (1:8 dla Kell i 1:32 dla odpoczynku).,
typowanie antygenu płodu odbywa się poprzez amniopunkcję lub wolne od komórek DNA płodu w osoczu matki, jeśli ojciec jest heterozygotyczny (100% dla K1, 65% Dla M). Gdy płód jest znany jako antygen dodatni, Nadzór na ciężką anemię płodu jest wykonywana, z cotygodniowym MCA badania dopplerowskie już 16-18 tygodni i IUT jest przeprowadzana, jeśli przekracza 1,5 mama z dostawą przez 38 tygodni ciąży.
wykazano, że Alloantybody matki wobec leukocytów ojca powodują blokadę Fc i zmniejszają nasilenie niedokrwistości hemolitycznej płodu., Może to być wykorzystane w przyszłości.
Postępowanie z uczulonym noworodkiem
łagodna choroba hemolityczna stanowi 50% noworodków z dodatnimi wynikami bezpośrednich testów na obecność przeciwciał. Większość z tych noworodków nie ma anemii (hemoglobina Kordowa >14 g/dL) i ma minimalną hemolizę (bilirubina Kordowa < 4 mg / dL). Poza wczesną fototerapią nie wymagają transfuzji. Jednak te noworodki są narażone na ryzyko rozwoju ciężkiej późnej niedokrwistości przez 3-6 tygodni życia. Dlatego ważne jest monitorowanie stężenia hemoglobiny po wypisie ze szpitala.,
umiarkowana choroba hemolityczna stanowi około 25% chorych noworodków. Umiarkowana choroba hemolityczna noworodka charakteryzuje się umiarkowaną niedokrwistością i zwiększonym poziomem bilirubiny rdzenia. U tych niemowląt nie występuje klinicznie żółtaczka po urodzeniu, ale szybko rozwija się niezwiązana hiperbilirubinemia w ciągu pierwszych 24 godzin życia. Rozmaz obwodowy wykazuje liczne jądra RBC, zmniejszenie liczby płytek krwi, a czasami dużą liczbę niedojrzałych granulocytów., Noworodki te często mają hepatosplenomegalię i są narażone na ryzyko rozwoju encefalopatii bilirubinowej bez odpowiedniego leczenia. Zwykle wymagana jest wczesna transfuzja wymienna z Rh-ujemnymi świeżymi RBC typu O z intensywną fototerapią. Stosowanie IVIG w dawkach 0,5-1 g/kg mc. w schemacie dawkowania pojedynczego lub wielokrotnego skutecznie zmniejszyło potrzebę transfuzji wymiennej.,
prospektywne, randomizowane, kontrolowane badanie wykazało wczesne stosowanie dużej dawki IVIG 1 g / kg w wieku 12 godzin w celu skrócenia czasu trwania fototerapii i pobytu w szpitalu oraz zapobiegania transfuzji wymiennej u noworodków z umiarkowaną do ciężkiej Izoimmunizacją Rh. Noworodki te są również narażone na ryzyko rozwoju późnej niedokrwistości hiporegeneracyjnej w okresie niemowlęcym w 4-6 tygodniu życia. Jednak jedno randomizowane badanie z podwójnie ślepą próbą kontrolowane placebo nie wykazało korzyści z profilaktycznego leczenia IVIG 0.,75 g / kg w ciągu 4 godzin od osiągnięcia wieku u noworodków dotkniętych ciężką chorobą, którzy byli leczeni transfuzją wewnątrzmaciczną w celu izoimmunizacji Rh.
ciężka choroba hemolityczna stanowi pozostałe 25% noworodków alloimmunizowanych, którzy są albo martwe lub hydropic po urodzeniu. Hydrops płodu jest głównie spowodowane zespołem przesiąkania naczyń włosowatych z powodu niedotlenienia tkanek, hipoalbuminemii wtórnej do zaburzeń czynności wątroby i wysokiej wydajności niewydolności serca z powodu niedokrwistości., Około połowa tych płodów staje się hydropiczna przed 34 tygodniem ciąży i wymaga intensywnego monitorowania i zarządzania ciąży alloimmunizowanej, jak opisano wcześniej. Łagodne wodobrzusze z udziałem wodobrzusza odwraca się z IVTs tylko w 88% przypadków z lepszym przeżyciem, ale ciężkie wodobrzusze powodujące obrzęk skóry głowy i ciężkie wodobrzusze i wysięki opłucnowe odwracają się w 39% przypadków i są związane ze słabym przeżyciem.
Postępowanie w przypadku niezgodności ABO
Postępowanie w przypadku hiperbilirubinemii jest poważnym problemem u noworodków z niezgodnością ABO., Kryteria transfuzji wymiennej i fototerapii są podobne do tych stosowanych w alloimmunizacji Rh. IVIG był również bardzo skuteczny, gdy był podawany na początku kursu. Wykazano, że cyna (Sn) porfiryna, silny inhibitor oksygenazy hemu, enzymu katalizującego etap ograniczania szybkości wytwarzania bilirubiny z hemu, zmniejsza wytwarzanie bilirubiny i zmniejsza potrzebę transfuzji wymiennej i czas trwania fototerapii u noworodków z niekompatybilnością ABO.
u noworodków badano protoporfirynę lub mezoporfirynę cyny lub cynku., Muszą być podawane domięśniowo w dawce zależnej od masy ciała, a ich skuteczność wydaje się zależna od dawki we wszystkich ciążach. Ich możliwe działania toksyczne obejmują fotouczulenie skóry, niedobór żelaza i możliwe zahamowanie produkcji tlenku węgla. Ich stosowanie w chorobie hemolitycznej RH noworodka nie odnotowano. Ich rutynowe stosowanie nie jest jeszcze zalecane ze względu na brak długoterminowych danych dotyczących bezpieczeństwa.
















Dodaj komentarz