denk aan wat er halverwege de kleurverandering gebeurt. Op dit punt zijn de concentraties van het zuur en zijn ion gelijk. In dat geval, zullen ze opheffen van de vriendelijke uitdrukking.
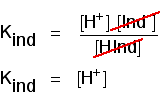
u kunt dit gebruiken om uit te zoeken wat de pH is op dit halve punt., Als u de laatste vergelijking zo rangschikt dat de waterstofionenconcentratie zich aan de linkerkant bevindt en vervolgens converteert naar pH en pKind, krijgt u:
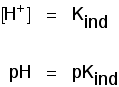
dat betekent dat het eindpunt van de indicator volledig afhangt van wat de pKind-waarde is. Voor de indicatoren die we hierboven hebben bekeken, zijn deze:
| indicator | pKind |
|---|---|
| lakmoes | 6.5 | methyl orange | 3,7 |
| fenolftaleïne | 9.,3 |
het pH-bereik van indicatoren
indicatoren verandert niet scherp bij een bepaalde pH (gegeven door hun pKind). In plaats daarvan veranderen ze over een smal bereik van pH.
neem aan dat het evenwicht stevig aan één kant staat, maar nu voeg je iets toe om het te verschuiven. Naarmate het evenwicht verschuift, zul je meer en meer van de tweede kleur gevormd krijgen, en op een gegeven moment zal het oog beginnen om het te detecteren.
bijvoorbeeld, stel dat je methyloranje in een alkalische oplossing hebt, zodat de dominante kleur geel is., Begin nu zuur toe te voegen zodat het evenwicht begint te verschuiven.
op een gegeven moment zal er genoeg van de rode vorm van de methyloranje aanwezig zijn dat de oplossing een oranje tint begint aan te nemen. Naarmate je meer zuur toevoegt, zal het rood uiteindelijk zo dominant worden dat je geen geel kan zien.
Er is een geleidelijke, gladde verandering van de ene kleur naar de andere, die plaatsvindt over een pH-bereik. als een ruwe “vuistregel” vindt de zichtbare verandering plaats ongeveer 1 ph-eenheid aan weerszijden van de pKind-waarde.,
De exacte waarden voor de drie indicatoren die we hebben bekeken zijn:
| indicator | pKind | pH-bereik |
|---|---|---|
| waarom | 6.5 | 5 – 8 |
| methyl oranje | 3.7 | 3.1 – 4.4 |
| fenolftaleïne | 9.3 | 8.3 – 10.0 |
De lakmoes kleur veranderen gebeurt via een ongewoon breed aanbod, maar het is nuttig voor het opsporen van zuren en logen in het lab, omdat het verandert van kleur, rond een pH van 7., Methyloranje of fenolftaleïne zou minder nuttig zijn.
Dit is gemakkelijker diagramatisch te zien.
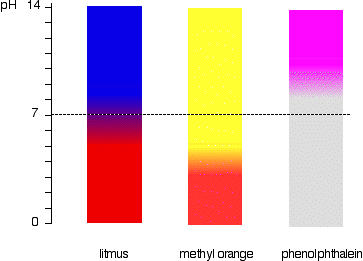
bijvoorbeeld, methyloranje zou geel zijn in elke oplossing met een pH hoger dan 4,4. Het kon geen onderscheid maken tussen een zwak zuur met een pH van 5 of een sterke alkali met een pH van 14.
het kiezen van indicatoren voor titraties
onthoud dat het equivalentiepunt van een titratie is waar u de twee stoffen in exact vergelijkingsverhoudingen hebt gemengd., U moet natuurlijk een indicator kiezen die zo dicht mogelijk bij dat equivalentiepunt van kleur verandert. Dat varieert van titratie tot titratie.
sterk zuur v sterke base
het volgende diagram toont de pH-curve voor het toevoegen van een sterk zuur aan een sterke base. Er bovenop liggen de pH-bereiken voor methyloranje en fenolftaleïne.
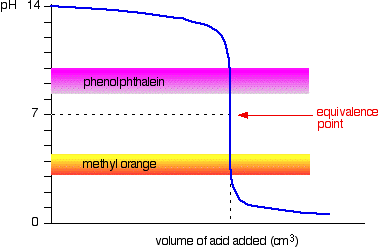
u kunt zien dat geen van beide indicatoren van kleur verandert op het equivalentiepunt.,
echter, de grafiek is zo steil op dat punt dat er vrijwel geen verschil in het volume van zuur toegevoegd welke indicator u kiest. Het zou echter zinvol zijn om met elke indicator de best mogelijke kleur te titreren.
Als u fenolftaleïne gebruikt, zou u titreren totdat het gewoon kleurloos wordt (bij pH 8,3) omdat dat het dichtste is als u het equivalentiepunt kunt bereiken.
aan de andere kant zou u met methyloranje titreren totdat er het allereerste spoor van Oranje in de oplossing zit., Als de oplossing rood wordt, kom je verder van het equivalentiepunt af.
sterk zuur v zwakke base
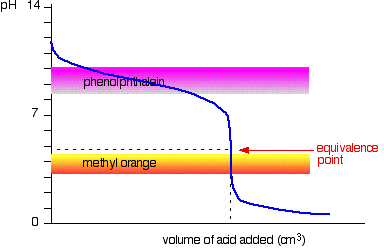
Deze keer is het duidelijk dat fenolftaleïne volledig nutteloos zou zijn. Methyloranje begint echter heel dicht bij het equivalentiepunt te veranderen van geel naar oranje.
u moet een indicator kiezen die van kleur verandert op het steile stuk van de curve.
zwak zuur v sterke base
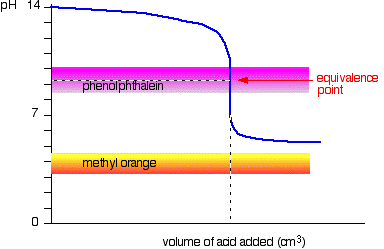
Deze keer is methyloranje hopeloos!, Echter, de fenolftaleïne verandert van kleur precies waar u het wilt.
zwak zuur v zwakke base
De curve is voor een geval waarin het zuur en de base beide even zwak zijn – bijvoorbeeld ethaanzuur en ammoniakoplossing. In andere gevallen zal het equivalentiepunt op een andere pH liggen.
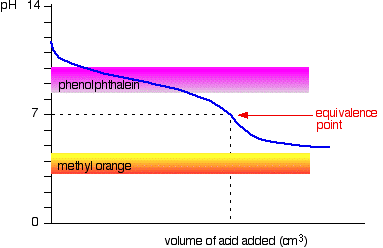
u kunt zien dat geen van beide indicatoren enig nut heeft. Fenolftaleïne zal zijn geëindigd te veranderen ruim voor het equivalentiepunt, en methyloranje valt helemaal uit de grafiek.,
het kan mogelijk zijn om een indicator te vinden die begint te veranderen of eindigt met veranderen op het equivalentiepunt, maar omdat de pH van het equivalentiepunt van geval tot geval zal verschillen, kunt u niet generaliseren.
over het algemeen zou u nooit een zwak zuur en een zwakke base titreren in de aanwezigheid van een indicator.
natriumcarbonaatoplossing en verdund zoutzuur
Dit is een interessant speciaal geval., Als u fenolftaleïne of methyloranje gebruikt, geven beide een geldig titratieresultaat-maar de waarde van fenolftaleïne is precies de helft van die van methyloranje.
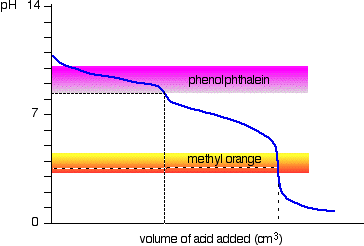
het gebeurt dat het fenolftaleïne zijn kleurverandering heeft beëindigd op precies de pH van het equivalentiepunt van de eerste helft van de reactie waarbij natriumwaterstofcarbonaat wordt geproduceerd.
![]()
![]()
De methyloranje verandert van kleur bij precies de pH van het equivalentiepunt van de tweede fase van de reactie.,
![]()
![]()
vragen om uw begrip te testen
als dit de eerste reeks vragen is die u hebt gedaan, lees dan de inleidende pagina voordat u begint. U moet de knop terug in uw browser gebruiken om hier achteraf terug te komen.
vragen over indicatoren
antwoorden
Waar wilt u nu naartoe?
naar het menu zuur-base evenwichten . . .
naar het menu Fysische Chemie . . .
naar Hoofdmenu . . .,
















Geef een reactie