| De Universiteit van Sheffield | Departement Chemie | VSEPR |
ammoniak heeft ook vier elektronenparen en de coördinatiegeometrie van stikstof zijn gebaseerd op een tetraëdrische opstelling van elektronenparen. Er zijn slechts drie gebonden groepen, daarom is er één enkel paar. Omdat de eenzame paren echter ‘onzichtbaar’ zijn, is de vorm van ammoniak piramidaal.,r>
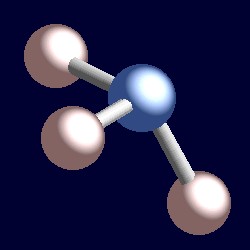
beschouw een bindingspaar van elektronen. De twee elektronen bevinden zich tussen twee kernen, en worden door beide aangetrokken. Een eenzaam paar is anders. Het wordt noodzakelijkerwijs slechts aangetrokken tot één kern en het gevolg is dat het een positie inneemt die effectief dichter bij die ene kern ligt dan de verbindingsparen van elektronen. Dit betekent dat de effectieve ruimtehoek bezet door een enkel paar groter is dan die bezet door een bond paar., Eenzame paren vereisen grotere hoekige ruimte, en bevinden zich dichter bij hun atomen dan bind paren. Het gevolg hiervan voor ammoniak is dat het eenzame paar ruimte maakt voor zichzelf door de drie waterstofatomen een beetje samen te duwen en de H-N-H bindingshoeken iets minder zijn (106,6°) dan de ideale tetrahedrale hoek van 109,5°.
















Geef een reactie