US Pharm. 2010;35(5):36-41.
een relatie tussen diabetes mellitus (DM) en dementie is onmiskenbaar, met talrijke studies die concluderen dat DM het risico op cognitieve achteruitgang en dementie, waaronder de ziekte van Alzheimer (AD), verhoogt.1-5 DM verhoogt niet alleen het risico op dementie, het verhoogt eigenlijk het tarief van dementieontwikkeling twee – tot drievoudig.,3 Het mechanisme van deze stoornis is niet volledig begrepen, maar er wordt verondersteld dat hyperglycemie, insulineresistentie, oxidatieve stress, geavanceerde glycatie-eindproducten en ontstekingscytokines collectief leiden tot cognitieve dysfunctie.5 in feite, diabetes werd beschreven als een “speciale vorm van versnelde veroudering” in 1976 als gevolg van de vele bijbehorende complicaties.,5 de schijnbare overlap tussen DM en dementie heeft geleid tot de suggestie dat AD niet alleen een neurologische aandoening is, maar eerder een neuro-endocriene aandoening, waarbij Steen et al de term type 3 diabetes gebruikt om deze hybride ziekte te beschrijven.,6
overzicht van insulineresistentie/verstoorde glucosetolerantie
Pathofysiologie: zowel een verstoorde glucosetolerantie-gedefinieerd als een plasmaglucose van 140 mg / dL tot 199 mg/dL na een orale glucosetolerantietest—als een verstoorde nuchtere glucose—gedefinieerd als een nuchtere plasmaglucose van 100 mg/dL tot 125 mg/dL—zijn diagnostisch voor prediabetes (voorloper van type 2 DM ), evenals een hemoglobine A1C van 5,7% tot 6,4%.7 de pathofysiologie van prediabetes is hetzelfde als dat van T2DM, die na een vastende bloedglucose van 126 mg/dL of groter of een A1C van 6 wordt gediagnosticeerd.,5% of meer (test herhaald voor bevestiging).In beide omstandigheden ontwikkelt zich insulineresistentie in de perifere weefsels, waar insuline nodig is voor de opname van glucose (namelijk spier, lever en vet), en de alvleesklier wordt gedwongen om steeds meer insuline te leveren om deze resistentie te overwinnen.8 in dit stadium zijn patiënten vaak hyperinsulinemisch; echter, na verloop van tijd, de alvleesklier kan niet voldoen aan de eisen van de weefsels, en de insuline-producerende bètacellen van de alvleesklier langzaam falen, produceren steeds minder insuline.,Zonder voldoende insuline stijgen de bloedglucoseconcentraties, wat leidt tot prediabetes en, bij maximaal 70% van de patiënten met prediabetes, T2DM.De complicaties van hyperglycemie zijn talrijk en omvatten een verhoogd risico van macrovasculaire complicaties (met inbegrip van myocardinfarct, cerebrovasculair accident, en perifere vasculaire ziekte) en microvasculaire complicaties (met inbegrip van nefropathie, neuropathie, en retinopathie).7
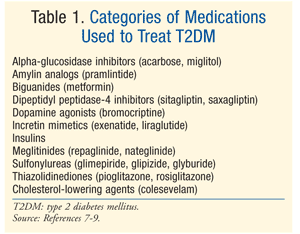
behandeling: Er bestaan vele therapieën om DM te behandelen., De eerste behandeling voor zowel prediabetes als T2DM is Levensstijl wijziging die dieet, oefening, en gewichtsverlies impliceren.De American Diabetes Association (ADA) beveelt ook aan om metformine te overwegen bij patiënten met prediabetes die een hoog risico lopen op het ontwikkelen van diabetes.Metformine wordt aanbevolen als initiële farmacologische therapie voor T2DM.Vaak is aanvullende farmacologische therapie nodig om Ada glycemische doelen te bereiken, waaronder een A1C <7%.,7 Er zijn talrijke klassen van medicijn voor T2DM (tabel 1), en de keus van agent om bloedglucose te normaliseren hangt van een gastheer van patiënt – en medicatie-specifieke factoren af. Het is belangrijk op te merken dat vele patiënten met T2DM exogene insuline uiteindelijk zullen vereisen om euglycemia te bereiken en te handhaven aangezien de BÃ ta-celfunctie progressief afneemt.
overzicht van AD
Pathofysiologie: AD is de meest voorkomende vorm van dementie bij oudere volwassenen, goed voor 60% tot 80% van alle gevallen.,10 twee histopathologische kenmerken van AD zijn neuritische plaques en neurofibrillaire kluwen.11 Plaques bestaan uit onoplosbaar bèta-amyloïde eiwit. De kluwen, die intracellular zijn, zijn samengesteld uit phosphorylated Tau proteã ne. De proteã ne van Tau is belangrijk voor microtubuleassemblage, en wanneer deze proteã ne abnormaal phosphorylated is, wordt de neuronale functie onderbroken. De neurofibrillaire verwarring beà nvloedt meestal cholinerge neuronen.12 bovendien draagt de verstoring van de belangrijkste prikkelende neurotransmitter, glutamaat, bij tot de pathologie van AD., In advertentie, is er een overactivation van glutamate, signalerend een proces als excitotoxicity wordt bekend, die tot plaquevorming, hyperphosphorylation van Tau-proteã ne, en celdood leidt.12 samengevat verstoren excitotoxiciteit en de vorming van neuritische plaques en neurofibrillaire kluwen de neurotransmitterwegen, wat resulteert in het leren en geheugenstoornis geassocieerd met AD.
behandeling: de beschikbare FDA-goedgekeurde farmacologische therapieën voor AD zijn samengevat in Tabel 2.,11,12 hoewel er nog veel moet worden geleerd met betrekking tot therapieën die de pathologie van AD behandelen of veranderen, omvatten de momenteel beschikbare therapieën het gebruik van acetylcholinesteraseremmers, waarvan er vier zijn, en de N-methyl-d-aspartaatreceptorantagonist memantine.

insuline en de hersenen
hoewel het noodzakelijk is voor glucosetransport naar perifere weefsels, lijkt insuline niet nodig te zijn voor het transport van glucose naar de hersenen of voor het cerebrale glucosemetabolisme., Terwijl glucosetransport naar de hersenen niet afhankelijk is van insuline, wordt insuline zelf over de bloed–hersenbarrière (BBB) door insuline–receptor-gemedieerde transportprocessen vervoerd.13 dit transportmechanisme is verzadigbaar; bij langdurige periodes van overtollige insulineconcentraties (hyperinsulinemie) in de periferie, zoals die gezien in prediabetes en T2DM, dit receptor-gemedieerde transportmechanisme downreguleert, waardoor het transport van insuline naar de hersenen en cerebrospinale vloeistof.,
naast insuline is insulineachtige groeifactor type 1 (IGF-1) aanwezig in de hersenen en is nodig voor een normale groei en functie van het centrale zenuwstelsel (CZS).14 insuline-en IGF-1-receptoren bevinden zich door de hersenen op neuronen en astrocyten (stervormige cellen in het CZS die helpen neuronen in de hersenen te ondersteunen). Twee gebieden van de hersenen die cruciaal zijn voor het leren en het geheugen, de hippocampus en de hypothalamus, bevatten hoge concentraties van insulinereceptoren.Bij ratten bleek intracerebroventriculaire insulinetoediening het geheugen te versterken.,Bovendien is aangetoond dat intranasale toediening van insuline bij mensen de geheugenprestaties verhoogt.Zoals eerder opgemerkt, is insuline niet nodig voor het cerebrale glucosemetabolisme; er kunnen echter specifieke gebieden in de hersenen zijn waar insuline metabole processen met glucose teweegbrengt. In rattenstudies, is insuline getoond om glucosegebruik in de hypothalamus en de locus coeruleus, twee gebieden te beà nvloeden die voor het leren en geheugen belangrijk zijn.,Het leren heeft ook getoond om verhoogde uitdrukking van CNS-insulinereceptoren te vergemakkelijken, leidend tot de postulatie dat de aanwezigheid en activiteit van insuline in de hersenen aan het leren en geheugen bijdragen en een essentiële rol spelen. Insuline kan ook bijdragen aan de modulatie van CZS-neurotransmitters, met name acetylcholine en noradrenaline, die beide van cruciaal belang zijn voor normale cognitie en gezondheid van de hersenen.,
insulineresistentie en dementie
overzicht: er lijken veel defecten te zijn in de insulinesignalering in de hersenen van AD-patiënten, wat leidt tot een verminderd glucosegebruik en energiemetabolisme.6,19 aangezien T2DM met perifere insulineresistentie wordt geassocieerd, wordt advertentie geassocieerd met de insulineresistentie van hersenen.In het begin van de advertentie lijkt er onvoldoende insulineopname en signalering in de hersenen te zijn, een teken van insulineresistentie.5,19,21,22 verhoogde insuline receptoren zijn gezien in de hersenen van patiënten met AD, waarschijnlijk als compensatie voor insulineresistentie.,
in het algemeen heeft deze verminderde insulinesignaalwerking veel downstream effecten in AD. Een theorie is dat lage concentraties van insuline in het CZS leiden tot een afname van acetylcholine niveaus en cerebrale bloedstroom.Bovendien kunnen veranderingen in insulineconcentraties de vorming van bèta-amyloïde en tau-eiwit bevorderen.2 in de hersenen is insulineafbrekende enzym (IDE) betrokken bij de afbraak en klaring van bèta-amyloïde eiwitten.Hoge insulinespiegels remmen IDE en kunnen leiden tot een afname van de bèta-amyloïdklaring, waardoor vervolgens de afzetting van bèta-amyloïd in de hersenen toeneemt.,Recent hebben ceramiden, een familie van lipiden, aandacht gevraagd voor hun mogelijke rol in insulineresistentie en dementie.23,24 Ceramides worden geproduceerd in aanwezigheid van ontsteking, die gemeenschappelijk is in obesitas, T2DM, en advertentie.Omdat ceramide gemakkelijk de BBB passeert, veroorzaakt blootstelling een verminderd energiemetabolisme en veranderingen in de insulinegenexpressie, wat bijdraagt tot insulineresistentie.Dit is momenteel een actief aandachtsgebied, met onderzoekers die aantonen dat remming van ceramide synthese obesitas-gemedieerde insulineresistentie verhinderde.,
intranasale insuline: zoals eerder vermeld, verbetert de toediening van intranasale insuline de geheugenprestaties bij mensen.Er zijn verschillende studies met intranasale insuline uitgevoerd. Na toediening van 20 eenheden intranasale insuline tweemaal daags aan menselijke proefpersonen, Reger et al vonden dat, in vergelijking met placebo, de groep behandeld met insuline meer verbale informatie behouden en toonde een verbeterde aandacht en functionele status.,Deze onderzoekers merkten ook op dat nuchtere plasmaglucose en insuline niet veranderden met intranasaal insulinegebruik, wat erop wijst dat intranasale toediening directe insulinetoegang tot het CZS biedt zonder perifere effecten.25,26
PPAR-Gamma-agonisten: uitgebreid bestudeerd voor de behandeling van perifere insulineresistentie, worden de thiazolidinedionen rosiglitazon en pioglitazon onderzocht op hun rol bij de behandeling van AD. Thiazolidinedionen zijn peroxisome proliferator-activated receptor (PPAR) – gamma agonisten., PPAR-gamma is betrokken bij glucose en lipidemetabolisme en moduleert ontsteking, een bekende bijdrager aan advertentie.Thiazolidinedionen zijn insuline sensibilisatoren, die werken om de insulineresistentie te verminderen; ze lijken ook ontstekingen te verminderen.21,26 in verscheidene placebogecontroleerde onderzoeken vertoonden patiënten die behandeld werden met rosiglitazon een verbetering van het geheugen en de cognitieve functie.Hoewel er slechts kleine studies met pioglitazon zijn uitgevoerd, is dit medicijn ook geassocieerd met verbeteringen in het geheugen en de cognitie.,Hoewel pioglitazon en rosiglitazon een slechte BBB-permeabiliteit hebben, is elk van deze middelen na orale toediening in de hersenen gedocumenteerd.Hoewel deze medicijnen een rol in de preventie of behandeling van advertentie kunnen spelen, zijn zij momenteel niet FDA-goedgekeurd voor patiënten met ADVERTENTIE, en hun potentiële voordelen en risico ‘ s moeten grondig worden overwogen op een individuele basis.
aërobe oefening: misschien wel de meest effectieve, en de meest over het hoofd gezien, methode om insulineresistentie te verminderen is fysieke activiteit., Obesitas is geassocieerd met een verhoogd risico op insulineresistentie, diabetes, dementie en AD.Oefening verbetert de insulinegevoeligheid en verlaagt de perifere insulinespiegels.26,31 lichamelijke activiteit, onafhankelijk van het gewicht, wordt geassocieerd met een lager risico op AD, waardoor het de enige bewezen neuroprotectieve therapie is.29-31 een mogelijk mechanisme van deze neuroprotection is dat de oefening de klaring van BÃ ta-amyloid proteã nen bevordert en hersenen-afgeleide neurotrophic factor verhoogt, een de groeifactor essentieel voor kennis en neuronale overleving die in advertentie wordt verminderd.,
rol van apotheker
apothekers spelen een essentiële rol bij het opleiden van patiënten over nieuwe therapieën; ze moeten ook op de hoogte blijven van nieuwe medische ontdekkingen of aandoeningen die vaak in het nieuws worden gepresenteerd. Type 3 diabetes is een dergelijke aandoening. Hoewel er nog veel te leren valt over deze potentiële nieuwe link tussen diabetes en verminderde cognitie, zal het publiek de mening van hun zorgverleners vragen. Daarnaast zullen veel patiënten met diabetes meer willen leren en zich tot hun apothekers wenden voor informatie., Daarom moeten apothekers het huidige begrip van deze aandoening met hun patiënten bespreken en hen ook adviseren over strategieën die hun risico kunnen verminderen, gezien hun individuele comorbiditeiten.
conclusie
intensieve studie is aan de gang in een poging om type 3 diabetes beter te karakteriseren en preventieve en therapeutische strategieën te ontwikkelen. Tot op heden zijn er geen specifieke behandelingen met bewezen werkzaamheid in de preventie van cognitieve achteruitgang of AD bij patiënten met DM., Daarom is de behandeling van cognitieve stoornissen bij patiënten met DM identiek aan die van patiënten zonder DM, met specifieke aandacht voor glycemische controle en cardiovasculaire risicofactoren. Dit is dezelfde aanpak die al essentieel is voor het voorkomen van DM-gerelateerde complicaties. Hoewel sommige patiëntengroepen een verhoogd risico op cognitieve stoornissen lijken te lopen, hebben de meeste patiënten met DM geen duidelijk gedefinieerde klinische associaties., Hoewel er geen specifieke behandelingsopties beschikbaar zijn, is de huidige logische benadering glycemische controle te bereiken en zorgvuldig cardiovasculaire risicofactoren, zoals hyperlipidemie en hypertensie te beheren.
1. Stewart R, Liolitsa D. type 2 diabetes mellitus, cognitive impairment and dementia. Diabet Med.
2. Xu WL, von Strauss E, Qiu CX, et al. Ongecontroleerde diabetes verhoogt het risico op de ziekte van Alzheimer: een populatie-gebaseerde cohort Studie. Diabetologia. 2009;52:1031-1039.
3. Arvanitakis Z, Wilson RS, Bennett DA. Diabetes mellitus, dementie en cognitieve functie bij oudere personen., J Nutr Gezondheid Veroudering. 2006;10:287-291.
4. Jacobson AM, Musen G, Ryan CM, et al. Langdurig effect van diabetes en de behandeling ervan op de cognitieve functie. N Engl J Med. 2007;356:1842–1852.
5. Whitmer RA. Diabetes Type 2 en risico op cognitieve stoornissen en dementie. Curr Neurol Neurosci Rep. 2007; 7: 373-380.
6. Steen E, Terry BM, Rivera EJ, et al. Verminderde insuline en insuline-achtige groeifactor expressie en signalerende mechanismen bij de ziekte van Alzheimer-is dit type 3 diabetes? J Alzheimers Dis. 2005;7:63-80.
7. American Diabetes Association. Normen van medische zorg bij diabetes-2010., Diabetes Zorg.
8. Triplitt Cl, Reasner CA, Isley WL. Diabetes mellitus. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Farmacotherapie principes & praktijk. 7e ed. New York, NY: McGraw Hill Medical; 2008: 1205-1241.
9. Nathan DM, Buse JB, Davidson MD, et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Zorg.
10. Hebert LE, Scherr PA, Bienias JL, et al., Alzheimer disease in the US population: prevalence estimates using the 2000 census. Arch Neurol. 2003;60:1119-1122.
11. Cummings J. de ziekte van Alzheimer. N Engl J Med. 2004;351:56-67.
12. Slattum PW, Swerdlow RH, Hill AM. De ziekte van Alzheimer. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Farmacotherapie principes & praktijk. 7e ed. New York, NY: McGraw Hill Medical; 2008: 1051-1065.
13. Craft S, Watson GS. Insuline en neurodegeneratieve ziekte: gedeelde en specifieke mechanismen. Lancet Neurol. 2004;3:169-178.
14. de La Monte SM, Wands JR., Overzicht van insuline en insuline-achtige groeifactor expressie, signalering, en storing in het centrale zenuwstelsel: relevantie voor de ziekte van Alzheimer. J Alzheimers Dis. 2005;7:45-61.
15. Park CR, Seeley RJ, Craft S, Woods SC. Intracerebroventriculaire insuline verbetert het geheugen bij een passieve vermijdingstaak. Physiol Behav. 2000;68:509-514.
16. Fehm HL, Perras B, Smolnik R, et al. Het manipuleren van neuropeptidergische paden bij de mens: een nieuwe benadering van neurofarmacologie? EUR J Pharmacol. 2000;405:43-54.
17. Zhao WQ, Alkon DL. Rol van insuline en insuline receptor in het leren en geheugen., Mol Cell Endocrinol. 2001;177:125-134.
18. Kopf S, Baratti C. effecten van posttraining toediening van insuline op retentie van een gewenningsreactie bij muizen: participatie van een centraal cholinerg mechanisme. Neurobiol Leer Mem.
19. Revill P, Moral MA, Prous JR. verstoorde insuline signalering en de pathogenese van de ziekte van Alzheimer. Drugs Today (Barc). 2006;42:785-790.
20. Moroz N, Tong M, Lonstato L, et al. Beperkte Alzheimer-type neurodegeneratie bij experimentele obesitas en type 2 diabetes mellitus. J Alzheimers Dis. 2008;15:29-44.
21. Haan MN., Therapy insight: type 2 diabetes mellitus en het risico van de ziekte van Alzheimer. Nat Clin Pract Neurol. 2006;2:159-166.
22. Landreth G, Jiang Q, Madrekar S, et al. Ppargamma-agonisten als therapeutica voor de behandeling van de ziekte van Alzheimer. Neurotherapie. 2008;5:481-489.
23. Lyn-Cook LE, Lawton M, Tong M, et al. Hepatische ceramide kan leiden tot insulineresistentie en neurodegeneratie in de hersenen bij type 2 diabetes en niet-alcoholische steatohepatitis. J Alzheimers Dis.
24. Tong M, De La Monte SM. Mechanismen van ceramide-gemedieerde neurodegeneratie. J Alzheimers Dis.
25., Reger MA, Watson GS, Green PS. Intranasale insuline verbetert kennis en moduleert bèta-amyloid in vroege advertentie. Neurologie. 2008;70:440-448.
26. Craft S. insuline resistance syndrome en de ziekte van Alzheimer: leeftijd-en obesitas-gerelateerde effecten op het geheugen, amyloid en ontsteking. Neurobiol Veroudering. 2005; 26 (suppl 1): 65-69.
27. Jiang Q, Heneka M, Landreth GE. De rol van peroxisome proliferator-activated receptor-gamma (PPARgamma) in de ziekte van Alzheimer: therapeutische implicaties. CNS Drugs. 2008;22:1-14.
28. Watson GS, Cholerton BA, Reger MA, et al., Behoud van de cognitie bij patiënten met een vroeg stadium van de ziekte van Alzheimer en een lichte amnestische cognitieve stoornis tijdens de behandeling met rosiglitazon: een voorstudie. Am J Geriatr Psychiatrie. 2005;13:950-958.
29. Luchsinger JA, Mayeux R. Adiposity en de ziekte van Alzheimer. Curr Alzheimer Res. 2007; 4: 127-134.
30. Whitmer RA. De epidemiologie van adipositeit en dementie. Curr Alzheimer Res. 2007; 4: 117-122.
31. Watson GS, Craft S. de rol van insulineresistentie in de pathogenese van de ziekte van Alzheimer: implicaties voor de behandeling. CNS Drugs. 2003;17:27-45.
32. Cole GM, Frautschy SA., De rol van insuline en neurotrophic factor die in hersenen het verouderen en de ziekte van Alzheimer signaleren. Exp Gerontol. 2007;42:10-21.
















Geef een reactie