introductie
replicatie in de kern van eukaryotische cellen maakt gebruik van drie DNA-polymerasen: polymerase α, δ En ε (Hubscher et al ., 2002; Pavlov et al., 2006b; Kunkel and Burgers, 2008; Loeb and Monnat, 2008; Burgers, 2009; Pavlov and Shcherbakova, 2010; Lange et al., 2011)., De DNA-synthese is gericht en verloopt van 5 ‘tot 3’, waarbij een nucleofiele aanval op het α-Fosfaat van een nucleotide door de 3 ‘ OH van een primer resulteert in de inbouw van een nucleosidemonofosfaat en de afgifte van pyrofosfaat (Steitz, 1999). Alle polymerasen van DNA vereisen een primer en een vrije 3 ‘ OH om DNA-synthese uit te voeren, en Pol α is geen uitzondering. Pol α is een heterotetramer die bestaat uit twee primase-subeenheden en twee polymerasesubeenheden., De subeenheden van primase initiëren de replicatie van DNA door korte (7-12 ribonucleotiden) RNA-primers samen te stellen, die dan door polymerase α worden uitgebreid (Pellegrini, 2012). DNA-polymerase δ En ε verlengen de door pol α gegenereerde primers nauwkeurig en processief (Kunkel, 2004, 2011; Pellegrini, 2012). In gist, is de polymerase δ van DNA getoond essentieel om voor de synthese van DNA van de achterblijvende bundel te zijn terwijl Pol ε hoofdzakelijk bij de belangrijke bundel schijnt te functioneren (Pursell et al., 2007; Nick Mcelhinny et al., 2008; Kunkel, 2011; Georgescu et al., 2014)., In tegenstelling, in de mitochondria replicatie is de verantwoordelijkheid van één enige polymerase, DNA-polymerase γ (Lee et al., 2009).
DNA-polymerasen zijn gegroepeerd in zeven families (A, B, C, D, X, Y en RT). In eukaryotes de drie nucleaire replicatieve polymerases van DNA toevallig behoren tot de familie B (Burgers et al., 2001; Patel and Loeb, 2001). Er zijn nu kristallen structuren van alle drie replicatieve DNA polymerases van gist, die voor de eerste keer een vergelijking van hun gedeelde structurele elementen, evenals een studie van hun unieke eigenschappen (Swan et al., 2009; Perera et al.,, 2013; Hogg et al., 2014; Jain et al., 2014a). Alle drie de replicatieve DNA-polymerasen zijn multi-subunit enzymen (Tabel 1) (Johansson and Macneill, 2010; Pavlov and Shcherbakova, 2010; Makarova et al., 2014). De belangrijkste focus van dit overzicht ligt op hun katalytisch domein, of subeenheid A.
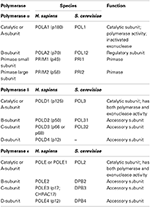
Tabel 1. Eukaryotic de polymerases van DNA zijn multi-subeenheid enzymen.,
totale structuur van polymerasen van de B-Familie
alle DNA-polymerasen hebben een gemeenschappelijke polymeraseplooi, die is vergeleken met een menselijke rechterhand, bestaande uit drie subdomeinen: vingers, palm en duim (Steitz, 1999; Patel en Loeb, 2001). De palm, een sterk geconserveerde plooi bestaande uit vier antiparallel β-strengen en twee helices, herbergt twee strikt geconserveerde katalytische aspartaten in motief a, dxxlyps en motief C, DTDs (Delarue et al., 1990; Braithwaite and Ito, 1993)., Deze RRM-achtige vouw wordt gedeeld door een zeer grote groep enzymen, waaronder DNA-en RNA-polymerasen, reverse transcriptases, CRISPR-polymerase, en zelfs reverse (3′-5′) transferases zoals Thg1 (Anantharaman et al., 2010; Hyde et al., 2010). De subdomeinen duim en vingers vertonen daarentegen aanzienlijk meer structurele diversiteit (Steitz, 1999). De vingers ondergaan een conformational verandering op het binden van DNA en het correcte inkomende nucleotide. Deze beweging staat residu ‘ s in het vingers subdomein toe om in contact te komen met het nucleotide in het beginnende basenpaar., De duim houdt de DNA-duplex vast tijdens de replicatie en speelt een rol in de processiviteit (Doublié and Ellenberger, 1998; Doublié et al., 1999).
eukaryotische DNA-polymerasen α, δ En ε delen homologie met vele archaeale, bacteriële, bacteriofaag-en virale polymerasen (Delarue et al., 1990; Braithwaite and Ito, 1993; Franklin et al., 2001; Firbank et al., 2008; Wang and Yang, 2009)., Koonin en medewerkers droegen een gedetailleerde fylogenetische analyse van archaeal DNA polymerases en hun relatie met eukaryotic polymerases in deze kwestie van grenzen in microbiologie gewijd aan polymerases Makarova et al. (2014).
alle polymerasen van de B-familie bestaan uit vijf subdomeinen: de vingers, duim en palm (hierboven beschreven) die de kern van het enzym vormen, evenals een exonuclease-domein en een n-terminaal domein (NTD) (Franklin et al., 2001; Xia and Konigsberg, 2014) (figuur 1; tabel S1)., Het exonuclease-domein draagt een 3′ -5 ‘ proeflezen activiteit, die misincorporated nucleotiden verwijdert. De actieve plaats van de exonuclease bevindt zich 40-45 Å van de actieve plaats van de polymerase. De NTD lijkt verstoken te zijn van katalytische activiteit. In pol δ bestaat de NTD uit drie motieven: een heeft een topologie die lijkt op een OB-vouw, een single-stranded DNA-bindend motief, en een ander draagt een RNA-bindend motief (RNA-Herkenningsmotief of RRM) (Swan et al., 2009). In bacteriofaag T4 verminderen mutaties in de NTD de expressie van de polymerase (Hughes et al., 1987)., In RB69 en T4 bindt de gp43 polymerase zijn eigen boodschapper RNA, vermoedelijk door de NTD en onderdrukt de vertaling (Petrov et al., 2002), wat niet het geval lijkt te zijn voor Pol δ (Swan et al., 2009). Nieuwe gegevens geven aan dat de NTD een rol speelt in de polymerasestabiliteit en-betrouwbaarheid door zijn interacties met andere domeinen (Li et al., 2010; Prindle et al., 2013) (zie hieronder).
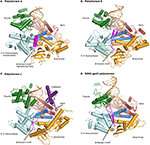
figuur 1. Ternaire complexen van polymerasen α, δ, ε en RB69 gp43 worden geïllustreerd aan de hand van identieke oriëntaties voor vergelijking., De duim (groen) en vingers (donkerblauw) domeinen grijpen de duplex nucleïnezuur (primer in beige, sjabloon in Oranje) tegen de palm domein (rood). Het n-terminaal domein verschijnt in goud, grenzend aan het 3 ‘ -5 ‘ exonuclease domein (cyaan). (A) Polymerase α (PDBID 4FYD) bindt een RNA/DNA-hybride, waar de brede, ondiepe kleine groef van A-vorm DNA zichtbaar is in de buurt van de duim. De 3’ -5 ‘ exonuclease domein is verstoken van activiteit. Een spiraalvormig gebied (magenta) in het geïnactiveerde exonuclease domein stabiliseert 5 ‘ End van het malplaatje., (B) Polymerase δ (PDBID 3IAY) bevat een groot β-haarspeldmotief (magenta), dat belangrijk is bij het overschakelen van de primerstreng van de actieve plaats van de polymerase naar de actieve plaats van de exonuclease in het geval van proeflezen. (C) Polymerase ε (PDBID 4M8O) hanteert een uniek P-domein (Paars), dat de polymerase met verhoogde processiviteit begiftigt. Interessant is dat het β-haarspeldmotief is geatrofieerd in pol ε., (D) het behoud van de polymerase vouw van familieb DNA, en de organisatie van het domein, is duidelijk wanneer het modelenzym van bacteriofaag RB69 gp43 (PDBID 2OZS) samen met de drie eukaryotic replicative polymerases wordt bekeken. De domeinafbakening voor elke polymerase wordt gegeven in Tabel S1. Figuur werd gemaakt met PyMOL (het pymol Molecular Graphics System, versie 1.5.0.4 Schrödinger, LLC.).
van alle DNA-polymerasen van de B-familie van zoogdieren is bekend dat ze twee cysteïnerijke metaalbindingsplaatsen (CysA en CysB) in hun C-terminaldomein (CTD) Herbergen (Figuur 2)., CysA wordt verondersteld een zinkbindende plaats te zijn terwijl CysB een ijzerzwavelcluster is (Netz et al., 2012). Verlies van de cluster in de CTD van gist Pol δ heeft een negatief effect op interacties met zijn accessoire B-subeenheid (Sanchez Garcia et al., 2004). Het zinkbindend motief bleek belangrijk te zijn voor de interactie van Pol δ met zijn processiviteits factor, PCNA (Netz et al., 2012).

Figuur 2. Schematisch schema van de drie Saccharomyces cerevisiae replicatieve DNA-polymerasen α, δ en ε., De polymerase van DNA van bacteriofaag RB69 wordt getoond voor vergelijking.
DNA-Polymerase α
de katalytische subeenheid van DNA-polymerase α bestaat uit 1468 aminozuren (Tabel 2). De voor kristallisatie ontworpen eiwitconstructie werd afgekapt aan de N-en C-eindpunten (residuen 349-1258) en mist daarom de CTD en zijn cluster (Figuur 2). Het construct werd gekristalliseerd unliganded, in een binair complex met een DNA / RNA hybride oligonucleotide, en in een ternair complex met DNA / RNA en inkomende nucleotide (Perera et al., 2013) (figuur 1).,

Tabel 2. Compilatie van de polymerase van DNA van de familie B van bekende structuur.
een mechanisme voor het loslaten van de Polymerase
het in de kristallen gevangen RNA/DNA-oligonucleotide heeft, zoals verwacht, een A-vormconstructie. Het duimdomein houdt zich bezig met meerdere interacties met de RNA-primer, zowel via hydrofobe contacten als Polaire interacties (Perera et al., 2013)., Experimenten in oplossing hebben aangetoond dat de uitbreiding van de RNA-primer door Pol α beperkt is tot 10-12 nucleotiden, wat neerkomt op één draai van een helix. Deze observatie leidde de auteurs om een mechanisme voor beëindiging van primersynthese door Pol α voor te stellen waarin verlies van specifieke interactie tussen duim en RNA de polymerase zou teweegbrengen om zich van DNA/RNA oligonucleotide los te maken, en een hand aan een replicatieve polymerase toe te staan.,
bewegingen in het Palmdomein kunnen de translocatie van Pol α
vergemakkelijken nadat het enzym in drie toestanden (apo, binair en ternair) is gekristalliseerd, konden de auteurs alle drie de structuurmodellen overlappen. Pol α is de enige eukaryotische familie B DNA polymerase waarvoor alle drie de staten werden gevangen in een kristalstructuur. De structurele superpositie bleek dat, in aanvulling op de goed gedocumenteerde bewegingen van de vingers en duim subdomeinen begeleidende substraat binding en nucleotidyl overdracht, de palm subdomein zelf ondergaat een structurele herschikking (Perera et al.,, 2013). De auteurs stellen voor dat de verschillende conformaties van het palmdomein de translocatie van pol α langs en voorbij de RNA/DNA-duplex zouden kunnen vergemakkelijken. Zoals hierboven vermeld, wordt het verlies van contacten aan de bundel van RNA voorspeld om versie van inleiding teweeg te brengen, die dan Beschikbaar voor uitbreiding door Pol δ Of ε wordt.,
een verschillende Eiwitplooi in het geïnactiveerde Exonuclease subdomein
De proeflezingsactiviteit wordt afgeschaft in pol α, als gevolg van mutaties in alle vier carboxylaten (Asp114/Glu116/Asp222/Asp327 in RB69 gp43 komt overeen met Ser542/Gln544/Tyr644/Asn757 in een structuurgebaseerde alignment) (Tabel 2). Bovendien wordt het β-haarspeldmotief dat in de meeste polymerasen van de B-familie wordt aangetroffen (residuen 246-267 in RB69 gp43) vervangen door een spiraalvormig gebied in pol α (residuen 667-676; 681-693) (Hogg et al., 2007)., De β-haarspeld maakt deel uit van het exonuclease-domein en is in T4 en RB69 pols getoond om aan de verdeling van de DNA-primer tussen de polymerase en de actieve plaats van de exonuclease deel te nemen (Reha-Krantz, 1988; Stocki et al., 1995; Hogg et al., 2007). Bij gebrek aan proeflezen is het niet verwonderlijk dat dit motief in pol α Niet werd behouden. Residueert zijn 684 en Phe 685 van het spiraalvormige gebied in pol α stapel met een thymine en guanine base, respectievelijk, op posities -3 en -2 in de ongepaarde 5 ‘ End van de template (Perera et al., 2013)., Zo neemt in pol α het gebied dat overeenkomt met het β-haarspeldmotief een andere vouw aan (helices vs.β-strengen) en een andere functie (het stabiliseren van het ongepaarde gebied van de template streng in plaats van het faciliteren van actieve site switching). Aangezien Pol α Geen controleactiviteit heeft, rijst de vraag of de korte oligonucleotiden worden gecorrigeerd en zo ja, door welke DNA-polymerase. Het lijkt erop dat het proeflezen van de door pol α gesynthetiseerde primers wordt uitgevoerd door Pol δ (Pavlov et al., 2006a).,
DNA-Polymerase δ
humaan Pol δ bestaat uit vier subeenheden, terwijl Saccharomyces cerevisiae er drie heeft (Gerik et al., 1998; Liu et al., 2000) (Tabel 1). Naast zijn functie in de replicatie van DNA is Pol δ getoond om een rol in de reparatie en nieuwe combinatie van DNA te spelen (Hubscher et al., 2002; Lee et al., 2012; Tahirov, 2012). P12, de kleinste subeenheid in menselijke Pol δ en ook de subeenheid die niet in ontluikende gist wordt gezien, wordt afgebroken in reactie op DNA-schade (Lee et al., 2014). De katalytische subeenheid van gist Pol δ (POL3) bestaat uit 1097 residuen., De voor kristallisatie gebruikte constructie bestaat uit residuen 67-985 en ontbeert dus de CTD (figuur 1; Tabel 2).
een derde metaalion in de actieve Polymeraseplaats
het palmdomein bevat drie geconserveerde carboxylaten (Asp608, Asp762 en Asp764). De twee katalytische aspartaten, Asp608 en Asp764, contacteren twee metaalionen (Ca2+) in de polymerase actieve site gescheiden door 3,7 Å. Intrigerend werd een derde metaal waargenomen gecoördineerd door het γ-Fosfaat van het inkomende nucleotide en Glu802, met Glu800 in de nabijheid., Mutatie van beide glutamaten tot alanine leverde een polymerasevariant op met een verminderde incorporatie-efficiëntie voor zowel correcte als onjuiste nucleotiden (Swan et al., 2009). Op deze aminozuurposities hebben pol α en Pol ε ook carboxylaatresiduen (Pol δ Glu800/Glu802 komt overeen met Pol α Asp1033/Asp1035, en pol ε Glu945/Asp947). Of deze carboxylaten een vergelijkbare rol spelen in pol α en ε moet nog worden onderzocht.,
High Fidelity and Correading
humaan Pol δ is een high-fidelity polymerase, die de nucleotidyltransferreactie katalyseert met een foutenfrequentie van 1 per 22.000 (Schmitt et al., 2009). Proeflezen verhoogt de betrouwbaarheid van de polymerase met een factor 10-100 (Mcculloch and Kunkel, 2008; Prindle et al., 2013). Pol δ herbergt een polymerase en exonuclease actieve site, gescheiden door ongeveer 45 Å (Swan et al., 2009). De polymerases van DNA met het proeflezen activiteit kunnen misincorporated nucleotiden aanvoelen door de minder belangrijke groef van basisparen voorbij de insertieplaats te contacteren., Het eiwit interageert met universele waterstofbindingsacceptoren op de N3 en O2 posities van purines en pyrimidines, respectievelijk (Seeman et al., 1976; Doublié et al., 1998; Franklin et al., 2001). Deze waterstofverbindingscontacten worden bewaard wanneer het basispaar een Watson-Crick-geometrie aanneemt en verloren gaat in het geval van een mismatch. In RB69 gp43 strekken de contacten zich uit tot de eerste twee basenparen voorbij het beginnende basenpaar (Franklin et al., 2001; Hogg et al., 2004, 2005). De contacten zijn veel uitgebreider in pol δ, die zich uitstrekken tot vijf basisparen na invoeging (Swan et al.,, 2009), die zou kunnen bijdragen aan zijn high fidelity.
zoals hierboven vermeld, speelt het β-haarspeldsegment van het exonuclease-domein een cruciale rol in de verdeling van het DNA tussen polymerisatie-en proeflezingslocaties in T4 en RB69 pols (Stocki et al., 1995; Hogg et al., 2007). In RB69 gp43 neemt het β-haarspeldmotief verschillende conformaties aan, afhankelijk van of het complex met onbeschadigd DNA werd verkregen (Franklin et al., 2001; Zahn et al., 2007) of DNA dat een schade bevat (Freisinger et al., 2004; Hogg et al., 2004)., Het werd volledig gevisualiseerd contact met zowel de primer en template strengen in een complex met thymine glycol (Aller et al., 2011). Evenzo, steekt de haarspeld β in pol δ in de belangrijkste groef van DNA uit en doet dienst als wig tussen dubbelstrengs DNA en single-stranded 5 ‘ End van de malplaatjestreng, die door twee aromatische residuen Phe441 en Tyr446 (figuur 1) (Swan et al., 2009). De positie van de β-haarspeld is consistent met een rol in actieve plaatsomschakeling.,
Interdomeincontacten en trouw
mutaties die betrokken zijn bij kanker worden meestal gevonden in het exonucleasedomein van Pol δ En ε, waarbij de nadruk wordt gelegd op de cruciale rol van proeflezen bij het verlagen van de incidentie van mutaties (Church et al., 2013; Henninger en Pursell, 2014). Eén mutatie in menselijke colorectale kankercellen lokaliseert zich naar het vingers domein, R689W. de analoge mutatie in gist (R696W) resulteert in een mutator fenotype (Daee et al., 2010)., Een mutatie in de buurt van Arg696 in het sterk behouden motief B van het vingers subdomein van gist Pol δ (A699Q) resulteert ook in een mutator fenotype. Dit gebied van de vingers ligt in de nabijheid van de NTD. Mutatie van MET540 van de NTD naar alanine elimineert het mutatorfenotype van A699Q, wat illustreert dat interacties tussen de vingers en de NTD de trouw van de polymerase kunnen beïnvloeden (Prindle et al., 2013)., Evenzo in T4 en RB69 pols is het NPL kernmotief, dat residuen van de N-terminal en palm domeinen impliceert, in contact met het vingers domein en werd getoond om polymerase-DNA complexen te stabiliseren (Li et al., 2010).
DNA-Polymerase ε
de katalytische subeenheid van DNA-polymerase ε is het product van een zeer groot gen (2222 aminozuren in gist; 2286 in mensen), en is slechts derde in grootte na polymerase ζ (ook een lid van de B-familie) en pol θ, een familie a polymerase (respectievelijk 3130 en 2590 aminozuren bij mensen) (Lange et al.,, 2011; Hogg and Johansson, 2012) (figuur 1; Tabel 2). Pol ε is tweemaal zo groot als Pol δ en bestaat uit twee tandem polymerase / exonuclease regio ‘ s. Het n-terminalsegment herbergt zowel polymerase als proeflezen terwijl het C-terminalsegment geïnactiveerd wordt. De twee exonuclease-polymerase modules zijn ver verwant (Tahirov et al., 2009). Hoewel het geïnactiveerde segment verondersteld wordt een structurele rol te spelen tijdens replicatie, waren twee groepen in staat om katalytisch actieve Pol ε constructies (residuen 1-1228; 1-1187) te kristalliseren zonder de volledige C-terminalmodule (Hogg et al.,, 2014; Jain et al., 2014a). Beide kristalstructuren waren van een ternair complex van de polymerase, de inleiding/het malplaatje van DNA en inkomend nucleotide.
een nieuw Processiviteitsdomein dat uitgaat van het Palmdomein
Pol ε verschilt van pol δ in die zin dat de DNA-glijklem PCNA niet nodig is voor een hoge processiviteit (Hogg and Johansson, 2012). Het palmdomein van pol ε is aanzienlijk groter (380 residuen) dan dat van Pol α Of δ (respectievelijk 175 en 203 residuen)., De recente Pol ε kristalstructuren onthulden dat inserties in het palmdomein collectief een nieuw domein vormen dat bestaat uit drie β-strengen en twee helices (residuen 533-555; 682-760) (Hogg et al., 2014; Jain et al., 2014a) (figuur 1; tabel S1). Het verwijderen van residuen 690-751 resulteerde in een variant met verminderde polymeraseactiviteit. Bovendien, muteren positief geladen residuen (His748, Arg749, en Lys751) gelegen in de nabijheid van de fosfaat backbone beïnvloed de processiviteit van het enzym (Hogg et al., 2014)., Het extra domein dat van de palm afkomstig was, werd dus het processivity of P domein genoemd, naar zijn functie. De basis van het P-domein herbergt een metaalbindplaats (zie hieronder) (Hogg et al., 2014; Jain et al., 2014a, b).
een Ijzerzwavelcluster binnen het Polymerasedomein
onverwacht onderzoek naar oplossingen toonde aan dat de katalytische subeenheid van gistpolymerase ε zelf een cluster binnen zijn polymeraseplooi bevat (Jain et al., 2014b), naast het cluster in de CTD (Figuur 2; Tabel 2)., De tweede cluster binnen Pol ε stelt voor dat deze polymerase gevoeliger voor oxidatieve stress kan zijn (Jain et al., 2014b). De kristalstructuren van pol ε onthulden echter geen cluster in het polymerasedomein (Hogg et al., 2014; Jain et al., 2014a; Zahn and Doublié, 2014). Twee van de cysteinenresiduen zijn ongeordend in de structuurmodellen en de resulterende metaalbindingsplaats lijkt zink te binden (Hogg et al., 2014; Jain et al., 2014a). Substitutie van A door een niet-inheems zink in metaalbindende eiwitten is niet ongebruikelijk (Netz et al., 2012) aangezien clusters labiel zijn., Het visualiseren binnen het polymerasedomein van Pol ε Kan anaerobe voorwaarden vereisen.
een kort β-Haarspeldmotief in het Exonucleasedomein
in elke DNA-polymerase die zowel polymerase-als exonucleaseactiviteiten bevat, is het gebonden DNA in evenwicht tussen de twee actieve centra (Beechem et al., 1998). De concentratie van inkomend nucleotide en de aanwezigheid van een beschadigde basis of mispair zijn twee factoren die de overdracht van DNA van de polymerase beà nvloeden activeert plaats aan de proofreading actieve plaats., Polymerasen bewaken de kleine groef kant van de nieuw gevormde basenparen en interageren met de universele h bond acceptoren, O3, en N2, als een manier om te controleren op mismatches (Seeman et al., 1976; Franklin et al., 2001). Een uniek kenmerk van pol ε is het contact met de belangrijkste groef kant van het ontluikende basenpaar via een residu van het exonuclease domein, Tyr431. Verdere analyse is gerechtvaardigd om de potentiële rol van deze tyrosine in de hoge trouw van Pol ε te verduidelijken.,
in pol δ plaatst het β-haarspeldsegment zich in het DNA en fungeert als een wig tussen enkelstrengs-en dubbelstrengs-DNA (Swan et al., 2009). In E. coli DNA pol II, verschuift het inbrengen van een β vat de positie van de β haarspeld zodanig dat polymerisatie boven het proeflezen wordt bevoordeeld (Wang and Yang, 2009). Deze modificatie laat deze polymerase vermoedelijk toe om translesiesynthese-extensie uit te voeren., Aangezien pol ε een nauwkeurige DNA-polymerase is, zou de veronderstelling voor de kennis van de kristalstructuur zijn dat de β-haarspeld dichter bij die van pol δ zou moeten zijn dan die van E. coli Pol II. verrassend genoeg is het β-haarspeldmotief in pol ε afgekapt, te kort om met het DNA in contact te komen (figuur 1). Welk eiwitmotief, dan, zou actieve plaats kunnen vergemakkelijken het overschakelen op het ontdekken van een mispair? Het P-domein is een goede kandidaat, vanwege zijn contacten met zowel primer-als template-strengen; residuen van het P-domein kunnen replicatiefouten aanvoelen en kunnen dus helpen bij het vergemakkelijken van actieve site-switching.,
conclusies
alle drie de eukaryotische replicatieve DNA-polymerasen maken gebruik van een gemeenschappelijke b-familievouw, en elke polymerase heeft gemodificeerde structurele elementen opgenomen die uniek zijn en afgestemd zijn op de specifieke functie van elke polymerase (bijvoorbeeld de toevoeging van het processiviteitdomein in pol ε, een processieve polymerase die geen PCNA gebruikt, of het gemodificeerde gebied dat contact maakt met de 5 ‘ End van de template in pol α, een polymerase zonder proeflezen activiteit). De vouw van B-familiepolymerasen is goed geschikt voor high-fidelity, replicatieve polymerasen., Maar verrassend genoeg wordt het ook gebruikt door translesiepolymerasen. Eukaryotic pol ζ (Of REV3L) is een 353 kDa-polymerase die in translesiesynthese functioneert en tumorigenese lijkt te onderdrukken (Wittschieben et al., 2010; Lange et al., 2011; Zahn et al., 2011; Hogg and Johansson, 2012; Sharma et al., 2013). De structuur van E. coli Pol II onthulde wijzigingen in de NTD die de positie van de β-haarspeld van het exonucleasedomein beà nvloeden, en dus de verdeling van het DNA tussen de polymerisatie en het proeflezen plaatsen (Wang en Yang, 2009)., De structuur van Pol ζ Kan gelijkaardige aanpassingen onthullen, die de vouw veranderen die door replicatieve polymerasen met hoge betrouwbaarheid wordt gebruikt om het enzym minder getrouw te maken en in staat om translesiesynthese uit te voeren.
belangenconflict verklaring
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
erkenning
Dit werk werd ondersteund door een subsidie van de National Institutes of Health (NCI R01 CA 52040).
















Geef een reactie