Introduction
chloroplasten vertegenwoordigen een structureel kenmerk van plantencellen en ondersteunen de overleving van planten via hun primaire metabolisme en functies op hoog niveau (Kirk and Tilney-Bassett, 1978; Mullet, 1988; López-Juez and Pyke, 2005). Tijdens de vegetatieve groei van planten bevatten bladcellen een zeer homogene populatie van chloroplasten wat grootte en vorm betreft., Het aantal chloroplasten per cel wordt bereikt door binaire splitsing van reeds bestaande organellen en verdeling in twee dochtercellen tijdens celdeling (Birky, 1983; Possingham en Lawrence, 1983). Aldus, is de verordening van het chloroplastaantal in een bepaald celtype essentieel voor de cellulaire functie en genetische overerving van chloroplasten.
om de aard van de bepaling van het chloroplastgetal in plantencellen te onderzoeken, hebben bladmesofylcellen van representatieve soorten een belangrijke rol gespeeld ., Deze cellen zijn fysiologisch belangrijk voor fotosynthese en vertonen een hoge mate van structurele en functionele homogeniteit. Vroege systematische observatieanalyses van geïsoleerde weefsels en cellen (Boasson and Laetsch, 1969; Possingham and Saurer, 1969; Boffey et al., 1979; Lamppa et al.,, 1980; Thomas and Rose, 1983; Pyke and Leech, 1991) leverde veel nuttige informatie over de bepaling van het chloroplastgetal, waaronder de notie dat chloroplasten (plastiden) niet de novo worden gesynthetiseerd, maar worden gerepliceerd door deling en de observatie dat bladmesofyl chloroplastgetal gevoelig is voor verschillende milieu-en plant-endogene factoren. Wat dit laatste betreft, heeft licht bij spinazie een positieve invloed op de verdeling van bladgroenten tijdens de kweek van de bladschijven in vergelijking met donkere of donkere omstandigheden (Possingham en Lawrence, 1983)., In de eerste bladeren van tarwe is het celvolume positief gecorreleerd met chloroplast proliferatie (Ellis and Leech, 1985; Pyke and Leech, 1987). In Arabidopsis, beïnvloedt de genetische achtergrond chloroplast proliferatie; het gemiddelde chloroplast Aantal per cel in eerste bladeren is 121 in het Landsberg erecta (Ler) ecotype en 83 in het wassilewskija (Ws) ecotype (Pyke and Leech, 1994; Pyke et al., 1994)., Blad mesophyll cellen hebben ook bijgedragen aan het begrijpen van de genetische controle van chloroplast Divisie; bijvoorbeeld, screening mutanten aangetast in chloroplast proliferatie en het karakteriseren van Gen functies betrokken bij chloroplast Divisie hebben geopenbaard meer dan 20 genen coderen chloroplast Divisie machine componenten of chloroplast regulerende factoren (Gao en Gao, 2011; Miyagishima et al ., 2011; Basak and Møller, 2013; Osteryoung and Pyke, 2014; Li et al., 2017).
daarentegen onderzoeken naar de replicatie van chloroplasten in niet-mesofylcellen (bijv.,, bestrating cellen in blad epidermis; Itoh et al., 2018) schaars zijn. Onlangs is gemeld dat de regulatie van chloroplast deling verschilt tussen bladweefsels (Fujiwara et al., 2018; Itoh et al., 2018), hoewel het gedetailleerde mechanisme onbekend blijft. Bovendien, terwijl de analyses van suspensie-gecultiveerd door-2 cellen en blad mesophyll protoplasten in tabak en schieten apicale meristem en blad primordiale cellen in Arabidopsis (Nebenführ et al., 2000; Sheahan et al.,, 2004; Seguí-Simarro en Staehelin, 2009) belangrijke inzichten hebben opgeleverd, hoe chloroplast (plastide) partitionering wordt gereguleerd in planten is nog onduidelijk. Ondanks aanzienlijke inspanningen blijven dus fundamentele vragen in het chloroplast-onderzoek bestaan, zoals (I) hoe wordt het chloroplast-Aantal per cel gecoördineerd in plantenweefsels en (ii) hoe wordt de chloroplast-partitionering geregeld bij celdeling.,
geschiedenis van het onderzoek naar Guard Cell Chloroplastgetal
stomatale GC ‘ s in de scheutepidermis bevatten over het algemeen chloroplasten en controlegasuitwisseling tussen het bladmesofyl en de atmosfeer (Sachs, 1875; Taiz et al., 2015; Zie figuur 1A). Het eerste onderzoek naar het aantal GC-chloroplast in bladeren werd meer dan een eeuw geleden uitgevoerd in natuurlijk geteelde Drosera-planten (Macfarlane, 1898)., Deze studie toonde aan dat, net als andere structurele kenmerken van planten en cellen, GC chloroplast Aantal per cel in een vermeende hybride afgeleid van een kruising tussen Drosera filiformis en Drosera intermedia tussen de twee soorten, wat impliceert dat GC chloroplast aantal kan worden gebruikt om de genetische samenstelling van een plant te bepalen. Belangrijke observaties werden vervolgens gerapporteerd over de verschillen in GC chloroplast aantal tussen plantensoorten (Sakisaka, 1929) en het relatief stabiele chloroplast aantal in GCs in de bladepidermis van moerbei (Morus spp.,; Hamada en Baba, 1930) en in volwassen bladeren van verschillende Brassica-soorten (Iura, 1934). Verder bleek uit analyse van autopolyploïde suikerbieten (Beta vulgaris) planten dat het GC chloroplastgetal in bladeren positief gecorreleerd is met het nucleaire ploïdie niveau van planten (Mochizuki en Sueoka, 1955). Vervolgens werden meer diepgaande en uitgebreide analyses uitgevoerd met behulp van verschillende plantmonsters om de relatie tussen het chloroplast-aantal en de stomatale grootte met het ploïdie-niveau te onderzoeken (bijv. Frandsen, 1968)., In deze analyses, chloroplast te tellen bij de stomatale (GC paar) niveau werd vaak aangenomen, die uitgesloten zijn van het effect van vooringenomen chloroplast verdeling tussen gekoppelde GCs (bijv., Mochizuki en Sueoka, 1955; Frandsen, 1968), waaruit blijkt dat de gemiddelde GC chloroplast-nummer in bladeren of zaadlobben in ongeveer 80 soorten, varianten of hybriden, variërend van 2,8 tot 40.0 in diploids (2×) en 5.0 van 73,5 in tetraploids (4×). Bovendien, hele-genoom duplicatie gebeurtenissen in planten (d.w.z., 1× tot 2×, 2× tot 4×, enz.) veroorzaakte een ongeveer 1.,7-voudige toename van het aantal GC-chloroplasten met hoge betrouwbaarheid (herzien in Butterfass, 1973). Deze resultaten moedigden onderzoek aan naar het ploïdiegehalte in verschillende weefsels en planten, verkregen via weefselkweek, kruising of natuurlijke teelt, in combinatie met chemische (b.v. colchicine) of stralingsbehandelingen (b. v. Jacobs en Yoder, 1989; Singsit en Veilleux, 1991; Qin en Rotino, 1995)., Hoewel het GC-chloroplastgetal is bestudeerd in stomatale biologie (Lawson, 2009) en cytologie om de chloroplastvermenigvuldiging te begrijpen (Butterfass, 1979; zie hieronder), heeft het grotendeels gediend als een betrouwbare en handige marker voor de detectie van hybriden, soorten en varianten en voor de schatting van ploidyniveaus van doelplantweefsels.
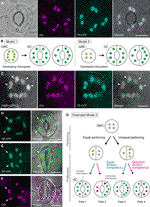
figuur 1 Simplified models and microscopy evidence for the control of chloroplast number in dental guard cells (GCS)., A) een typisch stoma-paar (GC-paar) in de abaxiale epidermis van het bladblad Arabidopsis dat een stoma-gerichte fusie van het transit peptide (TP) met cyaan fluorescerend eiwit (CFP; TP-CFP) tot expressie brengt. B) twee modellen voor de bepaling van het chloroplastgetal in GC ‘s, waarbij chloroplastpartitionering (model 1) of zowel chloroplastproliferatie als partitionering (model 2) betrokken zijn tijdens de ontwikkeling van GC uit guard moedercellen (GMC’ s). C) een GC-paar in adaxiale epidermis van Arabidopsis bladsteel die TP-CFP en FtsZ1 uitdrukken gesmolten aan de groene fluorescente proteã ne (GFP; FtsZ1-GFP)., (D-F) GC paren in abaxiale epidermis van het bladblad Arabidopsis met (D, E) of zonder (F) de expressie van TP gefuseerd met het gele fluorescerende eiwit (YFP; TP-YFP). F) chlorofyl autofluorescentie (Chl) werd gebruikt als chloroplastmerker., (G) uitgebreid model 2, dat de betrokkenheid vertegenwoordigt van gelijke en ongelijke verdeling van chloroplasten na GMC-deling en daaropvolgende verdeling van GC-chloroplasten met gelijke (blauwe lijn) of selectieve (rode lijn) verdeling competentie, wat zou resulteren in vier soorten chloroplastgetallen bepaling (Fates 1-4) tijdens late stomatale ontwikkeling van Arabidopsis bladeren. (A, C–F) Epifluorescentiemicroscopie werd uitgevoerd met een Olympus ix71 omgekeerde microscoop met behulp van plantaardige materialen zoals eerder beschreven (Fujiwara et al., 2017, Fujiwara et al., 2018)., Fluorescentiesignalen van chlorofyl, CFP, GFP, en YFP zijn pseudo-gekleurd in magenta, Cyaan, groen (in samengevoegd beeld slechts), en groen, respectievelijk. Indicaties in panelen zijn als volgt: pijlpunt, de ftsz1 ring; pijl, vergrote GC chloroplast; gestippelde lijn, celvorm. Schaalbalk = 10 µm.
Nut van Bladwachtcellen voor de analyse van de controle van het Chloroplastgetal
bladmesofylcellen worden al lang gebruikt als primair model voor de analyse van het chloroplastgetal., Hoewel zij voordelen hebben voor de studie van de effecten van omgevingscondities op de chloroplastverdeling (bijvoorbeeld de lichtcytokinine-signalering; Boasson and Laetsch, 1969; Possingham and Lawrence, 1983; Okazaki et al., 2009; Chiang et al., 2012), zijn ze in sommige opzichten beperkt. Ten eerste variëren de bladmesofylcellen in grootte en vorm en worden ze diep in het blad verdeeld, waardoor het moeilijk is om intacte weefsels te manipuleren., Ten tweede kan de gevoeligheid van bladmesofyl chloroplast proliferatie voor omgevingsstress en plantengroei omstandigheden betrouwbare vergelijkingen tussen studies voorkomen. Het blad mesophyll chloroplast Aantal per cel in Arabidopsis Columbia (Col) ecotype is gerapporteerd als 76 (Kinsman and Pyke, 1998), 80-100 (Stokes et al., 2000), 70 (Tirlapur en König, 2001), 41 (Yoder et al., 2007), 40-60 (Okazaki et al., 2009), en 30-40 (Kawade et al., 2013)., Bovendien is het bijna onmogelijk om de bijdrage van chloroplast partitionering aan het uiteindelijke chloroplast Aantal per mesofyl cel tijdens de bladontwikkeling te beoordelen, hoewel dit wordt verondersteld te worden bepaald door de balans tussen de snelheid van celdeling en de snelheid van chloroplast deling. Om het mechanisme van chloroplastgetal controle in vegetatieve bladcellen te ontdekken, is een modelsysteem vereist dat de bovengenoemde kwesties overwint.
stomatale GCs (zie figuur 1A) vertonen de kenmerken van een modelsysteem om het mechanisme van de controle van het chloroplastgetal te begrijpen., GCs is hoogst uniform in grootte en vorm binnen een weefsel, en hun verspreide maar dichte distributie in de buitenste laag van scheuten vergemakkelijkt hun opsporing door lichte en fluorescentiemicroscopie. GCs worden ook afgeleid van protodermale cellen in de scheut apicale meristem of van embryonale epidermale cellen, en hun ontwikkelingsvolgorde door meristemoïden (een stomatale voorloper met meristematische activiteit) en guard moedercellen (GMCs; een voorloper van GC paren) wordt in detail vastgesteld (Zhao en Sack, 1999; Nadeau en Sack, 2002; Kalve et al., 2014)., De Late stomatale ontwikkeling impliceert één ronde van symmetrische GMC verdeling, die de beoordeling van chloroplastdistributie en het verdelen vóór en na cytokinesis toelaat. Vanuit het perspectief van praktische experimenten, zijn blad GCs geschikt voor Microscopie. Eerder werd aangetoond dat het chloroplast Aantal per cel in blad GCs van Sinapis alba minder werd beïnvloed door verschillende lichtomstandigheden dan die in blad mesofyl cellen (Wild and Wolf, 1980)., Daarnaast is het verschil in GC chloroplast aantal in bladstelen relatief klein onder de drie Arabidopsis ecotypen Col, Ler, en Ws (Fujiwara et al., 2018). Bovendien, endoreduplicatie, die de ontwikkeling van blad mesofyl beà nvloedt, bestrating, en trichoomcellen, is niet gedetecteerd in Arabidopsis blad GCs (Melaragno et al., 1993), die de interpretaties van chloroplast aantal gegevens op het 2C niveau van cellen zou verzekeren., Samen, suggereren deze rapporten dat blad GCs potentieel een uitstekend model voor de systematische analyse van chloroplast aantaldynamica in een bepaalde cellijn zijn.
Arabidopsis Leaf Guard Cells als Model voor het bestuderen van de controle van het Chloroplastgetal
In de geschiedenis van het onderzoek naar GC-chloroplasten heeft het tellen van chloroplasten op stomataal niveau (GC-paar) een even belangrijke rol gespeeld bij het bepalen van het chloroplastgetal als het tellen op het individuele GC-niveau. Beide methoden produceren hetzelfde gemiddelde chloroplastgetal (Butterfass, 1973)., Wanneer de variatie in chloroplastdistributie in in paren gerangschikt GCs en zijn onderliggend mechanisme een onderwerp van nadruk is, is de gedetailleerde informatie van chloroplasten op het individuele celniveau, d.w.z., hun grootte, vorm, en intracellular localisatie, essentieel. Chloroplast (plastid) proliferatie tijdens de GMC–GC differentiatie werd eerder onderzocht in verschillende plantensoorten (Butterfass, 1973, Butterfass 1979)., Deze studies stelden twee modellen voor voor het bepalen van het terminale chloroplastgetal in GC ‘ s in verschillende plantensoorten (figuur 1B): een (model 1; suikerbiet) betreft alleen de verdeling van chloroplast bij GMC-verdeling, en de andere betreft niet alleen de verdeling van chloroplast maar ook de proliferatie van chloroplast tijdens de ontwikkeling van GC.
In het tijdperk van moleculaire genetica, genomica, celbeeldvorming en andere interdisciplinaire analyses zijn er vele mogelijkheden voor de verdere karakterisering van het chloroplastpartitioneringsmechanisme., Arabidopsis leaf GCs kan een van de beste modelsystemen voor dit doel. Verschillende studies hebben het GC chloroplastgetal in de bladeren of cotyledons van Arabidopsis onderzocht (Hoffmann, 1968; Pyke and Leech, 1994; Pyke et al., 1994; Robertson et al., 1995; Keech et al., 2007; Chen et al., 2009; Yu et al., 2009; Higaki et al., 2012; Fujiwara et al., 2018). Deze GCs vertonen een bescheiden aantal chloroplasten, variërend van 3,5 tot 5,5 gemiddeld. Tot op heden hebben geen studies de veranderingen in chloroplast (plastid) aantal tijdens stomatale ontwikkeling onderzocht., Echter, microscopisch bewijs van stomatale ontwikkeling analyses (e.g., Zhao and Sack, 1999; Hachez et al., 2011) en onze voorlopige waarnemingen geven aan dat GMC ’s kleinere aantallen zich ontwikkelende chloroplasten kunnen bevatten dan GC’ s en dat chloroplastproliferatie kan optreden tijdens GC-differentiatie. Om dit te testen, werd de vorming van de machines van de chloroplast divisie in GCs gecontroleerd met de sonde ftsz1 gesmolten aan de groene fluorescente proteã ne (FtsZ1-GFP) (Fujiwara et al., 2008)., Een transgene lijn, gelijktijdig uitdrukkend transitpeptide (TP)-fused CFP en FtsZ1-GFP om stroma en ftsz1-ring te visualiseren, respectievelijk, werd onderzocht door epifluorescentiemicroscopie (Fujiwara et al., 2017). Er werd gebruik gemaakt van uitzettende bladstelen (vijfde blad van 4 weken oude zaailingen). Als gevolg hiervan werden GCs met symmetrisch vernauwende chloroplasten gedetecteerd (figuur 1C). Deze chloroplasten vormden de FtsZ1-ring, een chloroplastafdelingsring op het stromale oppervlak van het membraan in bladmesofyl en bestrating cellen (Vitha et al., 2001; Fujiwara et al.,, 2008), op de equatoriale vernauwing. Consistent met het stomatale patroon in Arabidopsis bladontwikkeling (Donnelly et al., 1999; Andriankaja et al., 2012), werden delende chloroplasten ontdekt in het late en vroege stadium van de bladuitzetting. Model 2 is dus waarschijnlijk het beste geschikt voor Arabidopsis leaf GCs.
relatie tussen chloroplast proliferatie en expansie in Arabidopsis blad Guard cellen
bovendien werd een onverwacht fenotype van GC chloroplast morfogenese waargenomen in volwassen GCs (figuren 1D, E)., Wanneer epidermale schillen van volledig geëxpandeerde bladeren (derde–vierde bladbladen van 4 weken oude zaailingen) uit een TP-fused yellow fluorescent protein (YFP) lijn werden microscopisch gekarakteriseerd (FL6-5 lijn; Fujiwara et al., 2018), vertoonden sommige stomata ongelijke chloroplast distributiepatronen in GC paren, terwijl de meeste bladmondata gelijke of vergelijkbare chloroplast distributiepatronen vertoonden (Robertson et al., 1995; Fujiwara et al., 2018)., Binnen het GC-paar van een stoma was de grootte van chloroplasten in het GC met kleinere aantallen chloroplasten groter dan in het andere GC ‘ s in het paar met grotere aantallen chloroplasten (figuren 1D, E). Op deze manier, GCS handhaaft waarschijnlijk het totale chloroplast volume per cel op een constant niveau tijdens celgroei. Vergrote chloroplasten vertegenwoordigden het terminale fenotype en konden zich niet langer in geëxpandeerde bladeren verdelen. Deze resultaten werden bevestigd in verschillende onafhankelijke experimenten, ongeacht de expressie van een TP-gefuseerd fluorescerend eiwit voor stroma-etikettering (figuur 1F).,
Dit GC-chloroplast-fenotype wordt geïnterpreteerd als een compensatiemechanisme voor chloroplast-expansie, dat goed gedocumenteerd is in bladmesofylcellen die defect zijn in de controle van chloroplast-deling (Pyke and Leech, 1994; Pyke et al., 1994). Tot op heden heeft slechts één studie (Ellis en bloedzuiger, 1985) een negatieve correlatie gemeld tussen het chloroplast-aantal en de chloroplast-grootte in bladmesofylcellen van tarwe, terwijl veel studies een positieve correlatie hebben gemeld tussen het celvolume en het chloroplast-aantal in normale bladmesofylcellen (bloedzuiger en Pyke, 1988; Pyke, 1997)., Overwegende dat onevenwichtigheden in GC chloroplastgetal optreden bij lage frequentie (Fujiwara et al., 2018), chloroplast heterogeniteit in GC paren geeft aan dat ongelijke chloroplast partitionering differentiële chloroplast groei tussen wild-type bladcellen in Arabidopsis zou kunnen veroorzaken, ondanks symmetrische celdeling.
het chloroplastcompensatieeffect bij GCs kan minder streng zijn dan bij bladmesofylcellen., GCs zou schaarste of volledig verlies van totale chloroplast volume per cel kunnen weerstaan in ernstig verminderde chloroplast Divisie mutanten, zoals in Arabidopsis arc6 en atminE1 en tomaat suffulta, terwijl veel gemuteerde GCs verminderde chloroplast aantal en vergrote chloroplast grootte vergelijkbaar met de blad mesofyl cellen (Robertson et al., 1995; Forth and Pyke, 2006; Chen et al., 2009; Fujiwara et al., 2018)., In een late chloroplast-delingsmutant, arc5, werd de vermindering van het aantal GC-chloroplast niet geassocieerd met een significante toename van de chloroplast-grootte, in tegenstelling tot de bladmesofylcellen (Pyke and Leech, 1994). A lower degree of chloroplast expansion in GCs than in mesophyll cells (Pyke and Leech, 1994; Barton et al., 2016), en de variatie in chloroplastuitbreiding onder GC ‘s, kan ten grondslag liggen aan zo’ n breed toelaatbaar bereik van het totale chloroplastvolume per GC., Bovendien kan de timing van chloroplast deling tijdens GMC–GC differentiatie een significante invloed hebben op het terminale GC chloroplast fenotype. Hoewel verdere gedetailleerde karakterisering nodig is om dit probleem aan te pakken, lijkt het aannemelijk dat Arabidopsis leaf GCs een systeem is om de onontgonnen aspecten van chloroplastgetal controle in plantaardige cellen te onderzoeken.,
een werkmodel voor de bepaling van het Chloroplastgetal in Arabidopsis Leaf Guard cellen
op basis van het bovenstaande stellen we een werkmodel voor (een uitgebreid model 2) voor de analyse van het chloroplastgetal in GCs (figuur 1G). Het uiteindelijke chloroplastgetal per GC wordt bepaald door chloroplastverdeling bij GMC-deling en chloroplastproliferatie in GC ‘ s. Tijdens GMC deling, kunnen chloroplasten of gelijke of ongelijke verdeling ondergaan. Tijdens de chloroplastproliferatie zullen GC-chloroplasten zich vermenigvuldigen met ofwel een gelijke (blauwe lijn) ofwel een selectieve (magenta lijn) delingscompetentie., Bijvoorbeeld, als gelijk verdeelde chloroplasten gelijkwaardige delingscompetentie bezitten, zullen gelijke chloroplastgetallen voorkomen in het GC-paar (Fate 1). Als ongelijk verdeelde chloroplasten gelijkwaardige delingscompetentie bezitten, zullen chloroplasten met dezelfde snelheid toenemen binnen het GC-paar (Fate 3). Als selectieve chloroplast deling optreedt in GCs, zal de balans van het chloroplast getal in het GC paar veranderen na GMC deling (Fates 2 en 4)., Het is momenteel moeilijk om steun te vinden voor” selectieve chloroplast deling, ” maar als Lot 1 en 4 eigenlijk overheersen in GCs, dan kunnen zij een mechanisme bezitten dat het totale chloroplast volume per cel controleert, zoals in blad mesofyl cellen. Het model roept twee problemen op: (i) zijn GC-chloroplasten goed verdeeld in dochtercellen en hoe partitioneren ze? En (ii) is de afdelingscompetentie van GC-chloroplasten gecoördineerd geregeld?,
met betrekking tot de kwestie (i) is het al lang een zorg geweest of er sprake is van overerving van chloroplasten door willekeurige verdeling van meerdere chloroplasten in het cytoplasma of door positief chloroplastpartitioneringsmechanisme(s) (Butterfass, 1969; Birky, 1983; Hennis and Birky, 1984; Nebenführ, 2007; Sheahan et al., 2016). Intrigerend, in Arabidopsis arc6, blad of cotyledon GCs hebben nul tot drie chloroplasten, en in chloroplast-deficiënte GCs, niet-fotosynthetische plastiden bestaan nog steeds in vesiculaire tot langwerpige vormen (Robertson et al ., 1995; Chen et al., 2009; Fujiwara et al., 2018)., In arc6 zijn geen GCs zonder plastiden per se gevonden en er is geen verklaring voor gevonden, ondanks de verstoring van het chloroplast-delingsapparaat (Vitha et al., 2003). Daarom zal het belangrijk zijn om de replicatie en morfologie van arc6 chloroplasten in stomatale lijn studies te onderzoeken. Arabidopsis mutant onderzoek kan ook een andere aanwijzing voor deze kwestie., De observatie dat 18% van cotyledon GCs in de kreukelde blad (crl) mutant bevatten geen plastidic structuren in het cytoplasma, terwijl 100% van de blad mesofyl cellen bevatten een tot vier vergrote chloroplasten (Asano et al., 2004; Chen et al., 2009), is van groot belang. CRL is een chloroplast buitenste-envelop eiwit met een onbekende functie. Het begrijpen van CRL eiwitfunctie kan inzicht in het mechanisme(s) van chloroplast het verdelen verstrekken., De analyse van chloroplast proliferatie en partitionering in blad mesophyll cellen in Arabidopsis arc mutanten en andere transgene lijnen heeft onderzoek naar de proliferatie en partitionering van niet-mesophyll plastiden bevorderd. Evenzo, resultaten verkregen in GCs kunnen overdraagbaar zijn naar andere celsystemen.
slotopmerking
het GC-model opent vele perspectieven voor de ontwikkeling van de chloroplastbiologie. Bijvoorbeeld, terwijl cytoskeletal systemen gekend zijn om chloroplast morfologie, beweging, en het verdelen te regelen (Sheahan et al.,, 2016; Wada, 2016; Erickson and Schattat, 2018), heeft de rol van elk regulerend gen in chloroplast proliferatie en partitionering in planten weinig aandacht gekregen. Aan de andere kant, zodra het mogelijk wordt om GC chloroplast Aantal of morfologie via diverse experimentele strategieën te schaden, kunnen nieuwe inzichten in de moleculaire controle van chloroplast morfogenese in stomatale geslachtscellen worden verstrekt. Bovendien, in combinatie met kwantitatieve analyses van chloroplast nummer tijdens stomatale ontwikkeling, wiskundige modellering kan een nieuwe weg voor deze onderzoeken bieden., Dit artikel presenteert de huidige kennis van hoe GC chloroplast nummer wordt gecontroleerd en benadrukt de potentiële bruikbaarheid van Arabidopsis blad GCs voor het begrijpen van chloroplast proliferatie en partitionering.
data Availability Statement
alle datasets voor deze studie zijn opgenomen in het artikel/ aanvullend materiaal.
Auteursbijdragen
MF bedacht de studie en schreef het manuscript. MF en zoals uitgevoerd de experimenten. AS en RI hebben de analyses uitgevoerd. Alle auteurs hebben het definitieve manuscript gelezen en goedgekeurd.,
financiering
Dit werk werd gesteund door het Japanse Ministerie van Onderwijs, Cultuur, Wetenschap en technologie in het kader van KAKENHI (subsidie nr. 19K05831 aan MF en 18K06314 aan RI).
belangenconflict
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
Dankbetuigingen
De auteurs danken Dr.Nobuyuki Kanzawa (Sophia University) voor advies over het werk.
Birky, C. W., Jr. (1983)., Het verdelen van cytoplasmic organellen bij celdeling. Int. Rev. Cytol. 15, 49-86.
Google Scholar
butter churn, T. (1969). De plastideverdeling in mitose van de sluitende moedercellen van de haploïde swedenklee (Trifolium hybridum L.). Planta 84, 230-234. doi: 10.1007 / BF00388108
PubMed Abstract | CrossRef Full Text | Google Scholar
butter churn, T. (1973). Controle van de plastide deling door middel van nucleaire DNA hoeveelheid. Protoplasma 76, 167-195. doi: 10.,1007/BF01280696
CrossRef Full Text | Google Scholar
Qin, X., Rotino, G. L. (1995). Chloroplast number in guard cells as ploidy indicator of in vitro-grown androgenic pepper plantlets. Plant Cell Tissue Organ Cult. 41, 145–149. doi: 10.1007/BF00051583
CrossRef Full Text | Google Scholar
Sachs, J. (1875). Textbook of Botany. Oxford: Clarendon Press.
Google Scholar
Thomas, M. R., Rose, R. J. (1983)., Plastid aantal en plastid structurele veranderingen geassocieerd met tabak mesophyll protoplast cultuur en plantenregeneratie. Planta 158, 329-338. doi: 10.1007 / BF00397335
PubMed Abstract / CrossRef Full Text / Google Scholar
Tirlapur, U. K., König, K. (2001). Femtoseconde near-infrared lasers as a novel tool for non-invasive real-time high-resolution time-lapse imaging of chloroplast division in living bundle sheath cells of Arabidopsis. Planta 214, 1-10. doi: 10.,1007/s004250100597
PubMed Abstract | CrossRef Full Text/Google Scholar
Wild, A., Wolf, G. (1980). Het effect van verschillende lichtintensiteiten op de frequentie en grootte van stomata, de grootte van cellen, het aantal, de grootte en het chlorofylgehalte van chloroplasten in de mesofyl en de guardcellen tijdens de ontogenie van primaire bladeren van Sinapis alba. Z. Pflanzenphysiol. Bd. 97, 325–342. doi: 10.1016 / S0044-328X(80)80006-7
CrossRef Full Text / Google Scholar
















Geef een reactie