naarmate de temperatuur toeneemt, neemt ook de snelheid van de enzymreacties toe. Een temperatuurstijging van tien graden zal de activiteit van de meeste enzymen met 50% tot 100% verhogen. Variaties in reactietemperatuur zo klein als 1 of 2 graden kunnen veranderingen van 10% tot 20% in de resultaten. Deze toename is slechts tot een bepaald punt totdat de verhoogde temperatuur de structuur van het enzym breekt. Zodra het enzym gedenatureerd is, kan het niet worden gerepareerd., Aangezien elk enzym in zijn structuur en verbindingen tussen aminozuren en peptiden verschillend is, is de temperatuur voor denaturering specifiek voor elk enzym. Omdat de meeste dierlijke enzymen bij temperaturen boven 40°C snel gedenatureerd worden, worden de meeste enzymbepalingen iets onder die temperatuur uitgevoerd.
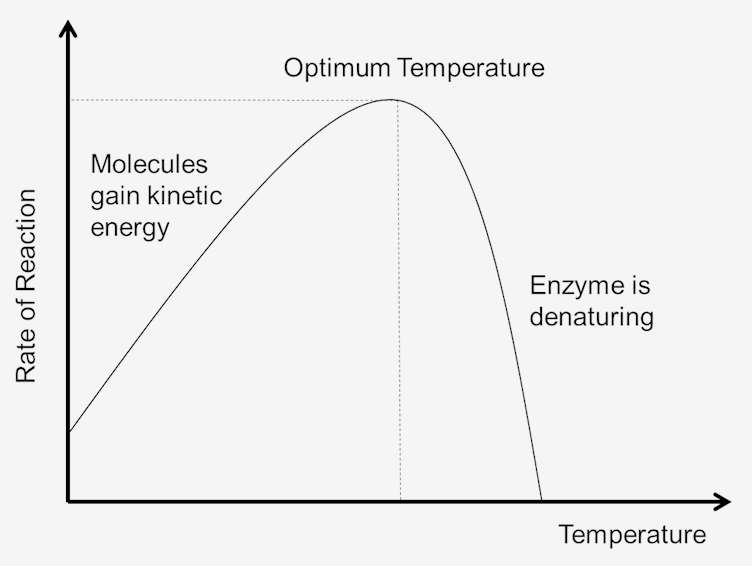 figuur 1. Effect van temperatuur op reactiesnelheid.
figuur 1. Effect van temperatuur op reactiesnelheid.
gedurende een bepaalde periode worden enzymen gedeactiveerd bij zelfs matige temperaturen. De opslag van enzymen bij 5°C of lager is over het algemeen het meest geschikt. Lagere temperaturen leiden tot tragere chemische reacties., Enzymen zullen uiteindelijk inactief worden bij vriestemperaturen, maar zullen het grootste deel van hun enzymactiviteit herstellen wanneer de temperaturen weer stijgen, terwijl sommige enzymen hun activiteit verliezen wanneer ze bevroren zijn.
kinetische energie en interne energie
De temperatuur van een systeem is tot op zekere hoogte Een maat voor de kinetische energie van de moleculen in het systeem. Botsingen tussen alle moleculen nemen toe naarmate de temperatuur stijgt. Dit is te wijten aan de toename van snelheid en kinetische energie die volgt temperatuurstijgingen. Met hogere snelheden, zal er minder tijd tussen botsingen., Dit resulteert in meer molecules die de activeringsenergie bereiken, die het tarief van de reacties verhoogt. Omdat de moleculen ook sneller bewegen, nemen botsingen tussen enzymen en substraten ook toe. Dus hoe lager de kinetische energie, hoe lager de temperatuur van het systeem en, evenzo, hoe hoger de kinetische energie, hoe groter de temperatuur van het systeem.
naarmate de temperatuur van het systeem toeneemt, neemt de interne energie van de moleculen in het systeem toe., De interne energie van de molecules kan de Vertalende energie, trillingsenergie en rotatieenergie van de molecules omvatten, de energie betrokken bij chemische binding van de molecules evenals de energie betrokken bij niet-bindende interactie. Een deel van deze warmte kan worden omgezet in chemische potentiële energie. Als deze chemische potentiële energieverhoging groot genoeg is, kunnen sommige zwakke bindingen die de driedimensionale vorm van de actieve eiwitten bepalen, worden gebroken. Dit kan tot thermische denaturatie van de proteã ne leiden en zo de proteã ne inactiveren., Aldus kan te veel hitte het tarief van een enzym-gekatalyseerde reactie veroorzaken om te verminderen omdat het enzym of substraat gedenatureerd en inactief wordt.
optimale temperatuur
elk enzym heeft een temperatuurbereik waarin een maximale reactiesnelheid wordt bereikt. Dit maximum staat bekend als het temperatuuroptimum van het enzym. De optimale temperatuur voor de meeste enzymen is ongeveer 98,6 graden Fahrenheit (37 graden Celsius). Er zijn ook enzymen die goed werken bij lagere en hogere temperaturen., Arctische dieren hebben bijvoorbeeld enzymen die zijn aangepast aan lagere optimale temperaturen; dieren in woestijnklimaten hebben enzymen die zijn aangepast aan hogere temperaturen. Echter, enzymen zijn nog steeds eiwitten, en zoals alle eiwitten, beginnen ze af te breken bij temperaturen boven de 104 graden Fahrenheit. Daarom wordt het bereik van enzymactiviteit bepaald door de temperatuur waarbij het enzym begint te activeren en de temperatuur waarbij het eiwit begint te ontbinden.,
gerelateerde diensten
Enzymkinetiek
Enzymologische Assays
om meer service details te bespreken, kunt u contact met ons opnemen door te bellen naar 1-631-562-8517, of ons te mailen naar: [email protected].
















Geef een reactie