prise en charge de l’alloimmunisation maternelle
en règle générale, les titres d’anticorps maternels en série sont surveillés jusqu’à ce qu’un titre critique de 1: 32 indique À ce stade, le fœtus nécessite une surveillance très intense des signes d’anémie et d’hydrops fœtaux., Dans L’alloimmunisation de Kell, hydrops peut se produire à des titres maternels faibles en raison de l’érythropoïèse supprimée, et, par conséquent, un titre de 1:8 a été suggéré comme critique. Par conséquent, les valeurs delta-OD 450 ne sont pas fiables pour prédire la gravité de la maladie dans L’alloimmunisation de Kell.
les titres maternels ne sont pas utiles pour prédire l’apparition de l’anémie fœtale après la première gestation affectée. De grandes différences de titre peuvent être observées chez le même patient entre différents laboratoires, et une technique de gel plus récente produit des résultats de titre plus élevés que l’ancienne méthode du tube., Par conséquent, la méthode standard de tube devrait être utilisée pour déterminer le titre critique, et un changement de plus de 1 dilution représente une véritable augmentation du titre d’anticorps maternel. Pour tous les anticorps responsables de la maladie hémolytique du nouveau-né (HDN), une augmentation de 4 fois de tout titre d’anticorps est généralement considérée comme un changement significatif nécessitant une évaluation fœtale.
lorsque cela est indiqué, l’amniocentèse peut être réalisée dès 15 semaines de gestation (rarement nécessaire lors de la première grossesse touchée avant 24 semaines de gestation) pour déterminer le génotype fœtal et en évaluer la gravité., Les échantillons de sang maternel et paternel doivent être envoyés au Laboratoire de référence avec un échantillon de liquide amniotique pour éliminer les résultats faussement positifs (provenant du pseudogène maternel ou du gène Ccde) et faussement négatifs (provenant d’un réarrangement au locus du gène RHD chez le père).
la détermination du génotype RH fœtal dans le plasma maternel est devenue courante dans de nombreux pays européens et est proposée aux États-Unis., L’ADN sans cellules fœtales représente 3% de l’ADN plasmatique maternel circulant total, est trouvé dès 38 jours de gestation et provient de l’apoptose de la couche de cytotrophoblaste placentaire. La demi-vie moyenne de L’ADN fœtal circulant est en moyenne inférieure à 30 minutes, et le plasma maternel est soumis à une filtration et à une microcentrifugation pour éliminer tous les éléments cellulaires avant le test. Cela élimine les résultats faussement positifs des cellules fœtales greffées de grossesses antérieures dans les organes lymphoïdes maternels.,
L’ADN fœtal sans cellules est soumis à une réaction en chaîne par polymérase (PCR) en temps réel pour détecter la présence de séquences spécifiques au gène RHD et s’est avéré précis dans 99,5% des cas. Le gène SRY (chez le fœtus masculin) et les polymorphismes de l’ADN dans la population générale (chez le fœtus féminin) sont utilisés comme contrôles internes pour confirmer l’origine fœtale de l’ADN sans cellules. Un panel de 92 polymorphismes mono-nucléotidiques (SNP) est comparé entre l’échantillon maternel de buffy coat et le plasma., Une différence de plus de 6 SNPs confirme la présence d’ADN fœtal et la validité du test chez un fœtus féminin. Les résultats faussement négatifs étant les plus indésirables et consécutifs sont dus à des phénotypes d partiels ou faibles. Ils sont détectés en utilisant au moins deux amorces exon spécifiques à RHD et exécutés en doublons.
heureusement, les tests d’ADN fœtal sans cellules pour déterminer le génotype d’autres antigènes de globules rouges tels que c,C, e, E et Kell se révèlent également très fiables et précis.,
l’amniocentèse en série est commencée à des intervalles de 10 à 14 jours pour surveiller la gravité de la maladie chez le fœtus. Toutes les tentatives doivent être faites pour éviter le passage transplacentaire de l’aiguille qui peut entraîner une hémorragie fœtomaternale (FMH) et une augmentation supplémentaire du titre d’anticorps. Les valeurs en série delta-OD 450 sont tracées sur la carte Queenan ou la carte Liley étendue pour évaluer le risque d’hydrops fœtaux. Une échographie précoce est effectuée pour établir l’âge gestationnel correct., Une surveillance ultrasonographique fréquente est également effectuée pour évaluer le bien-être fœtal et détecter une anémie modérée et des signes précoces d’hydrops.
la vitesse Doppler systolique maximale de l’artère cérébrale moyenne (MCA) s’est révélée être un outil de dépistage fiable pour détecter l’anémie fœtale et a remplacé l’amniocentèse. Le MCA est facilement visualisé avec le Doppler à flux de couleur; le Doppler pulsé est ensuite utilisé pour mesurer la vitesse systolique maximale juste distale de sa bifurcation de l’artère carotide interne., Parce que la vitesse de MCA augmente avec l’avancement de l’âge gestationnel, le résultat est rapporté en multiples de médiane (mamans). Dans des études récentes, la sensibilité à la détection de l’anémie fœtale modérée et sévère s’est avérée être de 100%, avec un taux de faux positifs de 10% à 1,5 maman. Il a été démontré qu’il réduit le besoin de procédures de diagnostic invasives telles que l’amniocentèse et la cordocentèse de plus de 70%.
Les études Doppler MCA peuvent commencer dès 18 semaines de gestation mais ne sont pas fiables après 35 semaines de gestation., Il a également été utilisé pour chronométrer la transfusion fœtale ultérieure et pour diagnostiquer l’anémie de causes multiples, comme dans la transfusion twin-twin. La pente MCA à partir de lectures hebdomadaires 3 est maintenant utilisée pour prédire le risque fœtal d’anémie sévère (voir l’image ci-dessous).
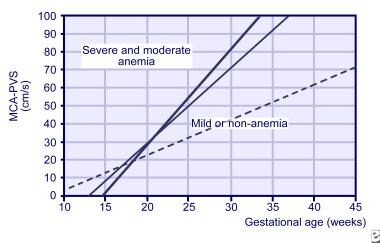 pentes pour la vitesse systolique maximale dans l’artère cérébrale moyenne (MCA) pour les fœtus normaux (ligne pointillée), les fœtus légèrement anémiques (ligne mince) et les fœtus gravement anémiques (ligne épaisse).,
pentes pour la vitesse systolique maximale dans l’artère cérébrale moyenne (MCA) pour les fœtus normaux (ligne pointillée), les fœtus légèrement anémiques (ligne mince) et les fœtus gravement anémiques (ligne épaisse)., avec l’acquisition de l’expérience dans la réalisation de L’étude Doppler MCA, l’amniocentèse en série pour détecter l’anémie fœtale a été utilisée dans une moindre mesure.
pendant la période où la transfusion péritonéale intra-utérine était le seul moyen de traitement, les nouveau-nés étaient systématiquement mis au monde à 32 semaines de gestation. Cette approche a entraîné une incidence élevée de maladies membranaires hyalines et de transfusions d’échange., Avec l’avènement de la transfusion intravasculaire (IVT) in utero, l’approche générale pour le fœtus gravement atteint consiste à effectuer une IVT au besoin jusqu’à 35 semaines de gestation, l’accouchement étant prévu à terme. L’établissement de la maturité pulmonaire est difficile chez ces fœtus en raison de la contamination du liquide amniotique par du sang résiduel pendant la transfusion; cependant, si l’accouchement est prévu avant 34 semaines de gestation, l’administration de stéroïdes maternels pour améliorer la maturité pulmonaire fœtale est indiquée.,
en outre, les niveaux excessifs de bilirubine de liquide amniotique provoquent une fausse élévation sur le test de maturité pulmonaire fœtale TDX dépolarisation par fluorescence, version II (TDX-FLMII); par conséquent, d’autres tests pour déterminer la maturité pulmonaire fœtale devraient être utilisés, tels que la spectroscopie infrarouge, le nombre de corps lamellaires, la quantification du phosphatidylglycérol ou le rapport lécithine/sphingomyéline (L / S).
Liley a décrit pour la première fois la transfusion intrapéritonéale (IPT) en 1963. Une aiguille Tuohy est introduite dans la cavité péritonéale fœtale sous guidage ultrasonographique., Un cathéter péridural est enfilé à travers l’aiguille. Un milieu radio-opaque est injecté dans le péritoine fœtal. Le placement correct est confirmé par la délimitation à l’extérieur de l’intestin ou sous le diaphragme ou par diffusion dans l’ascite fœtale.,ss de moins de 4 jours, groupe O, Rh négatif, Kell négatif, leucoréducé, irradié avec 25 Gy pour prévenir la maladie du greffon contre l’hôte et apparié avec du sérum maternel sont injectés dans des aliquotes de 10 mL à un volume calculé par la formule suivante:
IPT volume = (gestation en semaines-20) × 10 mL
l’hémoglobine résiduelle (HB) chez le fœtus est estimée pour permettre un espacement approprié de l’IPT et la sélection de la gestation de l’accouchement par la formule suivante:
HB g/dl = 0.,85/125 × a / b × 120-c/120
dans la formule, a est la quantité de RBC HB du donneur transfusée, b est le poids corporel fœtal estimé et c est l’intervalle en jours entre le moment de la transfusion et le moment de l’estimation de l’Hb du donneur.
L’IPT est répété lorsque L’Hb fœtale est estimée à 10 g / dL. Habituellement, un deuxième IPT est effectué 10 jours après la première transfusion afin d’élever L’Hb au-dessus de 10 g/dL. Ensuite, une autre transfusion est effectuée toutes les 4 semaines jusqu’au moment de l’accouchement prévu à 34-35 semaines de gestation., Des mouvements diaphragmatiques fœtaux sont nécessaires pour que l’absorption de RBC se produise. Cette approche n’a aucune valeur pour un fœtus moribond qui ne respire pas. Les complications maternelles comprennent l’infection et l’hémorragie transplacentaire, tandis que les complications fœtales sont la surtransfusion, l’exsanguination, la tamponnade cardiaque, l’infection, le travail prématuré et la maladie du greffon contre l’hôte. Les taux de survie après IPT ont approché environ 75% avec l’aide de l’échographie.,
L’IVT Directe est devenue une voie privilégiée d’intervention fœtale en raison du taux plus élevé de complications et de l’efficacité limitée de L’IPT chez un fœtus hydropique. Rodeck a réalisé avec succès IVT en 1981. Avec un guidage ultrasonographique, une aiguille de calibre 20-22 est introduite dans une veine ombilicale au niveau de l’insertion du cordon dans le placenta ou dans sa partie intrahépatique, et un échantillon de sang fœtal est obtenu. L’échantillon de sang est confirmé d’origine fœtale par un test de dénaturation alcaline rapide., Tous les tests fœtaux pertinents (par exemple, groupe sanguin, test d’anticorps direct, numération des réticulocytes, numération plaquettaire, taux D’Hb, taux D’Hct, taux d’albumine sérique, taux d’érythropoïétine) sont effectués. Si le taux de Hb est inférieur à 11 g/dL ou si le taux de Hct est inférieur à 30%, un IVT est démarré. La position de l’aiguille est confirmée en notant la turbulence dans le vaisseau fœtal lors de l’injection de solution saline. Le fœtus est fréquemment paralysé avec du pancuronium et reçoit du fentanyl 10 mcg / kg pour empêcher le déplacement de l’aiguille par les mouvements fœtaux., La médication maternelle varie de l’anesthésique local seulement, à l’indométacine de routine et à la sédation consciente, à l’analgésie épidurale spinale.
la transfusion est effectuée dans des aliquotes de 10 mL à un volume d’environ 50 mL/kg de poids corporel estimé par échographie ou jusqu’à ce qu’un taux D’Hct de 40% soit atteint. La procédure est rapidement interrompue si une décompensation cardiaque est notée sur les résultats de l’échographie., Les fœtus sévèrement anémiques ne tolèrent pas la correction aiguë de leur Hct aux valeurs normales, et le Hct initial ne doit pas être augmenté de plus de 4 fois au moment de la première IVT. Ils doivent ensuite être surveillés tous les 2-7 jours. L’IVT est répété lorsqu’il atteint une valeur qui reflète l’anémie critique chez le fœtus. Une perte de 1% de cellules transfusées par jour peut être anticipée.
certains centres effectuent des transfusions répétées à des intervalles de 10 jours, 2 semaines et toutes les 3 semaines. D’autres transfusent sur la base d’une baisse anticipée de l’hémoglobine fœtale de 0,4 g/dL/jour, 0,3 g/dL/jour et 0.,2 g / dL / jour pour les premier, deuxième et troisième intervalles de transfusion, respectivement. La vitesse maximale de MCA systolique a été utilisée pour chronométrer la deuxième transfusion, avec un seuil de 1,32 MOM. Après la première transfusion intra-utérine, la présence de globules rouges avec de l’hémoglobine adulte supprime l’érythropoïèse et améliore l’apport en oxygène, ce qui est responsable de la mauvaise corrélation entre la vitesse maximale de MCA et la gravité de l’anémie fœtale. Certains centres ont trouvé un effet bénéfique de la transfusion combinée IVT et IPT sur l’intervalle pour répéter la transfusion.,
en plus des complications de L’IPT, une bradycardie fœtale transitoire, un hématome du cordon, une compression de la veine ombilicale et une mort fœtale ont été rapportés au cours de L’IVT. Cependant, IVT présente de nombreux avantages, y compris la correction immédiate de l’anémie et la résolution des hydrops fœtaux, la réduction du taux d’hémolyse et l’hyperinsulinémie subséquente, et l’accélération de la croissance fœtale pour les fœtus non hydropes qui sont souvent retardés de croissance. L’IVT est la seule intervention disponible pour les fœtus hydropiques moribonds et ceux ayant un placenta antérieur. Le risque de perte fœtale est d’environ 0,8% avec IVT versus 3.,5% par procédure pour IPT, et le taux de survie global est de 88%.
Les globules rouges maternels récemment lavés ont été utilisés avec succès comme source de globules rouges antigéniques négatifs en cas d’incompatibilité rare, mais ont également été couramment utilisés en raison des avantages tels que la diminution du risque de sensibilisation aux nouveaux antigènes érythrocytaires, une demi-vie circulante plus longue étant fraîche et une diminution du risque de transmission d’agents viraux. La mère peut donner une unité de globules rouges après le premier trimestre.,
En cas d’immaturité pulmonaire et de delta-OD 450 dans la zone affectée de la courbe Queenan, l’administration orale de 30 mg de phénobarbital à la mère 3 fois par jour, suivie d’une induction en une semaine, réduit le besoin de transfusion d’échange chez le nouveau-né affecté. D’excellents algorithmes pour la prise en charge de la première grossesse affectée et de la grossesse chez une mère avec un fœtus précédemment affecté sont décrits dans une revue de Moise (voir les images ci-dessous).
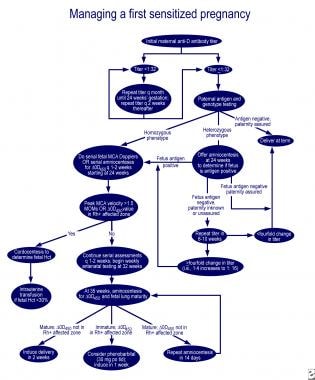 prise en charge de la première grossesse touchée.,
prise en charge de la première grossesse touchée., 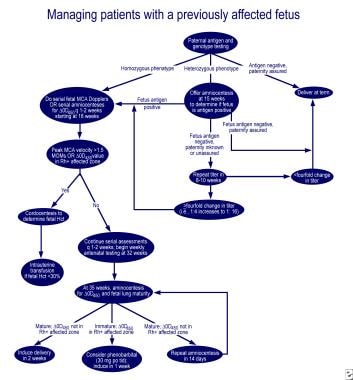 prise en charge des femmes enceintes dont le fœtus a déjà été atteint.
prise en charge des femmes enceintes dont le fœtus a déjà été atteint. Les premières tentatives de suppression de la production D’anticorps Rh avec L’haptène Rh, le stroma RBC Rh positif et l’administration de prométhazine ont été infructueuses. Une plasmaphérèse Extensive avec remplacement partiel utilisant 5% d’albumine (échange plasmatique thérapeutique) et une immunoglobuline intraveineuse (IGIV) ou l’administration D’IGIV à 1 g/kg de poids corporel par semaine s’est révélée modérément efficace., Le mécanisme d’action semble être le blocage des récepteurs Fc dans le placenta, réduisant le transport des anticorps vers le fœtus, les récepteurs Fc sur les phagocytes dans le système réticulo-endothélial fœtal et l’inhibition de la synthèse des anticorps maternels. Cependant, une cytotoxicité à médiation cellulaire dépendante des anticorps et une élévation du rebond de la concentration en anticorps, une altération du flux sanguin placentaire pendant la procédure et une hémorragie post-partum ont été notées après l’échange plasmatique.,
Une étude rétrospective plus récente portant sur 5 femmes enceintes présentant une PNHD sévère due à l’alloimmunisation RBC a rapporté un traitement réussi avec un schéma combiné d’échange plasmatique thérapeutique, D’IGIV et de transfusion intra-utérine (IUT) au début de la grossesse. Les femmes ont subi 3 procédures d’échange plasmatique au cours des semaines 10-13 de la grossesse, à la suite de perfusions hebdomadaires D’IGIV; les fœtus ont reçu des unités RBC qui correspondaient parfaitement au phénotype maternel aux groupes antigéniques D, C, E, K, Fy, Jk et S. Toutes les femmes ont accouché d’enfants en bonne santé entre 33 et 38 semaines de gestation.,
cependant, ces techniques ne font que reporter le besoin de prélèvement sanguin ombilical percutané (PUBS) et D’IVT jusqu’à 20-22 semaines de gestation, lorsque ces procédures peuvent être effectuées à un risque plus acceptable. Un examen de l’utilisation des IGIV montre son utilité pour prévenir l’apparition d’hydrops fœtaux et retarder le besoin D’IUT., Ainsi, une approche combinée de plasmaphérèse qui commence à 12 semaines de gestation 3 fois dans cette semaine, suivie D’IGIV à une dose de charge de 2 g/kg après la troisième plasmaphérèse, puis continue D’IGIV 1 g/kg/sem jusqu’à 20 semaines de gestation a été suggérée pour les fœtus à risque avant 20 semaines de gestation et peut également être utilisée plus tard dans la gestation si la TVI ne peut pas être réalisée ou si hydrops ne répond pas à la TVI.,
Un rapport a indiqué que le traitement des fœtus présentant une alloimmunisation sévère par IVT combiné à un traitement par IVIG fœtale à 1 g/kg/dose à partir de la troisième IVT a aidé à réduire la fréquence des IVT et à améliorer les signes d’hydrops. Un rapport de cas montre un traitement réussi de l’anémie sévère et des hydrops chez un fœtus avec alloimmunisation due à un anticorps anti-M avec des injections intrapéritonéales d’IGIV fœtales 2 g/kg administrées chaque semaine à partir de 30 semaines. Cependant, il s’agissait d’un rapport de cas, et un essai contrôlé randomisé est nécessaire avant que cela puisse devenir la norme de soins.,
des schémas de tests et de traitement similaires sont utilisés dans la prise en charge des grossesses touchées par l’alloimmunisation non RHD, telles que les anti-Rhc, les anti-K (K1) et les anti-M. Une fois que la mère reçoit un diagnostic d’anticorps associé à une maladie hémolytique, un titre Coombs indirect est effectué, ainsi que Les titres maternels sont répétés (tous les mois jusqu’à 28 semaines de gestation, puis toutes les 2 semaines) jusqu’à ce qu’un seuil d’anémie fœtale soit atteint (1:8 pour Kell et 1:32 pour le repos).,
le typage de l’antigène fœtal est effectué par amniocentèse ou par ADN fœtal sans cellules dans le plasma maternel si le père est hétérozygote (100% pour K1, 65% pour M). Lorsque le fœtus est connu pour être antigène positif, une surveillance de l’anémie fœtale sévère est effectuée, avec un dépistage Doppler MCA hebdomadaire dès 16-18 semaines et un IUT est effectué s’il dépasse 1,5 maman avec un accouchement avant 38 semaines de gestation.
Il a été démontré que les alloanticorps maternels contre les leucocytes paternels entraînent un blocage de la Fc et réduisent la gravité de l’anémie hémolytique fœtale., Ceci peut être utilisé à l’avenir.
prise en charge du nouveau-né sensibilisé
la maladie hémolytique légère représente 50% des nouveau-nés avec des résultats positifs aux tests d’anticorps directs. La plupart de ces nouveau-nés ne sont pas anémiques (hémoglobine du cordon >14 g/dL) et présentent une hémolyse minimale (bilirubine du cordon < 4 mg/dL). En dehors de la photothérapie précoce, ils ne nécessitent aucune transfusion. Cependant, ces nouveau-nés sont à risque de développer une anémie tardive sévère de 3 à 6 semaines de vie. Par conséquent, il est important de surveiller leurs taux d’Hb après leur sortie de l’hôpital.,
la maladie hémolytique modérée représente environ 25% des nouveau-nés atteints. La maladie hémolytique modérée du nouveau-né est caractérisée par une anémie modérée et une augmentation des niveaux de bilirubine du cordon. Ces nourrissons ne sont pas cliniquement jaunis à la naissance, mais développent rapidement une hyperbilirubinémie non conjuguée dans les 24 premières heures de la vie. Le frottis périphérique montre de nombreux globules rouges nucléés, une diminution des plaquettes et, occasionnellement, un grand nombre de granulocytes immatures., Ces nouveau-nés ont souvent une hépatosplénomégalie et risquent de développer une encéphalopathie à la bilirubine sans traitement adéquat. Une transfusion d’échange précoce avec des RBC frais Rh négatifs de type O avec photothérapie intensive est généralement nécessaire. L’utilisation D’IGIV à des doses de 0,5 à 1 g/kg dans un schéma posologique unique ou multiple a permis de réduire efficacement le besoin de transfusion d’échange.,
Une étude prospective randomisée contrôlée a montré que les IGIV à haute dose précoce 1 g / kg à l’âge de 12 heures réduisent la durée de la photothérapie et du séjour à l’hôpital et préviennent la transfusion d’échange chez les nouveau-nés présentant une isoimmunisation Rh modérée à sévère. Ces nouveau-nés sont également à risque de développer une anémie hyporégénérative tardive de la petite enfance à 4-6 semaines de vie. Cependant, un essai randomisé en double aveugle contrôlé par placebo n’a pas montré le bénéfice du traitement prophylactique par IGIV 0.,75 g / kg dans les 4 heures suivant l’âge chez les nouveau-nés gravement atteints qui ont été traités par transfusion intra-utérine pour l’isoimmunisation Rh.
la maladie hémolytique sévère représente les 25% restants des nouveau-nés alloimmunisés qui sont mort-nés ou hydropiques à la naissance. L’hydrops fœtal est principalement causé par un syndrome de fuite capillaire dû à une hypoxie tissulaire, une hypoalbuminémie secondaire à un dysfonctionnement hépatique et une insuffisance cardiaque à haut débit due à une anémie., Environ la moitié de ces fœtus deviennent hydropiques avant 34 semaines de gestation et nécessitent une surveillance et une gestion intensives de la gestation alloimmunisée comme décrit précédemment. Les hydrops légers impliquant une ascite s’inversent avec les IVT dans seulement 88% des cas avec une survie améliorée, mais les hydrops sévères provoquant un œdème du cuir chevelu et une ascite sévère et des épanchements pleuraux s’inversent dans 39% des cas et sont associés à une mauvaise survie.
prise en charge de L’incompatibilité ABO
la prise en charge de l’hyperbilirubinémie est une préoccupation majeure chez les nouveau-nés atteints d’incompatibilité ABO., Les critères de transfusion d’échange et de photothérapie sont similaires à ceux utilisés dans l’allo-immunisation. Les IGIV ont également été très efficaces lorsqu’elles sont administrées tôt dans le cours. Tin (SN) porphyrine un inhibiteur puissant de l’hème oxygénase, l’enzyme qui catalyse l’étape limite de vitesse dans la production de bilirubine à partir de l’hème, a été montré pour réduire la production de bilirubine et réduire le besoin de transfusion d’échange et la durée de la photothérapie chez les nouveau-nés présentant une incompatibilité ABO.
la protoporphyrine D’étain ou de zinc ou les mésoporphyrines ont été étudiées chez les nouveau-nés., Ils doivent être administrés par voie intramusculaire à une dose basée sur le poids corporel, et leur efficacité semble être liée à la dose dans toutes les gestations. Leurs effets toxiques possibles incluent la photosensibilisation cutanée, la carence en fer et l’inhibition possible de la production de monoxyde de carbone. Leur utilisation dans la maladie hémolytique Rh du nouveau-né n’a pas été rapportée. Leur utilisation courante ne peut pas encore être recommandée en raison du manque de données de sécurité à long terme.
















Laisser un commentaire