| L’Università di Sheffield | |
| Dipartimento di Chimica | VSEPR |
Ammoniaca dispone anche di quattro coppie di elettroni e la geometria di coordinazione di azoto è basato su una disposizione tetraedrica di una coppia di elettroni. Ci sono solo tre gruppi legati, quindi c’è una coppia solitaria. Tuttavia, poiché le coppie solitarie sono “invisibili”, la forma dell’ammoniaca è piramidale.,r>
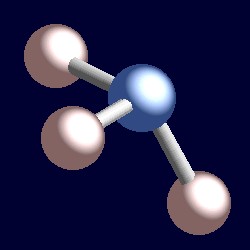
Considera una coppia di elettroni di legame. I due elettroni si trovano tra due nuclei e sono attratti da entrambi. Una coppia solitaria è diversa. È necessariamente attratto solo da un nucleo e la conseguenza è che adotta una posizione effettivamente più vicina a quel nucleo rispetto alle coppie di elettroni di legame. Ciò significa che l’angolo solido effettivo occupato da una coppia solitaria è maggiore di quello occupato da una coppia di legami., Le coppie solitarie richiedono una maggiore spazio angolare e si trovano più vicine ai loro atomi rispetto alle coppie di legami. La conseguenza di ciò per l’ammoniaca è che la coppia solitaria fa spazio a se stessa spingendo un po ‘ i tre atomi di idrogeno insieme e gli angoli di legame H-N-H sono leggermente inferiori (106,6°) rispetto all’angolo tetraedrico ideale di 109,5°.
















Lascia un commento