Gestione dell’alloimmunizzazione materna
Di norma, i titoli anticorpali materni seriali vengono monitorati fino a un titolo critico di 1:32, che indica che è stato raggiunto un alto rischio di idrope fetale. A questo punto, il feto richiede un monitoraggio molto intenso per i segni di anemia e idrope fetale., Nell’alloimmunizzazione di Kell, le idrope possono verificarsi a bassi titoli materni a causa dell’eritropoiesi soppressa e, quindi, un titolo di 1:8 è stato suggerito come critico. Quindi, i valori delta-OD 450 sono anche inaffidabili nel predire la gravità della malattia nell’alloimmunizzazione di Kell.
I titoli materni non sono utili per predire l’insorgenza dell’anemia fetale dopo la prima gestazione interessata. Grandi differenze nel titolo possono essere viste nello stesso paziente tra diversi laboratori e una nuova tecnica di gel produce risultati di titolo più elevati rispetto al metodo del tubo più vecchio., Di conseguenza, la metodologia standard del tubo dovrebbe essere usata per determinare il titolo critico e un cambiamento di più di 1 diluizione rappresenta un vero aumento nel titolo dell’anticorpo materno. Per tutti gli anticorpi responsabili della malattia emolitica del neonato (HDN), un aumento di 4 volte in qualsiasi titolo anticorpale è in genere considerato un cambiamento significativo che richiede una valutazione fetale.
Quando indicato, l’amniocentesi può essere eseguita già a 15 settimane di gestazione (raramente necessaria nella prima gravidanza affetta prima della gestazione di 24 settimane) per determinare il genotipo fetale e valutare la gravità., I campioni di sangue materno e paterno devono essere inviati al laboratorio di riferimento con un campione di liquido amniotico per eliminare i risultati falsi positivi (da pseudogene materno o dal gene Ccde) e falsi negativi (da un riarrangiamento nel locus del gene RHD nel padre).
La determinazione fetale del Rh-genotipo nel plasma materno è diventata di routine in molti paesi europei e viene offerta negli Stati Uniti., Il DNA fetale senza cellule rappresenta il 3% del DNA plasmatico materno circolante totale, si trova già a 38 giorni di gestazione ed è derivato dall’apoptosi dello strato di citotrofoblasto placentare. L’emivita media del DNA fetale circolante è in media inferiore a 30 minuti e il plasma materno viene sottoposto a filtrazione e microcentrifugazione per rimuovere tutti gli elementi cellulari prima del test. Questo elimina i risultati falsi positivi da cellule fetali attecchite di precedenti gravidanze negli organi linfoidi materni.,
Il DNA fetale senza cellule è sottoposto a reazione a catena della polimerasi in tempo reale (PCR) per la presenza di sequenze specifiche del gene RHD ed è stato trovato accurato nel 99,5% dei casi. Il gene SRY (nel feto maschile) e i polimorfismi del DNA nella popolazione generale (nel feto femminile) sono usati come controlli interni per confermare l’origine fetale del DNA senza cellule. Un pannello di 92 polimorfismi a singolo nucleotide (SNPS) viene confrontato tra il campione materno di buffy coat e il plasma., Una differenza di più di 6 SNPs conferma la presenza di DNA fetale e la validità del test in un feto femminile. I risultati falsi negativi che sono più indesiderabili e consequenziali sono dovuti a fenotipi D parziali o deboli. Vengono rilevati utilizzando almeno due primer esonici specifici per RHD ed eseguiti in duplicati.
Fortunatamente, test del DNA fetale senza cellule per determinare il genotipo per altri antigeni dei globuli rossi come c, C, e, E e Kell è anche ora trovato per essere altamente affidabile e preciso.,
L’amniocentesi seriale inizia a intervalli di 10-14 giorni per monitorare la gravità della malattia nel feto. Tutti i tentativi devono essere fatti per evitare il passaggio transplacentare dell’ago che può portare a emorragia fetomaternale (FMH) e un ulteriore aumento del titolo anticorpale. I valori delta-OD 450 seriali sono tracciati sul grafico di Queenan o sul grafico di Liley esteso per valutare il rischio di idrope fetale. L’ecografia precoce viene eseguita per stabilire la corretta età gestazionale., Il monitoraggio ultrasonografico frequente inoltre è effettuato per valutare il benessere fetale e per individuare l’anemia moderata ed i primi segni di idrope.
La velocità Doppler dell’arteria cerebrale media sistolica di picco (MCA) ha dimostrato di essere uno strumento di screening affidabile per rilevare l’anemia fetale e ha sostituito l’amniocentesi. Il MCA è facilmente visualizzato con Doppler a flusso di colore; il Doppler pulsato viene quindi utilizzato per misurare la velocità sistolica di picco solo distale alla sua biforcazione dall’arteria carotide interna., Poiché la velocità MCA aumenta con l’avanzare dell’età gestazionale, il risultato è riportato in multipli di mediana (MAMME). In studi recenti, la sensibilità per il rilevamento di anemia fetale moderata e grave è stata dimostrata al 100%, con un tasso di falsi positivi del 10% a 1,5 MOM. È stato dimostrato che riduce la necessità di procedure diagnostiche invasive come l’amniocentesi e la cordocentesi di oltre il 70%.
Gli studi MCA Doppler possono essere avviati già a 18 settimane di gestazione, ma non sono affidabili dopo 35 settimane di gestazione., Inoltre è stato usato per cronometrare la trasfusione fetale successiva e per diagnosticare l’anemia dalle cause multiple, quale nella trasfusione gemellata-gemellata. La pendenza MCA dalle letture settimanali 3 è ora utilizzata per prevedere il rischio fetale per anemia grave (vedere l’immagine sotto).
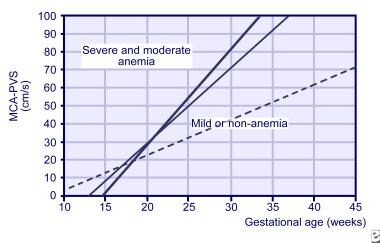 Piste per velocità sistolica di picco nell’arteria cerebrale media (MCA) per feti normali (linea tratteggiata), feti leggermente anemici (linea sottile) e feti gravemente anemici (linea spessa).,
Piste per velocità sistolica di picco nell’arteria cerebrale media (MCA) per feti normali (linea tratteggiata), feti leggermente anemici (linea sottile) e feti gravemente anemici (linea spessa)., Con l’acquisizione di esperienza nello studio Doppler MCA, l’amniocentesi seriale per la rilevazione dell’anemia fetale è stata utilizzata in misura minore.
Durante il periodo in cui la trasfusione peritoneale intrauterina era l’unico mezzo di trattamento, i neonati venivano regolarmente consegnati a 32 settimane di gestazione. Questo approccio ha portato ad un’alta incidenza di malattia della membrana ialina e trasfusioni di scambio., Con l’avvento della trasfusione intravascolare (IVT) in utero, l’approccio generale al feto gravemente colpito è quello di eseguire la IVT come richiesto fino alla gestazione di 35 settimane, con la consegna pianificata a termine. Stabilire la maturità polmonare è difficile in questi feti a causa della contaminazione del liquido amniotico con sangue residuo durante la trasfusione; tuttavia, se il parto è pianificato prima della gestazione di 34 settimane, è indicata la somministrazione materna di steroidi per migliorare la maturità polmonare fetale.,
inoltre, l’eccesso di liquido amniotico livelli di bilirubina causare falsi elevazione sulla fluorescenza depolarizzazione TDx maturità polmonare fetale test, la versione II (TDX-FLMII); di conseguenza, altri test per determinare la maturità polmonare fetale dovrebbe essere usato, come la spettroscopia infrarossa del corpo lamellare conte, phosphatidylglycerol quantificazione o lecitina/sfingomielina (L/S) rapporto.
Liley descrisse per la prima volta la trasfusione intraperitoneale (IPT) nel 1963. Un ago Tuohy viene introdotto nella cavità peritoneale fetale sotto guida ultrasonografica., Un catetere epidurale viene infilato attraverso l’ago. Un mezzo radiopaco viene iniettato nel peritoneo fetale. Il corretto posizionamento è confermato dalla delineazione al di fuori dell’intestino o sotto il diaframma o dalla diffusione nell’ascite fetale.,ss di 4 giorni, di vecchio, di gruppo O Rh-negativo, Kell-negativo, leukoreduced, irradiati con 25 Gy per evitare di graft versus host disease, e cross-matching con siero materno vengono iniettati in 10 mL aliquote per un volume calcolato con la seguente formula:
IPT volume = (gestazione in queste settimane – 20) × 10 mL
Residua di emoglobina (Hb) nel feto è stimato per consentire la corretta spaziatura di IPT e selezione di gestazione di consegna mediante la seguente formula:
Hb g/dL = 0.,85/125 × a / b × 120-c/120
Nella formula, a è la quantità di donatore RBC Hb trasfuso, b è il peso corporeo fetale stimato e c è l’intervallo in giorni dal momento della trasfusione al momento della stima del donatore Hb.
L’IPT viene ripetuto quando si stima che l’Hb fetale sia sceso a 10 g/dL. Di solito, un secondo IPT viene eseguito 10 giorni dopo la prima trasfusione al fine di aumentare l’Hb sopra 10 g/dL. Quindi un’altra trasfusione viene eseguita ogni 4 settimane fino al momento della consegna pianificata a 34-35 settimane di gestazione., I movimenti diaframmatici fetali sono necessari affinché si verifichi l’assorbimento di RBC. Questo approccio non ha alcun valore per un feto moribondo che non respira. Le complicazioni materne comprendono l’infezione e l’emorragia transplacentare, mentre le complicazioni fetali sono sovratrasfusione, exsanguination, tamponamento cardiaco, infezione, lavoro pretermine e malattia dell’innesto contro ospite. I tassi di sopravvivenza dopo IPT si sono avvicinati a circa il 75% con l’aiuto dell’ecografia.,
La IVT diretta è diventata una via preferita di intervento fetale a causa del più alto tasso di complicanze e dell’efficacia limitata dell’IPT in un feto idropico. Rodeck prima eseguito con successo IVT nel 1981. Con la guida ultrasonografica, un ago calibro 20-22 viene introdotto in una vena ombelicale all’inserimento del cordone nella placenta o nella sua porzione intraepatica e si ottiene un campione di sangue fetale. Il campione di sangue è confermato per essere di origine fetale dalla prova alcalina rapida di denaturazione., Vengono eseguiti tutti i test fetali pertinenti (ad esempio, gruppo sanguigno, test anticorpale diretto, conta reticolocitaria, conta piastrinica, livello di Hb, livello di Hct, livello di albumina sierica, livello di eritropoietina). Se il livello di Hb è inferiore a 11 g / dL o se il livello di Hct è inferiore al 30%, viene avviata una IVT. La posizione dell’ago è confermata notando la turbolenza nel vaso fetale all’iniezione di soluzione salina. Il feto è paralizzato frequentemente con pancuronium e dato fentanyl 10 mcg / kg per impedire lo spostamento dell’ago dai movimenti fetali., Il farmaco materno varia solo dall’anestetico locale, all’indometacina di routine e alla sedazione cosciente, all’analgesia epidurale spinale.
La trasfusione viene eseguita in aliquote da 10 ml ad un volume di circa 50 mL / kg di peso corporeo stimato mediante ecografia o fino al raggiungimento di un livello di Hct del 40%. La procedura viene prontamente interrotta se si nota uno scompenso cardiaco sui risultati dell’ecografia., I feti gravemente anemici non tollerano la correzione acuta del loro Hct ai valori normali e l’Hct iniziale non deve essere aumentato di oltre 4 volte al momento della prima IVT. Dovrebbero quindi essere monitorati ogni 2-7 giorni. L’IVT viene ripetuto quando raggiunge un valore che riflette l’anemia critica nel feto. Si può prevedere una perdita dell ‘ 1% delle cellule trasfuse al giorno.
Alcuni centri eseguono trasfusioni ripetute ad intervalli di 10 giorni, 2 settimane e ogni 3 settimane. Altri trasfuse sulla base di un previsto calo dell’emoglobina fetale di 0,4 g / dL / die, 0,3 g/dL / die e 0.,2 g/dL/die per intervalli di prima, seconda e terza trasfusione, rispettivamente. La velocità MCA sistolica di picco è stata utilizzata per cronometrare la seconda trasfusione, con una soglia di 1,32 MOM. Dopo la prima trasfusione intrauterina, la presenza di globuli rossi con emoglobina adulta sopprime l’eritropoiesi e migliora l’erogazione di ossigeno, che è responsabile della scarsa correlazione tra la velocità di picco MCA e la gravità dell’anemia fetale. Alcuni centri hanno trovato un effetto benefico della trasfusione combinata di IVT e IPT sull’intervallo per ripetere la trasfusione.,
Oltre alle complicanze dell’IPT, durante l’IVT sono stati riportati bradicardia fetale transitoria, ematoma del cordone ombelicale, compressione della vena ombelicale e morte fetale. Tuttavia, IVT presenta molti vantaggi, compreso la correzione immediata dell’anemia e della risoluzione delle idrope fetali, del tasso ridotto di emolisi e dell’iperinsulinemia successiva e dell’accelerazione di crescita fetale per i feti nonhydropic che sono spesso crescita ritardata. IVT è l’unico intervento disponibile per feti idropici moribondi e quelli con placenta anteriore. Il rischio di perdita fetale è circa 0.8% con IVT contro 3.,5% per procedura per IPT e il tasso di sopravvivenza globale è dell ‘ 88%.
I globuli rossi materni lavati di recente sono stati usati con successo come fonte di globuli rossi antigene-negativi in caso di rara incompatibilità, ma sono stati anche usati di routine a causa di benefici come la diminuzione del rischio di sensibilizzazione a nuovi antigeni eritrocitari, una più lunga emivita circolante fresca e un ridotto rischio di trasmissione di agenti virali. La madre può donare un’unità di globuli rossi dopo il primo trimestre.,
In caso di immaturità polmonare e delta-OD 450 nella zona interessata della curva Queenan, la somministrazione orale di 30 mg di fenobarbital alla madre 3 volte al giorno, seguita dall’induzione in una settimana, riduce la necessità di trasfusioni di scambio nel neonato affetto. Algoritmi eccellenti per la gestione della prima gravidanza interessata e della gravidanza in una madre con feto precedentemente affetto sono delineati in una recensione di Moise (vedi le immagini qui sotto).
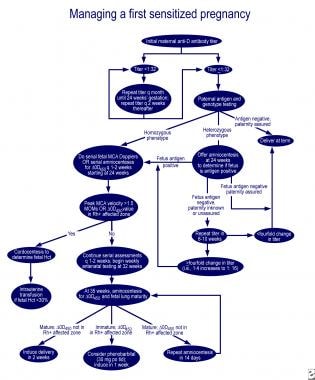 Gestione della prima gravidanza affetta.,
Gestione della prima gravidanza affetta., 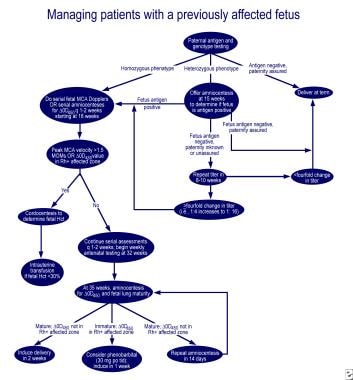 Gestione di donne in gravidanza con feto precedentemente affetto.
Gestione di donne in gravidanza con feto precedentemente affetto. I tentativi iniziali di sopprimere la produzione di anticorpi Rh con aptene Rh, stroma RBC Rh-positivo e somministrazione di prometazina non hanno avuto successo. La plasmaferesi estesa con sostituzione parziale utilizzando il 5% di albumina (scambio plasmatico terapeutico) e immunoglobulina endovenosa (IVIG) o la somministrazione di IVIG a 1 g/kg di peso corporeo alla settimana si è dimostrata moderatamente efficace., Il meccanismo d’azione sembra essere il blocco dei recettori Fc nella placenta, riducendo il trasporto di anticorpi verso il feto, i recettori Fc sui fagociti nel sistema reticoloendoteliale fetale e l’inibizione del feedback della sintesi di anticorpi materni. Tuttavia, la citotossicità cellulo-mediata anticorpo-dipendente e l’elevazione di rimbalzo della concentrazione anticorpale, l’alterazione del flusso sanguigno placentare durante la procedura e l’emorragia postpartum sono stati notati dopo lo scambio plasmatico.,
Uno studio retrospettivo più recente su 5 donne in gravidanza con HDFN grave a causa di alloimmunizzazione RBC ha riportato il successo del trattamento con un regime combinato di scambio plasmatico terapeutico, IVIG e trasfusione intrauterina (IUT) all’inizio delle gravidanze. Le donne sono state sottoposte a 3 procedure di scambio plasmatico durante le settimane 10-13 di gravidanza, dopo infusioni settimanali di IVIG; i feti hanno ricevuto unità RBC che corrispondevano pienamente al fenotipo materno ai gruppi antigenici D, C, E, K, Fy, Jk e S. Tutte le donne hanno partorito neonati sani a 33-38 settimane di gestazione.,
Tuttavia, queste tecniche rimandano solo la necessità di prelievo percutaneo di sangue ombelicale (PUB) e IVT fino alla gestazione di 20-22 settimane, quando queste procedure possono essere eseguite a un rischio più accettabile. Una revisione dell’uso di IVIG mostra la sua utilità nel prevenire l’insorgenza di idrope fetali e nel ritardare la necessità di IUT., Pertanto, un approccio combinato di plasmaferesi che inizia alla gestazione di 12 settimane 3 volte in quella settimana, seguito da IVIG ad una dose di carico di 2 g/kg dopo la terza plasmaferesi, e poi continuato IVIG 1 g/kg / settimana fino alla gestazione di 20 settimane è stato suggerito per i feti a rischio prima della gestazione di 20 settimane e può essere utilizzato anche più tardi nella gestazione se la IVT non può essere eseguita o se hydrops non risponde alla IVT.,
Un rapporto ha indicato che il trattamento di feti con alloimmunizzazione severa usando IVT combinato con terapia IVIG fetale a 1 g/kg / dose a partire dalla terza IVT ha aiutato a ridurre la frequenza di IVT e migliorare i segni di idrope. Un caso clinico mostra il successo del trattamento di anemia grave e idrope in un feto con alloimmunizzazione a causa di anticorpi anti-M con iniezioni intraperitoneali di IVIG 2 g/kg somministrati settimanalmente a partire da 30 settimane. Tuttavia, questo era un caso clinico, ed è necessario uno studio controllato randomizzato prima che questo possa diventare standard di cura.,
Regimi simili di test e trattamento sono utilizzati nella gestione di gravidanze affette da alloimmunizzazione nonRhD, come anti-Rhc, anti-K (K1) e anti-M. Una volta che alla madre viene diagnosticato un anticorpo associato a malattia emolitica, viene eseguito un titolo indiretto di Coombs, insieme al test paterno per l’antigene coinvolto e la zigosità. I titoli materni vengono ripetuti (mensilmente fino alla gestazione di 28 settimane e poi ogni 2 settimane) fino al raggiungimento di una soglia per l’anemia fetale (1:8 per Kell e 1:32 per il riposo).,
La tipizzazione dell’antigene fetale viene eseguita tramite amniocentesi o DNA fetale senza cellule nel plasma materno se il padre è trovato eterozigote (100% per K1, 65% per M). Quando il feto è noto per essere positivo all’antigene, viene eseguita la sorveglianza per l’anemia fetale grave, con screening Doppler MCA settimanale già da 16-18 settimane e IUT viene eseguito se supera 1,5 MOM con una consegna entro la gestazione di 38 settimane.
È stato dimostrato che gli alloanticorpi materni ai leucociti paterni provocano il blocco Fc e riducono la gravità dell’anemia emolitica fetale., Questo può essere utilizzato in futuro.
La gestione del neonato sensibilizzato
La malattia emolitica lieve rappresenta il 50% dei neonati con risultati positivi del test anticorpale diretto. La maggior parte di questi neonati non è anemica (emoglobina del cavo >14 g/dL) e ha emolisi minima (bilirubina del cavo < 4 mg/dL). A parte la fototerapia precoce, non richiedono trasfusioni. Tuttavia, questi neonati sono a rischio di sviluppare grave anemia tardiva entro 3-6 settimane di vita. Pertanto, il monitoraggio dei loro livelli di Hb dopo la dimissione ospedaliera è importante.,
La malattia emolitica moderata rappresenta circa il 25% dei neonati affetti. La malattia emolitica moderata del neonato è caratterizzata da anemia moderata e aumento dei livelli di bilirubina del cordone. Questi neonati non sono clinicamente itterici alla nascita, ma sviluppano rapidamente iperbilirubinemia non coniugata nelle prime 24 ore di vita. Lo striscio periferico mostra numerosi globuli ROSSI nucleati, diminuzione delle piastrine e, occasionalmente, un gran numero di granulociti immaturi., Questi neonati hanno spesso epatosplenomegalia e sono a rischio di sviluppare encefalopatia bilirubina senza un trattamento adeguato. Di solito è necessaria una trasfusione di scambio precoce con globuli rossi freschi Rh-negativi di tipo O con fototerapia intensiva. L’uso di IVIG in dosi di 0,5-1 g / kg in un regime di dose singola o multipla è stato in grado di ridurre efficacemente la necessità di trasfusioni di scambio.,
Uno studio prospettico randomizzato e controllato ha mostrato una IVIG precoce ad alte dosi 1 g / kg a 12 ore di età per ridurre la durata della fototerapia e della degenza ospedaliera e per prevenire lo scambio trasfusionale in neonati con isoimmunizzazione Rh da moderata a grave. Questi neonati sono anche a rischio di sviluppare anemia iporegenerativa tardiva dell’infanzia a 4-6 settimane di vita. Tuttavia, uno studio randomizzato in doppio cieco controllato con placebo non è riuscito a mostrare il beneficio della terapia profilattica IVIG 0.,75 g / kg entro 4 ore di età in neonati gravemente colpiti che sono stati trattati con trasfusione intrauterina per isoimmunizzazione Rh.
La grave malattia emolitica rappresenta il restante 25% dei neonati alloimmunizzati nati morti o idropici alla nascita. L’idrope fetale è prevalentemente causata da una sindrome da perdita capillare dovuta a ipossia tissutale, ipoalbuminemia secondaria a disfunzione epatica e insufficienza cardiaca ad alto rendimento da anemia., Circa la metà di questi feti diventano idropici prima della gestazione di 34 settimane e necessitano di un monitoraggio e una gestione intensivi della gestazione alloimmunizzata come descritto in precedenza. Le idrope lievi che coinvolgono l’ascite si invertono con IVTS solo nell ‘ 88% dei casi con una migliore sopravvivenza, ma le idrope gravi che causano edema del cuoio capelluto e le ascite gravi e le effusioni pleuriche si invertono nel 39% dei casi e sono associate a una scarsa sopravvivenza.
Gestione dell’incompatibilità ABO
La gestione dell’iperbilirubinemia è una delle principali preoccupazioni nei neonati con incompatibilità ABO., I criteri per la trasfusione di scambio e la fototerapia sono simili a quelli utilizzati nell’alloimmunizzazione Rh. IVIG è stato anche molto efficace quando somministrato all’inizio del corso. La porfirina di stagno (Sn) un potente inibitore dell’eme ossigenasi, l’enzima che catalizza la fase limitante della produzione di bilirubina dall’eme, ha dimostrato di ridurre la produzione di bilirubina e ridurre la necessità di trasfusioni di scambio e la durata della fototerapia nei neonati con incompatibilità ABO.
Stagno o zinco protoporfirina o mesoporfirine sono stati studiati nei neonati., Devono essere somministrati per via intramuscolare in una dose basata sul peso corporeo e la loro efficacia sembra essere correlata alla dose in tutte le gestazioni. I loro possibili effetti tossici includono fotosensibilizzazione della pelle, carenza di ferro e possibile inibizione della produzione di monossido di carbonio. Il loro uso nella malattia emolitica Rh del neonato non è stato riportato. Il loro uso di routine non può ancora essere raccomandato a causa della mancanza di dati di sicurezza a lungo termine.
















Lascia un commento