D Kelly1, G Crotty1, J O’Mullane2, M Stapleton2, B Sweeney1, SS O’Sullivan1
i Dipartimenti di 1Neurology e 2Biochemistry, Cork University Hospital, Wilton, Sughero
Abstract
Il primo passo per lo screening di potenziali malattia di Wilson è il siero ceruloplasmina test, per cui un livello inferiore a 0,2 g/L è suggestivo di malattia., Miravamo a determinare quale percentuale di una popolazione irlandese avesse un basso livello di ceruloplasmina, se le basse misurazioni fossero state adeguatamente seguite e quali fossero i risultati clinici. Abbiamo condotto una revisione retrospettiva di tutte le misurazioni della ceruloplasmina sierica tra agosto 2003 e ottobre 2009 in un grande centro di riferimento terziario nell’Irlanda meridionale. Dati clinici, ceruloplasmina sierica, test di funzionalità epatica, rame urinario e biopsie epatiche sono stati tutti registrati ove disponibili. 1573 pazienti hanno avuto una misurazione della ceruloplasmina sierica durante il periodo di studio di 7 anni. 96 pazienti (6.,1%) aveva un livello di ceruloplasmina < 0,2 g / L e di questi solo 3 pazienti avevano la malattia di Wilson. C’era solo 1 nuova diagnosi. Solo 27 pazienti (28,1%) hanno avuto una qualche forma di test di conferma eseguiti. Nell’esperienza del nostro centro, il valore predittivo positivo di un livello di ceruloplasmina significativamente basso è 11.1% (95% CI 2.91-30.3%). In pratica una bassa misurazione della ceruloplasmina sierica spesso non è seguita da appropriati test di conferma., Misurare la ceruloplasmina sierica come test diagnostico singolare per la malattia di Wilson o come parte della batteria di test di screening del fegato non selezionati è inappropriato e a bassa resa.
Introduzione
La malattia di Wilson (WD) è un raro difetto autosomico recessivo nel trasporto del rame epatocellulare riscontrato in 3 persone su 100.0001. Può portare alla deposizione cronica di rame nel fegato, nel cervello e in altri tessuti con conseguente epatotossicità e sequele neuropsichiatrici2., L’Associazione americana per lo studio della malattia del fegato (AASLD) raccomanda lo screening per WD in qualsiasi individuo di età compresa tra 3 e 55 anni con anomalie epatiche di causa incerta, specialmente quelli con disturbi neurologici inspiegabili co-morbosi3. Il primo passo nello screening per il potenziale WD è la misurazione della ceruloplasmina sierica, poiché circa l ‘ 85-90% dei pazienti con WD ha bassi livelli di ceruloplasmina sierica4., Tuttavia, la bassa ceruloplasmina non è specifica per la WD; può derivare da malassorbimento, altre malattie del fegato, enteropatie che perdono proteine, carenza di rame acquisita e aceruloplasminemia ereditaria5. La ceruloplasmina è anche un reagente di fase acuta e può essere elevata negli stati infiammatori compresi i pazienti con WD con epatite attiva6. Gli stati iper-estrogenici tra cui la gravidanza o l’uso della pillola contraccettiva orale possono anche aumentare i livelli di ceruloplasmina poiché l’mRNA di ceruloplasmina ha una regione a monte reattiva agli estrogeni per la sua trascrizione7. Livelli di ceruloplasmina inferiori a 0.,2g / L hanno dimostrato in uno studio di avere una sensibilità di oltre il 98%, una specificità di oltre il 55% e un valore predittivo positivo di oltre il 48% per la diagnosi di WD su pazienti con genotipo verificato8.
Tuttavia, altre ricerche suggeriscono che il valore predittivo positivo della ceruloplasmina<0,2 g / L quando usato da solo in pazienti con disfunzione epatica può essere basso come 5,9% 1. Per questo motivo, le linee guida raccomandano una serie di test di conferma tra cui un esame con lampada a fessura per il rilevamento di anelli Kayser-Fleischer (KF) e una stima del rame urinario di 24 ore3., Ulteriori indagini possono essere necessarie per quelli con risultati indeterminati tra cui una biopsia epatica per determinare la concentrazione di rame epatico o test molecolari per le mutazioni ATP7B9, 10. La European Association for the Study of the Liver (EASL) clinical practice guidelines riconosce anche i limiti della misurazione della ceruloplasmina sierica come un singolo test e raccomanda l’uso di una combinazione di test che riflettono il “metabolismo del rame disturbato” con un sistema di punteggio diagnostico basato sui loro risultati11., Il nostro studio ha valutato l’incidenza di bassi livelli di ceruloplasmina nella popolazione e le indicazioni cliniche per il test. Abbiamo determinato se sono stati eseguiti ulteriori test diagnostici e quale era il significato clinico di questi risultati.
Metodi
Abbiamo condotto una revisione retrospettiva di tutte le misurazioni di ceruloplasmina presso il Cork University Hospital Clinical laboratory che serve una vasta rete di cure primarie, cliniche specializzate e un centro di riferimento neurologico ed epatologico terziario di 800 letti tra agosto 2003 e ottobre 2009., Il periodo di tempo è stato scelto per includere i dati massimi disponibili. Lo studio è stato approvato dal comitato etico dell’ospedale. Dati clinici, ceruloplasmina sierica, test di funzionalità epatica, rame urinario e biopsie epatiche sono stati tutti registrati ove disponibili. La nefelometria era la tecnica utilizzata dal laboratorio di riferimento per la misurazione della ceruloplasmina sierica durante il periodo di studio. Abbiamo trattato valori di ceruloplasmina inferiori a 0,2 g / L come potenzialmente positivi per WD in conformità con le linee guida pubblicate3., Una diagnosi di WD è stata determinata sulla base dei risultati dei test di conferma (urina e rame epatico, esami oftalmologici) e documentazione della cartella clinica. I risultati dei test genetici sono stati registrati se disponibili. Gli eterozigoti WD sono stati definiti come quelli con una sola mutazione che causa la malattia in assenza di altre caratteristiche di supporto. I dati sono stati analizzati utilizzando SPSS versione 21.
Risultati
Demografia della popolazione testata
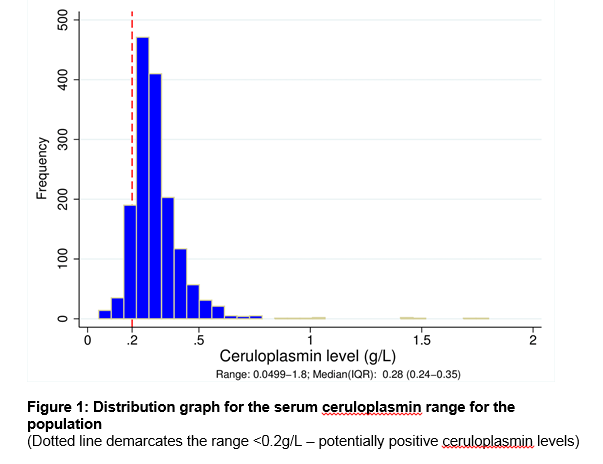
Il nostro laboratorio a Cork City, in Irlanda, funge da centro sovraregionale per una popolazione totale di 1,1 milioni di persone., C’erano 1573 pazienti nel database di laboratorio che avevano una misurazione della ceruloplasmina sierica durante il periodo di studio di 7 anni. La tabella 1 delinea i dettagli demografici e la fonte di riferimento per specialità clinica. Un totale di 476 livelli sierici di ceruloplasmina (30,3%) sono stati ordinati in pazienti di età inferiore a 3 anni o superiore a 55 anni, un gruppo al di fuori delle raccomandazioni AASLD3. Vedere la figura 1 per l’intervallo di livelli di ceruloplasmina nell’intera popolazione. Il livello mediano di ceruloplasmina era 0,28 g/L (5 ° centile = 0,18, 95 ° centile = 0,5 g / L)., C’è stata una differenza significativa nel livello mediano per maschi e femmine a 0,27 g/L e 0,3 g/L rispettivamente (p<0,05). C’era una debole correlazione positiva tra età e livello di ceruloplasmina con età inferiori associate a livello di ceruloplasmina inferiore, r =.124, n = 1573, p <.0005.
Tabella 1:
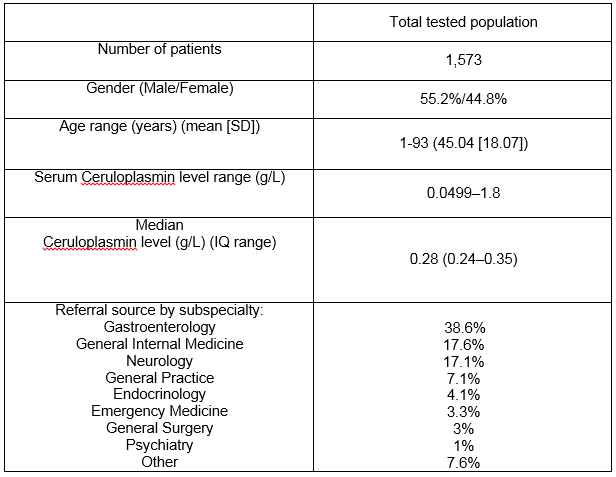
Positivo ceruloplasmina risultati
96 pazienti (maschi:femmine = 72%:per il 28% dell’intera coorte (6.1%) aveva un ceruloplasmina livello <0.,2g / L (vedi Figura 1). Le indicazioni più comuni per i test sono state la presenza di anomalie dei test di funzionalità epatica (61,5%), un disturbo del movimento (18,8%) e disturbi psichiatrici (7,3%). il 40,6% del gruppo ha successivamente ricevuto una diagnosi definitiva di malattia epatica, la più comune delle quali era la malattia epatica alcolica (14,6%) seguita dalla malattia epatica non alcolica (8,3%). Solo 3 dei 96 pazienti (3,1%) avevano WD. Due di questi pazienti erano stati precedentemente diagnosticati e sono stati nuovamente testati per il monitoraggio della malattia. Un paziente è stato di nuova diagnosi con WD durante il periodo di studio., La sua elevata escrezione urinaria di rame di 24 ore, gli anelli Kayser-Fleisher e il basso livello di ceruloplasmina sierica hanno confermato la diagnosi. Tutti e 3 i pazienti con WD avevano una ceruloplasmina < 0,05 g/L. Inoltre, 1 individuo che presentava tremore è stato identificato come portatore di WD con una sola mutazione ATP7B. La sua analisi genetica non era coerente con un eterozigote composto e non ha mai sviluppato ulteriori sintomi clinici.
Test di conferma per la malattia di Wilson
Dopo un risultato ceruloplasmina positivo / suggestivo, 27/96 pazienti (28.,1%) ha avuto una qualche forma di test di conferma per WD eseguita. 14 pazienti (14,5%) sono stati esaminati oftalmologicamente per gli anelli Kayser-Fleisher. 10 pazienti (10,4%) sono stati sottoposti a biopsia epatica per quantificare il rame epatico. 23 pazienti (24%) hanno avuto quantificazione del rame urinario. Il periodo medio di follow-up dal momento del test iniziale è stato di 51,4 mesi (DS 30,3 mesi). Le sottospecie non neurologiche / gastroenterologiche hanno avuto meno probabilità di eseguire indagini di follow-up. (p < 0.01). Solo 4 dei 27 pazienti (14.,8%) che avevano ulteriori test erano sotto la cura delle sottospecialità non neurologiche / gastroenterologiche.
Ceruloplasmina come test diagnostico di screening
Discussione
La misurazione della ceruloplasmina è spesso richiesta nella valutazione e nella gestione del paziente con aumento degli enzimi epatici. Nella nostra recensione di 7 anni di modelli di ordinazione ceruloplasmina, abbiamo trovato scarsa aderenza alle linee guida AASLD. Una percentuale significativa della popolazione testata era al di fuori della fascia di età raccomandata dall’AASLD. È molto raro presentare con la malattia di Wilson dopo l’età di 4012., In un’ampia revisione retrospettiva dei livelli di ceruloplasmina in 5023 pazienti, il numero necessario per testare la malattia di Wilson ad esordio tardivo (>40 anni di età) per ottenere 1 nuova diagnosi è stato 284713. In molti casi, le anomalie del fegato non erano di eziologia incerta e le malattie più comuni non erano ancora escluse. Molti di quelli con bassi livelli di ceruloplasmina avevano epatite cronica o malattia epatica indotta da alcol-condizioni associate a risultati falsi positivi secondari a una scarsa funzionalità epatica sintetica1., Meno del 30% della popolazione in studio ha avuto indagini di follow-up appropriate per un risultato positivo di ceruloplasmina come l’esame oftalmico per gli anelli KF o la biopsia epatica per la colorazione del rame. Le misurazioni della ceruloplasmina sono state richieste da una varietà di sottospecialiti, i più comuni sono gastroenterologia, neurologia e internisti. La ragione più comune per il test è stata la valutazione dell’aumento degli enzimi epatici o della malattia epatica accertata. I medici che non erano gastroenterologi o neurologi avevano meno probabilità di eseguire indagini di conferma (p<0,01)., Ciò suggerisce la mancanza di familiarità da altre sottospecialità con l’algoritmo diagnostico delle indagini necessarie per confermare o escludere WD.
La misurazione della ceruloplasmina sierica con un livello di cut-off inferiore a 0,2 g / L ha avuto un PPV basso per WD nel nostro studio simile al lavoro precedentemente pubblicato1. Ciò si riferisce alla bassa probabilità pre-test della diagnosi in una popolazione non selezionata con un’alta prevalenza di malattia epatica con eziologia nota. L’abbassamento dell’intervallo di riferimento a 0,14 avrebbe migliorato le prestazioni del test senza influire negativamente sulla sensibilità., Una maggiore accuratezza diagnostica con questa soglia inferiore è stata riportata in studi precedenti con un avvertimento di convalida locale necessaria8. In questo studio, concentrazioni sieriche di ceruloplasmina inferiori a 0,20, 0,14 e 0,10 g/L hanno mostrato valori predittivi positivi del 48,3%, 100% e 100%, rispettivamente, Nel gruppo di convalida, una soglia sierica di ceruloplasmina di 0,14 g / L ha reso sensibilità e specificità del 100%. Tuttavia è possibile che non tutti i pazienti con WD siano stati catturati sulla base di questo test di screening., Come accennato in precedenza, ci possono essere risultati falsi negativi per WD a fronte di infezione o infiammazione14. La gravidanza e la terapia supplementare dell’estrogeno possono avere un impatto simile15. Le future richieste/interpretazioni dei test dovrebbero tenere conto di tali fattori clinici attenuanti. Il metodo di prova può influenzare i risultati. La ceruloplasmina sierica può essere misurata enzimaticamente mediante la sua attività ossidasi rame-dipendente verso substrati specifici o mediante saggi anticorpali-dipendenti. Quest’ultimo include nefelometria, radioimmunoassay e immunodiffusione radiale., I risultati sono generalmente simili, ad eccezione dei saggi anticorpo-dipendenti e immunodiffusione, che possono sovrastimare i livelli di ceruloplasmina. La sovrastima può verificarsi perché i due metodi di prova non distinguono tra apoceruloplasmina (ceruloplasmina non legata al rame) e holoceruloplasmina (ceruloplasmina con il suo complemento completo di 6 atomi di rame per molecola)16. La nefelometria è stata la tecnica utilizzata costantemente durante il nostro periodo di studio.
C’erano diverse limitazioni a questo studio. Non abbiamo seguito pazienti che avevano valori normali (> 0.,2g / L) livelli sierici di ceruloplasmina per garantire che non abbiano successivamente sviluppato WD. Quindi potremmo non aver catturato le caratteristiche dei test di tutti i pazienti affetti. La nostra capacità di valutare la ceruloplasmina come test diagnostico era limitata in quanto potevamo includere solo misurazioni in cui venivano eseguiti test di conferma definitivi. Inoltre, è possibile che il vettore eterozigote che abbiamo identificato avesse in realtà WD con un fenotipo meno grave., Dato che la maggior parte dei pazienti affetti da WD sono eterozigoti composti e che esistono molte mutazioni specifiche della malattia, può essere difficile differenziare un portatore sano da un individuo interessato17. Lo screening di routine di tutti i pazienti è di limitata utilità clinica e la ceruloplasmina non deve essere utilizzata come parte della batteria empirica di test che formano lo schermo del fegato. L’uso più giudizioso di ceruloplasmina in una popolazione selezionata con una maggiore probabilità di pre-test della malattia di Wilson può aumentare la sua utilità come strumento di screening., Sistemi di punteggio diagnostici come quello proposto da EASL11 possono aiutare il rischio a stratificare o contestualizzare un risultato di ceruloplasmina sierica basso. Vi è una chiara necessità di una maggiore educazione per quanto riguarda le indicazioni appropriate per il test della ceruloplasmina in tutte le specialità cliniche di riferimento, ma in particolare le fonti non neurologiche e non gastroenterologiche. Le prestazioni del test possono migliorare con intervalli di riferimento inferiori validati localmente, aderenza delle linee guida e uso in una popolazione più selezionata.,
la Corrispondenza: S O’Sullivan
Dipartimento di Neurologia, Cork University Hospital, Sughero
Email:
Funding
S O’Sullivan ha ricevuto il sostegno di partecipare, di Eisai Pharma, UCB, AbbVie, Lundbeck Pharma e Teva Pharma
- Cauza E, Maier-Dobersberger T, Polli C, Kaserer K, Kramer L, Ferenci P. di Screening per la malattia di Wilson in pazienti con malattie del fegato da siero di ceruloplasmina. Rivista di epatologia. 1997;27:358-62.
- Medici V, Rossaro L, Sturniolo GC. Malattia di Wilson-un approccio pratico alla diagnosi, al trattamento e al follow-up., Digestive and epat disease: gazzetta ufficiale della Società Italiana di Gastroenterologia e dell’Associazione Italiana per lo Studio del Fegato. 2007;39:601-9.
- Roberts EA, Schilsky ML. Diagnosi e trattamento della malattia di Wilson: un aggiornamento. Epatologia (Baltimora, Md). 2008;47:2089-111.
- Stremmel W, Meyerrose KW, Niederau C, Hefter H, Kreuzpaintner G, Strohmeyer G. Malattia di Wilson: presentazione clinica, trattamento e sopravvivenza. Annali di medicina interna. 1991;115:720-6.
- Hellman NE, Gitlin JD. Metabolismo e funzione della ceruloplasmina. Revisione annuale della nutrizione., 2002;22:439-58.
- Scott J, Gollan JL, Samourian S, malattia di Sherlock S. Wilson, che si presenta come epatite cronica attiva. Gastroenterologia. 1978;74:645-51.
- German JL, 3rd, Bearn AG. Effetto degli estrogeni sul metabolismo del rame nella malattia di Wilson. Il Journal of clinical investigation. 1961;40:445-53.
- Mak CM, Lam CW, Tam S. Accuratezza diagnostica della ceruloplasmina sierica nella malattia di Wilson: determinazione della sensibilità e specificità mediante analisi della curva ROC tra soggetti genotipizzati ATP7B. Chimica clinica. 2008;54:1356-62.,
- Ferenci P, Steindl-Munda P, Vogel W, Jessner W, Gschwantler M, Stauber R, Datz C, Hackl F, Wrba F, Bauer P, Lorenz O. Valore diagnostico della determinazione quantitativa del rame epatico nei pazienti con malattia di Wilson. Gastroenterologia clinica ed epatologia : la rivista ufficiale di pratica clinica dell’American Gastroenterological Association. 2005;3:811-8.
- Shah AB, Chernov I, Zhang HT, Ross BM, Das K, Lutsenko S, Pavone L, Evgrafov O, Ivanova-Smolenskaya IA, Annerén G, Westermark K, Urrutia FH, Penchaszadeh GK, Sternlieb I, Scheinberg IH, Gilliam TC, Petrukhin K., Identificazione e analisi delle mutazioni nel gene della malattia di Wilson (ATP7B): frequenze di popolazione, correlazione genotipo-fenotipo e analisi funzionali. American journal of human genetics. 1997;61:317-28.
- Linee guida di pratica clinica EASL: malattia di Wilson. Rivista di epatologia. 2012;56:671-85.per maggiori informazioni clicca qui. Diagnosi della malattia di Wilson: un’esperienza di oltre tre decenni. Intestino. 2000;46:415-9.
- Tapper EB, Rahni DO, Arnaout R, Lai M. L’uso eccessivo della misurazione della ceruloplasmina sierica. L’American journal of medicine., 2013;126:926.e1-5.
- Goldstein IM, Kaplan HB, Edelson HS, Weissmann G. Ceruloplasmina: un reagente di fase acuta che elimina i radicali liberi derivati dall’ossigeno. Annali dell’Accademia delle Scienze di New York. 1982;389:368-79.
- Arredondo M, Nunez H, Lopez G, Pizarro F, Ayala M, Araya M. Influenza degli estrogeni sugli indicatori di rame: studi in vivo e in vitro. Ricerca di oligoelementi biologici. 2010;134:252-64.
- Dufour JF, Kaplan MM. Muddying the water: le sfide della malattia di Wilson non scompariranno presto. Gastroenterologia. 1997;113:348-50.
17. Schilsky ML, Ala A., Test genetici per la malattia di Wilson: disponibilità e utilità. Rapporti attuali di gastroenterologia. 2010;12:57-61.
Pagina 341
















Lascia un commento