Pensa a cosa succede a metà del cambiamento di colore. A questo punto le concentrazioni dell’acido e del suo ion sono uguali. In tal caso, annulleranno l’espressione Gentile.
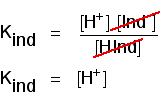
Puoi usarlo per capire qual è il pH in questo punto a metà strada., Se ri-disponi l’ultima equazione in modo che la concentrazione di ioni idrogeno sia sul lato sinistro e quindi converti in pH e pCind, ottieni:
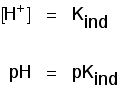
Ciò significa che il punto finale dell’indicatore dipende interamente dal suo valore di pCind. Per gli indicatori che abbiamo visto in precedenza, queste sono:
| indicatore | pKind |
|---|---|
| tornasole | 6.5 |
| metil arancio | 3.7 |
| fenolftaleina | 9.,3 |
L’intervallo di pH degli indicatori
Gli indicatori non cambiano colore bruscamente a un pH particolare (dato dal loro tipo). Invece, cambiano su un intervallo ristretto di pH.
Supponiamo che l’equilibrio sia saldamente da un lato, ma ora aggiungi qualcosa per iniziare a spostarlo. Man mano che l’equilibrio si sposta, inizierai a ottenere sempre più del secondo colore formato, e ad un certo punto l’occhio inizierà a rilevarlo.
Ad esempio, supponiamo di avere l’arancio metilico in una soluzione alcalina in modo che il colore dominante fosse giallo., Ora inizia ad aggiungere acido in modo che l’equilibrio inizi a spostarsi.
Ad un certo punto ci sarà abbastanza della forma rossa del presente metil arancio che la soluzione inizierà ad assumere una tinta arancione. Come si va ad aggiungere più acido, il rosso finirà per diventare così dominante che non si può longe vedere qualsiasi giallo.
C’è un graduale cambiamento graduale da un colore all’altro, che avviene su un intervallo di pH. Come una “regola empirica” approssimativa, il cambiamento visibile avviene circa 1 unità di pH su entrambi i lati del valore di pSind.,
I valori esatti per i tre indicatori che abbiamo visto sono:
| indicatore | pKind | intervallo di pH |
|---|---|---|
| tornasole | 6.5 | 5 – 8 |
| metil arancio | 3.7 | 3.1 – 4.4 |
| fenolftaleina | 9.3 | 8.3 – 10.0 |
La cartina tornasole del cambiamento di colore avviene su una gamma molto ampia, ma è utile per la rilevazione di acidi e alcali, in laboratorio, a causa del cambio di colore intorno a pH 7., L’arancio metilico o la fenolftaleina sarebbero meno utili.
Questo è più facilmente visibile schematicamente.
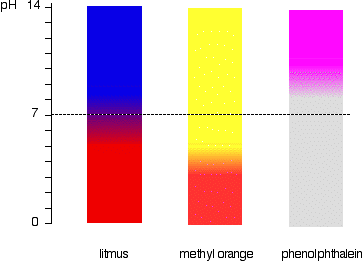
Ad esempio, l’arancio metilico sarebbe giallo in qualsiasi soluzione con un pH maggiore di 4.4. Non poteva distinguere tra un acido debole con un pH di 5 o un alcali forte con un pH di 14.
Scegliendo gli indicatori per le titolazioni
Ricorda che il punto di equivalenza di una titolazione è dove hai mescolato le due sostanze esattamente in proporzioni di equazione., Ovviamente è necessario scegliere un indicatore che cambia colore il più vicino possibile a quel punto di equivalenza. Che varia da titolazione a titolazione.
Acido forte v base forte
Il diagramma successivo mostra la curva del pH per aggiungere un acido forte a una base forte. Sovrapposti su di esso sono gli intervalli di pH per l’arancio metilico e la fenolftaleina.
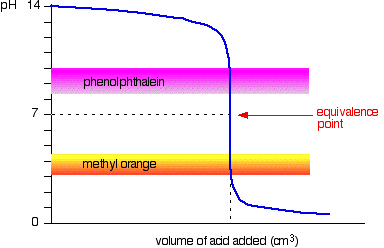
Puoi vedere che nessuno dei due indicatori cambia colore nel punto di equivalenza.,
Tuttavia, il grafico è così ripido a quel punto che non ci sarà praticamente alcuna differenza nel volume di acido aggiunto a seconda di quale indicatore si sceglie. Tuttavia, avrebbe senso per titolare al miglior colore possibile con ogni indicatore.
Se si utilizza la fenolftaleina, si titola fino a quando non diventa incolore (a pH 8.3) perché è il più vicino possibile al punto di equivalenza.
D’altra parte, usando l’arancia metile, si titolerebbe fino a quando non ci sarà la prima traccia di arancia nella soluzione., Se la soluzione diventa rossa, ti stai allontanando dal punto di equivalenza.
Acido forte v base debole
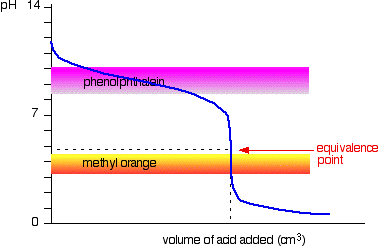
Questa volta è ovvio che la fenolftaleina sarebbe completamente inutile. Tuttavia, l’arancio metilico inizia a cambiare dal giallo all’arancione molto vicino al punto di equivalenza.
Devi scegliere un indicatore che cambia colore sulla punta ripida della curva.
Acido debole v forte base
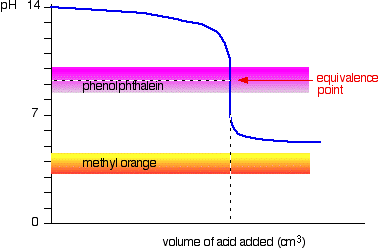
Questa volta, il metil arancione è senza speranza!, Tuttavia, la fenolftaleina cambia colore esattamente dove vuoi.
Acido debole v base debole
La curva è per un caso in cui l’acido e la base sono entrambi ugualmente deboli – ad esempio, acido etanoico e soluzione di ammoniaca. In altri casi, il punto di equivalenza sarà a qualche altro pH.
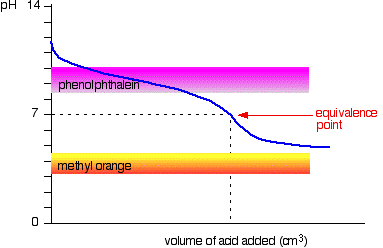
Puoi vedere che nessuno dei due indicatori è utile. La fenolftaleina avrà finito di cambiare molto prima del punto di equivalenza e l’arancia metile cade del tutto dal grafico.,
Potrebbe essere possibile trovare un indicatore che inizia a cambiare o finisce di cambiare nel punto di equivalenza, ma poiché il pH del punto di equivalenza sarà diverso da caso a caso, non è possibile generalizzare.
Nel complesso, non si titolerebbe mai un acido debole e una base debole in presenza di un indicatore.
Soluzione di carbonato di sodio e acido cloridrico diluito
Questo è un caso speciale interessante., Se si utilizza fenolftaleina o metil arancio, entrambi daranno un risultato di titolazione valido-ma il valore con fenolftaleina sarà esattamente la metà di quello metil arancio.
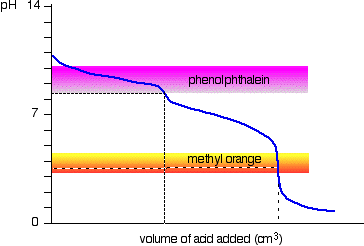
Si dà il caso che la fenolftaleina abbia terminato il suo cambiamento di colore esattamente al pH del punto di equivalenza della prima metà della reazione in cui viene prodotto l’idrogenocarbonato di sodio.
![]()
![]()
L’arancio metilico cambia colore esattamente al pH del punto di equivalenza del secondo stadio della reazione.,
![]()
![]()
le Domande per testare la vostra comprensione
Se questa è la prima serie di domande che hai fatto, si prega di leggere la pagina introduttiva prima di iniziare. Sarà necessario utilizzare il pulsante INDIETRO sul browser per tornare qui in seguito.
domande sugli indicatori
risposte
Dove vorresti andare ora?
Al menu equilibri acido-base . . .
Al menu Chimica fisica . . .
Al menu principale . . .,
















Lascia un commento