Introduzione
Cloroplasti rappresentano una caratteristica strutturale delle cellule vegetali e sostenere la sopravvivenza della pianta tramite il loro metabolismo primario e funzioni di alto livello (Kirk e Tilney-Bassett, 1978; Triglie, 1988; López-Juez e Pyke, 2005). Durante la crescita vegetativa delle piante, le cellule fogliari contengono una popolazione altamente omogenea di cloroplasti rispetto alle dimensioni e alla forma., Il numero di cloroplasti per cellula si ottiene mediante fissione binaria di organelli preesistenti e partizionamento in due cellule figlie durante la divisione cellulare (Birky, 1983; Possingham e Lawrence, 1983). Pertanto, la regolazione del numero di cloroplasti in un dato tipo di cellula è cruciale per la funzione cellulare e l’eredità genetica dei cloroplasti.
Per studiare la natura della determinazione del numero di cloroplasti nelle cellule vegetali, le cellule mesofille fogliari di specie rappresentative hanno svolto un ruolo importante ., Queste cellule sono fisiologicamente importanti per la fotosintesi e mostrano un alto grado di omogeneità strutturale e funzionale. Analisi di osservazione sistematica precoce di tessuti e cellule isolati (Boasson e Laetsch, 1969; Possingham e Saurer, 1969; Boffey et al., 1979; Lamppa et al.,, 1980; Thomas and Rose, 1983; Pyke and Leech, 1991) ha fornito molte informazioni utili sulla determinazione del numero di cloroplasti, inclusa la nozione che i cloroplasti (plastidi) non sono sintetizzati de novo ma replicati per divisione e l’osservazione che il numero di cloroplasti della mesofilla fogliare è sensibile a vari fattori ambientali e vegetali endogeni. Rispetto a quest’ultimo, negli spinaci, la luce ha un impatto positivo sulla divisione dei cloroplasti durante la coltura del disco fogliare rispetto a condizioni di oscurità o oscurità (Possingham e Lawrence, 1983)., Nelle prime foglie di grano, il volume cellulare è positivamente correlato alla proliferazione del cloroplasto (Ellis e Leech, 1985; Pyke e Leech, 1987). Nell’Arabidopsis, il background genetico influenza la proliferazione dei cloroplasti; il numero medio di cloroplasti per cellula nelle prime foglie è 121 nell’ecotipo Landsberg erecta (Ler) e 83 nell’ecotipo Wassilewskija (Ws) (Pyke and Leech, 1994; Pyke et al., 1994)., Le cellule di mesofilla fogliare hanno anche contribuito a comprendere il controllo genetico della divisione del cloroplasto; ad esempio, lo screening dei mutanti alterati nella proliferazione del cloroplasto e la caratterizzazione delle funzioni geniche coinvolte nella divisione del cloroplasto hanno rivelato oltre 20 geni che codificano componenti del macchinario della divisione del cloroplasto o fattori regolatori del cloroplasto (Gao e Gao, 2011; Miyagishima et al., 2011; Basak e Møller, 2013; Osteryoung e Pyke, 2014; Li et al., 2017).
Al contrario, studi sulla replicazione dei cloroplasti in cellule non mesofille (ad es.,, cellule della pavimentazione nell’epidermide della foglia; Itoh et al., 2018) sono scarsi. Recentemente, la regolazione della divisione dei cloroplasti è stata segnalata per differire tra i tessuti fogliari (Fujiwara et al., 2018; Itoh et al., 2018), anche se il meccanismo dettagliato rimane sconosciuto. Inoltre, mentre le analisi di sospensione-coltivate da-2 cellule e foglia mesofilla protoplasti nel tabacco e sparare apicale meristema e foglia cellule primordiali in Arabidopsis (Nebenführ et al., 2000; Sheahan et al.,, 2004; Seguí-Simarro e Staehelin, 2009) hanno fornito importanti approfondimenti, come il partizionamento del cloroplasto (plastid) sia regolato nelle piante non è ancora chiaro. Pertanto, nonostante un notevole sforzo, rimangono questioni fondamentali nella ricerca sui cloroplasti, come (i) come viene coordinato il numero di cloroplasti per cellula nei tessuti vegetali e (ii) come viene regolato il partizionamento dei cloroplasti nella divisione cellulare.,
Storia della ricerca sul numero di cloroplasti delle cellule di guardia
I GCS stomatici nell’epidermide del germoglio contengono generalmente cloroplasti e controllano lo scambio di gas tra la mesofilla fogliare e l’atmosfera (Sachs, 1875; Taiz et al., 2015; vedi Figura 1A). La prima indagine sul numero di cloroplasti GC nelle foglie è stata eseguita oltre un secolo fa in piante di Drosera coltivate naturalmente (Macfarlane, 1898)., Questo studio ha dimostrato che, come altre caratteristiche strutturali di piante e cellule, il numero di cloroplasti GC per cellula in un ibrido putativo derivato da un incrocio tra Drosera filiformis e Drosera intermedia era intermedio tra le due specie, il che implica che il numero di cloroplasti GC potrebbe essere utilizzato per determinare la composizione genetica di una pianta. Sono state successivamente riportate importanti osservazioni sulle differenze nel numero di cloroplasti GC tra le specie vegetali (Sakisaka, 1929) e sul numero di cloroplasti relativamente stabile in GCS nell’epidermide fogliare del gelso (Morus spp.,; Hamada e Baba, 1930) e in foglie mature di diverse specie di Brassica (Iura, 1934). Inoltre, l’analisi delle piante di barbabietola da zucchero autopoliploide (Beta vulgaris) ha rivelato che il numero di cloroplasti GC nelle foglie è positivamente correlato con il livello di ploidia nucleare delle piante (Mochizuki e Sueoka, 1955). Analisi più approfondite e complete sono state quindi condotte utilizzando vari campioni di piante per indagare la relazione tra numero di cloroplasti e dimensione stomatica con il livello di ploidia (ad esempio, Frandsen, 1968)., In queste analisi, cloroplasto il conteggio stomatica (GC coppia) livello è stato spesso adottato, che ha escluso l’effetto di parziale cloroplasto di distribuzione tra associati GCs (ad esempio, Mochizuki e Sueoka, 1955; Frandsen, 1968), rivelando che la media GC cloroplasto numero di foglie o cotiledoni in circa 80 specie, varianti, o ibridi variava da 2,8 a 40,0 in diploidi (2×) e 5.0 73.5 in tetraploids (4×). Inoltre, eventi di duplicazione dell’intero genoma nelle piante(cioè da 1× a 2×, da 2× a 4×, ecc.) causato un circa 1.,aumento di 7 volte del numero di cloroplasti GC ad alta fedeltà (recensito in Butterfass, 1973). Questi risultati hanno incoraggiato le indagini sul livello di ploidy in vari tessuti e piante ottenuti tramite coltura tissutale, incrocio o coltivazione naturale, in combinazione con trattamenti chimici (ad esempio, colchicina) o radiazioni (ad esempio, Jacobs e Yoder, 1989; Singsit e Veilleux, 1991; Qin e Rotino, 1995)., Mentre il numero di cloroplasti GC è stato studiato in biologia stomatica (Lawson, 2009) e in citologia per comprendere la moltiplicazione dei cloroplasti (Butterfass, 1979; vedi sotto), è stato in gran parte un marker affidabile e conveniente per la rilevazione di ibridi, specie e varianti e per la stima dei livelli di ploidia dei tessuti vegetali bersaglio.
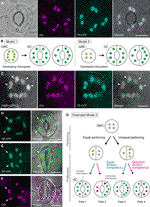
Figura 1 Modelli semplificati e prove di microscopia per il controllo del numero di cloroplasti nelle cellule di guardia stomatali (GCs)., (A) Una stoma tipica (coppia GC) nell’epidermide abassiale della lama fogliare Arabidopsis che esprime una fusione mirata allo stoma del peptide di transito (TP) con proteina fluorescente ciano (CFP; TP-CFP). (B) Due modelli di determinazione del numero di cloroplasti in GCS, che coinvolgono il partizionamento del cloroplasto (modello 1) o la proliferazione e il partizionamento del cloroplasto (modello 2) durante lo sviluppo di GC da cellule madri guard (GMCS). (C) Una coppia di GC nell’epidermide adaxial del picciolo della foglia di Arabidopsis che esprime TP-CFP e FtsZ1 fusi alla proteina fluorescente verde (GFP; FtsZ1-GFP)., (D-F) Coppie di GC nell’epidermide abassiale della lama della foglia di Arabidopsis con (D, E) o senza (F) l’espressione di TP fusa alla proteina fluorescente gialla (YFP; TP-YFP). (F) L’autofluorescenza della clorofilla (Chl) è stata utilizzata come marcatore del cloroplasto., (G) Modello esteso 2, che rappresenta il coinvolgimento del partizionamento del cloroplasto uguale e disuguale dopo la divisione GMC e la successiva divisione dei cloroplasti GC con competenza di divisione uguale (linea blu) o selettiva (linea rossa), che si tradurrebbe in quattro tipi di determinazione del numero di cloroplasti (Destini 1-4) durante lo sviluppo tardivo stomatico delle foglie di Arabidopsis. (A, C–F) La microscopia a epifluorescenza è stata eseguita con un microscopio invertito Olympus IX71 utilizzando materiali vegetali come descritto in precedenza (Fujiwara et al., 2017, Fujiwara et al., 2018)., I segnali di fluorescenza di clorofilla, CFP, GFP e YFP sono pseudo-colorati in magenta, ciano, verde (solo nell’immagine unita) e verde, rispettivamente. Le indicazioni nei pannelli sono le seguenti: punta di freccia, l’anello FtsZ1; freccia, cloroplasto GC ingrandito; linea tratteggiata, forma cellulare. Scala bar = 10 µm.
Utilità delle cellule di guardia fogliare per l’analisi del controllo del numero di cloroplasti
Le cellule di mesofilla fogliare sono state a lungo impiegate come modello primario per l’analisi del numero di cloroplasti., Mentre hanno vantaggi per lo studio degli effetti delle condizioni ambientali sulla divisione dei cloroplasti (ad esempio, la segnalazione della luce-citochinina; Boasson e Laetsch, 1969; Possingham e Lawrence, 1983; Okazaki et al., 2009; Chiang et al., 2012), sono limitati per alcuni aspetti. In primo luogo, le cellule della mesofilla fogliare variano in dimensioni e forma e sono distribuite in profondità all’interno della foglia, il che rende difficile manipolare i tessuti intatti., In secondo luogo, la suscettibilità della proliferazione del cloroplasto della mesofilla fogliare allo stress ambientale e alle condizioni di crescita delle piante può impedire confronti affidabili tra studi. Il numero di cloroplasti della mesofilla fogliare per cellula nell’ecotipo Arabidopsis Columbia (Col) è stato riportato variamente come 76 (Kinsman e Pyke, 1998), 80-100 (Stokes et al., 2000), 70 (Tirlapur e König, 2001), 41 (Yoder et al., 2007), 40-60 (Okazaki et al., 2009), e 30-40 (Kawade et al., 2013)., Inoltre, è quasi impossibile valutare il contributo del partizionamento del cloroplasto al numero finale di cloroplasto per cellula mesofilla durante lo sviluppo delle foglie, anche se si pensa che questo sia determinato dall’equilibrio tra il tasso di divisione cellulare e il tasso di divisione del cloroplasto. Per scoprire il meccanismo del controllo del numero di cloroplasti nelle cellule fogliari vegetative, è necessario un sistema modello che superi i problemi di cui sopra.
I GCS stomatali (vedi Figura 1A) mostrano le caratteristiche di un sistema modello per comprendere il meccanismo del controllo del numero di cloroplasti., I GCS sono altamente uniformi nella dimensione e nella forma all’interno di un tessuto e la loro distribuzione sparsa ma densa nello strato più esterno dei germogli facilita il loro rilevamento mediante microscopia a luce e fluorescenza. I GCS sono anche derivati da cellule protodermiche nel meristema apicale del germoglio o da cellule epidermiche embrionali, e la loro sequenza di sviluppo attraverso meristemoidi (un precursore stomatico con attività meristematica) e cellule madri di guardia (GMCS; un precursore delle coppie GC) è stabilita in dettaglio (Zhao e Sack, 1999; Nadeau e Sack, 2002; Kalve et al., 2014)., Lo sviluppo tardivo dello stomaco comporta un singolo ciclo di divisione GMC simmetrica, che consente la valutazione della distribuzione e del partizionamento del cloroplasto prima e dopo la citocinesi. Dal punto di vista degli esperimenti pratici, i GCS fogliari sono adatti alla microscopia. In precedenza è stato dimostrato che il numero di cloroplasti per cellula nei GCS fogliari di Sinapis alba era meno influenzato da condizioni di luce diverse rispetto a quelle delle cellule di mesofilla fogliare (Wild and Wolf, 1980)., Inoltre, la differenza nel numero di cloroplasti GC nei piccioli fogliari è relativamente minore tra i tre ecotipi Arabidopsis Col, Ler e Ws (Fujiwara et al., 2018). Inoltre, l’endoreduplicazione, che influisce sullo sviluppo della mesofilla fogliare, della pavimentazione e delle cellule dei tricomi, non è stata rilevata nei GCS fogliari di Arabidopsis (Melaragno et al., 1993), che assicurerebbe le interpretazioni dei dati del numero di cloroplasti a livello 2C delle cellule., Insieme, questi rapporti suggeriscono che leaf GCs sono potenzialmente un modello eccellente per l’analisi sistematica della dinamica dei numeri di cloroplasti in un particolare lignaggio cellulare.
Arabidopsis Leaf Guard Cells come modello per studiare il controllo del numero di cloroplasti
Nella storia della ricerca sui cloroplasti GC, il conteggio dei cloroplasti a livello stomatico (coppia GC) ha svolto un ruolo altrettanto importante nel determinare il numero di cloroplasti come conteggio a livello individuale GC. Entrambi i metodi producono lo stesso numero medio di cloroplasti (Butterfass, 1973)., Quando la variazione nella distribuzione dei cloroplasti in GCS accoppiati e il suo meccanismo sottostante sono oggetto di attenzione, le informazioni dettagliate dei cloroplasti a livello cellulare individuale, cioè la loro dimensione, forma e localizzazione intracellulare, sono essenziali. La proliferazione del cloroplasto (plastid) durante la differenziazione GMC–GC è stata precedentemente studiata in diverse specie vegetali (Butterfass, 1973, Butterfass 1979)., Questi studi hanno proposto due modelli per determinare il numero terminale di cloroplasti in GCS in diverse specie vegetali( Figura 1B): uno (modello 1; barbabietola da zucchero) coinvolge solo il partizionamento del cloroplasto alla divisione GMC, e l’altro coinvolge non solo il partizionamento del cloroplasto ma anche la proliferazione del cloroplasto durante lo sviluppo di GC.
Nell’era della genetica molecolare, della genomica, dell’imaging cellulare e di altre analisi interdisciplinari, ci sono molte possibilità per l’ulteriore caratterizzazione del meccanismo di partizionamento dei cloroplasti., Arabidopsis leaf GCs può essere uno dei migliori sistemi di modello per questo scopo. Diversi studi hanno esaminato il numero di cloroplasti GC nelle foglie o cotiledoni di Arabidopsis (Hoffmann, 1968; Pyke e Leech, 1994; Pyke et al., 1994; Robertson et al., 1995; Keech et al., 2007; Chen et al., 2009; Yu et al., 2009; Higaki et al., 2012; Fujiwara et al., 2018). Questi GCS presentano un numero modesto di cloroplasti, che vanno da 3,5 a 5,5 in media. Ad oggi, nessuno studio ha esaminato le alterazioni del numero di cloroplasti (plastidi) durante lo sviluppo stomatico., Tuttavia, prove microscopiche da analisi dello sviluppo stomatico (ad esempio, Zhao e Sack, 1999; Hachez et al., 2011) e le nostre osservazioni preliminari indicano che i GMC possono contenere un numero minore di cloroplasti in via di sviluppo rispetto ai GC e che la proliferazione dei cloroplasti può verificarsi durante la differenziazione dei GC. Per testare questo, la formazione del macchinario della divisione dei cloroplasti in GCs è stata monitorata con la sonda FtsZ1 fusa alla proteina fluorescente verde (FtsZ1-GFP) (Fujiwara et al., 2008)., Una linea transgenica, che esprime simultaneamente un CFP fuso con peptide di transito (TP) e FtsZ1-GFP per visualizzare rispettivamente lo stroma e l’anello FtsZ1, è stata esaminata mediante microscopia a epifluorescenza (Fujiwara et al., 2017). Sono stati impiegati piccioli fogliari in espansione (quinte foglie di piantine di 4 settimane). Di conseguenza, sono stati rilevati GCS con cloroplasti simmetricamente costrittori (Figura 1C). Questi cloroplasti formarono l’anello FtsZ1, un anello di divisione del cloroplasto sulla superficie stromale della membrana interna dell’involucro in mesofilla fogliare e cellule di pavimentazione (Vitha et al., 2001; Fujiwara et al.,, 2008), presso il sito di costrizione equatoriale. Coerente con il pattern stomatico nello sviluppo delle foglie di Arabidopsis (Donnelly et al., 1999; Andriankaja et al., 2012), la divisione dei cloroplasti è stata rilevata alla fine e all’inizio della fase di espansione delle foglie. Pertanto, il modello 2 è probabilmente la soluzione migliore per i GCS di foglie di Arabidopsis.
Relazione tra proliferazione e espansione del cloroplasto nelle cellule di protezione delle foglie di Arabidopsis
Inoltre, è stato osservato un fenotipo inaspettato di morfogenesi del cloroplasto GC in GCS maturi (Figure 1D, E)., Quando le bucce epidermiche delle foglie completamente espanse (lame del terzo-quarto foglio delle piantine di 4 settimane) da una linea fluorescente gialla TP-fusa della proteina (YFP) sono state caratterizzate microscopicamente (linea FL6-5; Fujiwara et al., 2018), alcuni stomi hanno mostrato modelli di distribuzione del cloroplasto disuguali in coppie GC, mentre la maggior parte degli stomi fogliari ha mostrato modelli di distribuzione del cloroplasto uguali o simili (Robertson et al., 1995; Fujiwara et al., 2018)., All’interno della coppia GC di uno stoma, la dimensione dei cloroplasti nel GC contenente un numero minore di cloroplasti era maggiore rispetto agli altri GCS nella coppia contenente un numero maggiore di cloroplasti (Figure 1D, E). In questo modo, i GCS probabilmente mantengono il volume totale di cloroplasto per cellula a un livello costante durante la crescita cellulare. I cloroplasti ingranditi rappresentavano il fenotipo terminale e non potevano più dividersi in foglie espanse. Questi risultati sono stati confermati in diversi esperimenti indipendenti, indipendentemente dall’espressione di una proteina fluorescente fusa con TP per l’etichettatura dello stroma (Figura 1F).,
Questo fenotipo di cloroplasto GC è interpretato come un meccanismo di compensazione per l’espansione del cloroplasto, che è stato ben documentato nelle cellule di mesofilla fogliare difettose nel controllo della divisione del cloroplasto (Pyke and Leech, 1994; Pyke et al., 1994). Ad oggi, solo uno studio (Ellis e Leech, 1985) ha riportato una correlazione negativa tra il numero di cloroplasti e la dimensione del cloroplasto nelle cellule di mesofilla fogliare del grano, mentre molti studi hanno riportato una correlazione positiva tra volume cellulare e numero di cloroplasti nelle normali cellule di mesofilla fogliare (Leech e Pyke, 1988; Pyke, 1997)., Mentre gli squilibri nel numero di cloroplasti GC si verificano a bassa frequenza (Fujiwara et al., 2018), l’eterogeneità del cloroplasto nelle coppie GC indica che il partizionamento disuguale del cloroplasto potrebbe innescare la crescita differenziale del cloroplasto tra le cellule fogliari di tipo selvaggio in Arabidopsis, nonostante la divisione cellulare simmetrica.
L’effetto di compensazione del cloroplasto nei GCS può essere meno rigoroso rispetto alle cellule di mesofilla fogliare., I GCS potrebbero essere in grado di resistere alla scarsità o alla completa perdita del volume totale di cloroplasto per cellula in mutanti di divisione del cloroplasto gravemente compromessi, come in Arabidopsis arc6 e atminE1 e tomato suffulta, mentre molti GCS mutanti hanno mostrato un numero ridotto di cloroplasti e dimensioni ingrandite del cloroplasto in modo simile alle cellule della mesofilla fogliare (Robertson et al., 1995; Forth e Pyke, 2006; Chen et al., 2009; Fujiwara et al., 2018)., In un mutante della divisione del cloroplasto tardivo, arc5, la riduzione del numero di cloroplasti GC non era associata ad un aumento significativo delle dimensioni del cloroplasto, a differenza delle cellule della mesofilla fogliare (Pyke e Leech, 1994). Un grado inferiore di espansione del cloroplasto in GCS rispetto alle cellule mesofille (Pyke e Leech, 1994; Barton et al., 2016), e la variazione dell’espansione del cloroplasto tra GCS, potrebbe essere alla base di un intervallo così ampio di volume totale di cloroplasto per GC., Inoltre, la tempistica della divisione del cloroplasto durante la differenziazione GMC–GC potrebbe influenzare significativamente il fenotipo terminale del cloroplasto GC. Sebbene sia necessaria un’ulteriore caratterizzazione dettagliata per affrontare questo problema, sembra plausibile che le foglie di Arabidopsis GCS rappresentino un sistema per indagare gli aspetti non sfruttati del controllo del numero di cloroplasti nelle cellule vegetali.,
Un modello di lavoro per la determinazione del numero di cloroplasti nelle cellule di protezione delle foglie di Arabidopsis
Sulla base di quanto sopra, proponiamo un modello di lavoro (un modello esteso 2) per l’analisi del numero di cloroplasti in GCs (Figura 1G). Il numero finale di cloroplasto per GC è determinato dal partizionamento del cloroplasto alla divisione GMC e dalla proliferazione del cloroplasto in GCS. Durante la divisione di GMC, i cloroplasti possono subire il partizionamento uguale o disuguale. Durante la proliferazione dei cloroplasti, i cloroplasti GC prolifereranno con una competenza di divisione uguale (linea blu) o selettiva (linea magenta)., Ad esempio, se i cloroplasti ugualmente partizionati possiedono una competenza di divisione equivalente, si verificheranno numeri uguali di cloroplasti nella coppia GC (Fate 1). Se i cloroplasti disegualmente partizionati possiedono una competenza di divisione equivalente, i cloroplasti aumenteranno allo stesso ritmo all’interno della coppia GC (Fate 3). Se la divisione selettiva del cloroplasto si verifica in GCS, il saldo del numero di cloroplasto nella coppia GC cambierà dopo la divisione GMC (Destini 2 e 4)., Attualmente è difficile trovare supporto per la “divisione selettiva del cloroplasto”, ma se i destini 1 e 4 predominano effettivamente nei GCS, allora potrebbero possedere un meccanismo che controlla il volume totale di cloroplasto per cellula, come nelle cellule mesofille fogliari. Il modello solleva due questioni: (i) I cloroplasti GC sono correttamente partizionati in cellule figlie e come si dividono? E (ii) la competenza di divisione dei cloroplasti GC è regolata in modo coordinato?,
Per quanto riguarda il problema (i), se l’ereditarietà del cloroplasto si verifica per distribuzione casuale di più cloroplasti nel citoplasma o per meccanismo di partizionamento positivo del cloroplasto è stata una preoccupazione di lunga data(Butterfass, 1969; Birky, 1983; Hennis e Birky, 1984; Nebenführ, 2007; Sheahan et al., 2016). Curiosamente, in Arabidopsis arc6, i GCS fogliari o cotiledoni hanno da zero a tre cloroplasti, e in GCS carenti di cloroplasti, i plastidi non fotosintetici esistono ancora in forme vescicolari o allungate (Robertson et al., 1995; Chen et al., 2009; Fujiwara et al., 2018)., Nessun GCS privo di plastidi di per sé è stato trovato in arc6, e nessuna spiegazione per questo è stata imminente, nonostante la rottura dell’apparato di divisione dei cloroplasti (Vitha et al., 2003). Di conseguenza, sarà importante esaminare la replicazione e la morfologia dei cloroplasti arc6 negli studi sul lignaggio stomatico. Arabidopsis mutant research può anche dare un altro indizio per questo problema., L’osservazione che il 18% dei GCS cotiledoni nel mutante foglia accartocciata (crl) non contengono strutture plastidiche nel citoplasma, mentre il 100% delle cellule mesofille fogliari contengono da uno a quattro cloroplasti ingranditi (Asano et al., 2004; Chen et al., 2009), è di grande importanza. Il CRL è una proteina dell’esterno-involucro del cloroplasto con una funzione sconosciuta. Comprendere la funzione della proteina CRL può fornire informazioni sui meccanismi del partizionamento del cloroplasto., L’analisi della proliferazione e del partizionamento dei cloroplasti nelle cellule della mesofilla fogliare nei mutanti dell’arco di Arabidopsis e in altre linee transgeniche ha promosso la ricerca sulla proliferazione e sul partizionamento dei plastidi non mesofilli. Allo stesso modo, i risultati ottenuti in GCs possono essere trasferibili ad altri sistemi cellulari.
Osservazione finale
Il modello GC apre molte prospettive per lo sviluppo della biologia dei cloroplasti. Ad esempio, mentre i sistemi citoscheletrici sono noti per regolare la morfologia del cloroplasto, il movimento e il partizionamento (Sheahan et al.,, 2016; Wada, 2016; Erickson e Schattat, 2018), il ruolo di ciascun gene regolatore nella proliferazione e nel partizionamento dei cloroplasti nelle piante ha ricevuto poca attenzione. D’altra parte, una volta che diventa possibile compromettere il numero o la morfologia del cloroplasto GC attraverso varie strategie sperimentali, possono essere fornite nuove intuizioni sul controllo molecolare della morfogenesi del cloroplasto nelle cellule del lignaggio stomatico. Inoltre, in combinazione con analisi quantitative del numero di cloroplasti durante lo sviluppo stomatico, la modellazione matematica può offrire una nuova strada per queste indagini., Questo articolo presenta le attuali conoscenze su come il numero di cloroplasti GC è controllato e mette in evidenza la potenziale utilità dei GCS di foglie di Arabidopsis per comprendere la proliferazione e il partizionamento dei cloroplasti.
Dichiarazione di disponibilità dei dati
Tutti i set di dati per questo studio sono inclusi nell’articolo / materiale supplementare.
Contributi dell’autore
MF ha ideato lo studio e scritto il manoscritto. MF e COME condotto gli esperimenti. AS e RI hanno condotto le analisi. Tutti gli autori hanno letto e approvato il manoscritto finale.,
Finanziamento
Questo lavoro è stato sostenuto dal Ministero dell’Istruzione, della Cultura, della Scienza e della Tecnologia del Giappone sotto KAKENHI (grant nn. 19K05831 a MF e 18K06314 a RI).
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Riconoscimenti
Gli autori ringraziano il Dr. Nobuyuki Kanzawa (Sophia University) per i consigli sul lavoro.
Birky, CW, Jr. (1983)., Il partizionamento degli organelli citoplasmatici a divisione cellulare. Int. Rev. Cytol. 15, 49-86.
Google Scholar
burro churn, T. (1969). La distribuzione del plastide nella mitosi delle cellule madri delle cellule di chiusura dello swedenklee aploide (Trifolium hybridum L.). Planta 84, 230-234. doi: 10.1007/BF00388108
PubMed Abstract | CrossRef Full Text/Google Scholar
butter churn, T. (1973). Controllo della divisione dei plastidi mediante quantità di DNA nucleare. Protoplasma 76, 167-195. doi: 10.,1007/BF01280696
CrossRef Full Text | Google Scholar
Qin, X., Rotino, G. L. (1995). Chloroplast number in guard cells as ploidy indicator of in vitro-grown androgenic pepper plantlets. Plant Cell Tissue Organ Cult. 41, 145–149. doi: 10.1007/BF00051583
CrossRef Full Text | Google Scholar
Sachs, J. (1875). Textbook of Botany. Oxford: Clarendon Press.
Google Scholar
Thomas, M. R., Rose, R. J. (1983)., Numero di plastidi e cambiamenti strutturali plastidi associati alla coltura del protoplasto mesofilico del tabacco e alla rigenerazione delle piante. Pianta 158, 329-338. doi: 10.1007/BF00397335
PubMed Abstract | CrossRef Full Text/Google Scholar
Tirlapur, Regno Unito, König, K. (2001). Laser a vicino infrarosso a femtosecondi come nuovo strumento per l’imaging time-lapse non invasivo in tempo reale ad alta risoluzione della divisione dei cloroplasti nelle cellule viventi della guaina del fascio di Arabidopsis. Planta 214, 1-10. doi: 10.,1007 / s004250100597
PubMed Abstract / CrossRef Full Text/Google Scholar
Wild, A., Wolf, G. (1980). L’effetto di diverse intensità di luce sulla frequenza e la dimensione degli stomi, la dimensione delle cellule, il numero, la dimensione e il contenuto di clorofilla dei cloroplasti nella mesofilla e nelle cellule di guardia durante l’ontogenesi delle foglie primarie di Sinapis alba. Z. Pflanzenfisiolo. Bd. 97, 325–342. doi: 10.1016/S0044-328X(80)80006-7
CrossRef Testo completo / Google Scholar
















Lascia un commento