All’aumentare della temperatura aumenta anche la velocità delle reazioni enzimatiche. Un aumento di dieci gradi centigradi della temperatura aumenterà l’attività della maggior parte degli enzimi dal 50% al 100%. Variazioni di temperatura di reazione piccole come 1 o 2 gradi possono introdurre cambiamenti del 10% al 20% nei risultati. Questo aumento è solo fino a un certo punto fino a quando la temperatura elevata rompe la struttura dell’enzima. Una volta che l’enzima è denaturato, non può essere riparato., Poiché ogni enzima è diverso nella sua struttura e nei legami tra amminoacidi e peptidi, la temperatura per la denaturazione è specifica per ciascun enzima. Poiché la maggior parte degli enzimi animali viene rapidamente denaturata a temperature superiori a 40°C, la maggior parte delle determinazioni enzimatiche viene effettuata leggermente al di sotto di tale temperatura.
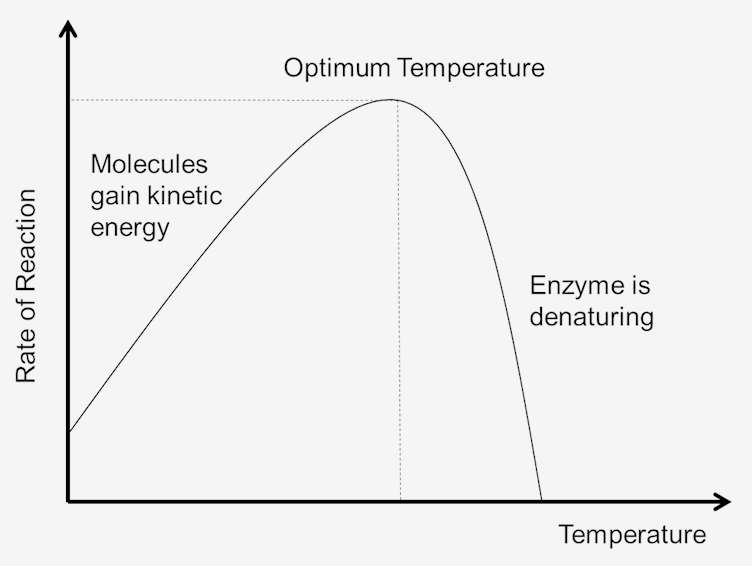 Figura 1. Effetto della temperatura sulla velocità di reazione.
Figura 1. Effetto della temperatura sulla velocità di reazione.
Per un periodo di tempo, gli enzimi saranno disattivati anche a temperature moderate. Lo stoccaggio degli enzimi a 5°C o sotto è generalmente il più adatto. Temperature più basse portano a reazioni chimiche più lente., Gli enzimi alla fine diventano inattivi a temperature di congelamento, ma ripristineranno la maggior parte della loro attività enzimatica quando le temperature aumentano di nuovo, mentre alcuni enzimi perdono la loro attività quando vengono congelati.
Energia cinetica ed energia interna
La temperatura di un sistema è in una certa misura una misura dell’energia cinetica delle molecole nel sistema. Le collisioni tra tutte le molecole aumentano all’aumentare della temperatura. Ciò è dovuto all’aumento della velocità e dell’energia cinetica che segue gli aumenti di temperatura. Con velocità più veloci, ci sarà meno tempo tra le collisioni., Ciò si traduce in più molecole che raggiungono l’energia di attivazione, che aumenta la velocità delle reazioni. Poiché anche le molecole si muovono più velocemente, aumentano anche le collisioni tra enzimi e substrati. Quindi più bassa è l’energia cinetica, più bassa è la temperatura del sistema e, allo stesso modo, maggiore è l’energia cinetica, maggiore è la temperatura del sistema.
All’aumentare della temperatura del sistema, l’energia interna delle molecole nel sistema aumenterà., L’energia interna delle molecole può includere l’energia traslazionale, l’energia vibrazionale e l’energia rotazionale delle molecole, l’energia coinvolta nel legame chimico delle molecole e l’energia coinvolta nelle interazioni non vincolanti. Parte di questo calore può essere convertita in energia potenziale chimica. Se questo aumento di energia potenziale chimico è abbastanza grande alcuni dei legami deboli che determinano la forma tridimensionale delle proteine attive possono essere rotti. Ciò potrebbe portare alla denaturazione termica della proteina e quindi inattivare la proteina., Così troppo calore può causare la velocità di una reazione catalizzata da enzimi a diminuire perché l’enzima o il substrato diventa denaturato e inattivo.
Temperatura ottimale
Ogni enzima ha un intervallo di temperatura in cui si ottiene una velocità massima di reazione. Questo massimo è noto come la temperatura ottimale dell’enzima. La temperatura ottimale per la maggior parte degli enzimi è di circa 98,6 gradi Fahrenheit (37 gradi Celsius). Ci sono anche enzimi che funzionano bene a temperature più basse e più alte., Ad esempio, gli animali artici hanno enzimi adattati a temperature ottimali più basse; gli animali nei climi desertici hanno enzimi adattati a temperature più elevate. Tuttavia, gli enzimi sono ancora proteine e, come tutte le proteine, iniziano a rompersi a temperature superiori a 104 gradi Fahrenheit. Pertanto, l’intervallo di attività enzimatica è determinato dalla temperatura alla quale l’enzima inizia ad attivarsi e dalla temperatura alla quale la proteina inizia a decomporsi.,
Servizi correlati
Enzyme Kinetics
Enzymology Assays
Per discutere ulteriori dettagli del servizio, vi preghiamo di contattarci chiamando 1-631-562-8517, o e-mail a [email protected].
















Lascia un commento