US Pharm. 2010;35(5):36-41.
Una relazione tra diabete mellito (DM) e demenza è innegabile, con numerosi studi che concludono che la DM aumenta il rischio di declino cognitivo e demenza, inclusa la malattia di Alzheimer (AD).1-5 Non solo il DM aumenta il rischio di demenza, ma aumenta effettivamente il tasso di sviluppo della demenza da due a tre volte.,3 Il meccanismo di questa compromissione non è completamente compreso, ma si ipotizza che l’iperglicemia, la resistenza all’insulina, lo stress ossidativo, i prodotti finali avanzati di glicazione e le citochine infiammatorie portino collettivamente a disfunzioni cognitive.5 In effetti, il diabete è stato descritto come un” tipo speciale di invecchiamento accelerato ” nel 1976 a causa delle sue molte complicazioni associate.,5 L’apparente sovrapposizione tra DM e demenza ha portato al suggerimento che l’AD non sia solo un disturbo neurologico, ma piuttosto un disturbo neuroendocrino, con Steen et al che ha coniato il termine diabete di tipo 3 per descrivere questa malattia ibrida.,6
Panoramica di Insulino-Resistenza/Tolleranza Alterata del Glucosio
Fisiopatologia: Sia alterata tolleranza al glucosio—definito come il glucosio plasmatico di 140 mg/dL a 199 mg/dL dopo un test di tolleranza al glucosio orale—e alterata glicemia a digiuno—definito come una glicemia a digiuno di 100 mg/dL a 125 mg/dL—sono diagnostici di prediabete (precursore di tipo 2 DM ), in quanto è una emoglobina A1C del 5,7% al 6,4%.7 La fisiopatologia del prediabete è la stessa di quella del T2DM, che viene diagnosticata dopo una glicemia a digiuno di 126 mg / dL o superiore o un A1C di 6.,5% o superiore (prova ripetuta per conferma).7 In entrambe le condizioni, la resistenza all’insulina si sviluppa nei tessuti periferici, dove l’insulina è necessaria per l’assorbimento del glucosio (cioè muscoli, fegato e grasso), e il pancreas è costretto a fornire sempre più insulina per superare questa resistenza.8 In questa fase, i pazienti sono spesso iperinsulinemici; tuttavia, nel tempo, il pancreas non può soddisfare le richieste dei tessuti e le cellule beta del pancreas che producono insulina lentamente falliscono, producendo sempre meno insulina.,8 Senza insulina sufficiente, le concentrazioni di glucosio nel sangue aumentano, portando a prediabete e, fino al 70% dei pazienti con prediabete, T2DM.9 Le complicanze dell’iperglicemia sono molteplici e comprendono un aumentato rischio di complicanze macrovascolari (tra cui infarto miocardico, accidente cerebrovascolare e malattia vascolare periferica) e complicanze microvascolari (tra cui nefropatia, neuropatia e retinopatia).7
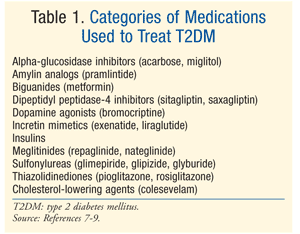
Trattamento: esistono molte terapie per trattare DM., Il trattamento iniziale sia per prediabetes che per T2DM è modifica di stile di vita che comprende la dieta, l’esercizio fisico e la perdita di peso.7 L’American Diabetes Association (ADA) raccomanda anche la considerazione della metformina nei pazienti con prediabete che sono ad alto rischio di sviluppare il diabete.La metformina è raccomandata come terapia farmacologica iniziale per T2DM.7 Spesso, è necessaria una terapia farmacologica aggiuntiva per raggiungere gli obiettivi glicemici ADA, incluso un A1C < 7%.,7 Esistono numerose classi di farmaci per T2DM (TABELLA 1) e la scelta dell’agente per normalizzare la glicemia dipende da una serie di fattori specifici per il paziente e il farmaco. È importante notare che molti pazienti con T2DM eventualmente richiederanno l’insulina esogena raggiungere e mantenere l’euglicemia mentre la funzione delle beta-cellule declina progressivamente.
Panoramica di AD
Fisiopatologia: l’AD è la forma più comune di demenza negli adulti più anziani, rappresentando dal 60% all ‘ 80% di tutti i casi.,10 Due caratteristiche istopatologiche di AD sono placche neuritiche e grovigli neurofibrillari.11 Placche sono costituite da proteina beta-amiloide insolubile. I grovigli, che sono intracellulari, sono composti da proteina tau fosforilata. La proteina Tau è importante per l’assemblea dei microtubuli e quando questa proteina è fosforilata anormalmente, la funzione neuronale è interrotta. I grovigli neurofibrillari colpiscono più comunemente i neuroni colinergici.12 Inoltre, la rottura del principale neurotrasmettitore eccitatorio, il glutammato, contribuisce alla patologia dell’AD., In AD, c’è un’iperattivazione del glutammato, segnalando un processo noto come eccitotossicità, che porta alla formazione di placca, iperfosforilazione della proteina tau e morte cellulare.12 In sintesi, l’eccitotossicità e la formazione di placche neuritiche e grovigli neurofibrillari interrompono le vie dei neurotrasmettitori, con conseguente compromissione dell’apprendimento e della memoria associata all’AD.
Trattamento: Le terapie farmacologiche approvate dalla FDA disponibili per l’AD sono riassunte nella TABELLA 2.,11,12 Mentre c’è ancora molto da imparare per quanto riguarda le terapie che trattano o alterano la patologia dell’AD, le terapie attualmente disponibili prevedono l’uso di inibitori dell’acetilcolinesterasi, di cui ce ne sono quattro, e l’antagonista del recettore N-metil-d-aspartato memantina.

Insulina e Cervello
Sebbene sia necessaria per il trasporto del glucosio nei tessuti periferici, l’insulina non sembra essere necessaria per il trasporto del glucosio nel cervello o per il metabolismo cerebrale del glucosio., Mentre il trasporto del glucosio al cervello non dipende dall’insulina, l’insulina stessa viene trasportata attraverso la barriera emato–encefalica (BBB) da processi di trasporto mediati dal recettore dell’insulina.13 Questo meccanismo di trasporto è saturabile; su periodi prolungati di concentrazioni di insulina in eccesso (iperinsulinemia) nella periferia, come quelli osservati in prediabete e T2DM, questo meccanismo di trasporto mediato dal recettore si riduce, riducendo così il trasporto di insulina nel cervello e nel liquido cerebrospinale.,
Oltre all’insulina, il fattore di crescita insulino-simile di tipo 1 (IGF-1) è presente nel cervello ed è necessario per la normale crescita e la funzione del sistema nervoso centrale (SNC).14 Recettori dell’insulina e IGF-1 si trovano in tutto il cervello su neuroni e astrociti (cellule a forma di stella nel SNC che aiutano a supportare i neuroni nel cervello). Due aree del cervello che sono cruciali per l’apprendimento e la memoria, l’ippocampo e l’ipotalamo, contengono alte concentrazioni di recettori dell’insulina.5 Nei ratti, la somministrazione intracerebroventricolare di insulina ha dimostrato di migliorare la memoria.,Inoltre, è stato riscontrato che la somministrazione intranasale di insulina nell ‘ uomo aumenta le prestazioni della memoria.16 Come notato in precedenza, l’insulina non è necessaria per il metabolismo del glucosio cerebrale; tuttavia, ci possono essere aree specifiche nel cervello in cui l’insulina innesca processi metabolici che coinvolgono il glucosio. Negli studi sui ratti, l’insulina ha dimostrato di influenzare l’utilizzo del glucosio nell’ipotalamo e nel locus coeruleus, due aree importanti per l’apprendimento e la memoria.,17 L’apprendimento ha anche dimostrato di facilitare una maggiore espressione dei recettori dell’insulina del SNC, portando alla postulazione che la presenza e l’attività dell’insulina nel cervello contribuiscono e svolgono un ruolo essenziale nell’apprendimento e nella memoria. L’insulina può anche contribuire alla modulazione dei neurotrasmettitori del SNC, in particolare acetilcolina e noradrenalina, entrambi fondamentali per la normale cognizione e la salute del cervello.,18
Insulino-resistenza e demenza
Panoramica: Sembrano esserci molti difetti nella segnalazione di insulina nel cervello dei pazienti AD, che portano a una diminuzione dell’utilizzo del glucosio e del metabolismo energetico.6,19 Poiché T2DM è associato all’insulino-resistenza periferica, l’AD è associato all’insulino-resistenza cerebrale.20 All’inizio di AD, sembra che ci sia inadeguato assorbimento di insulina e segnalazione nel cervello, un segno di insulino-resistenza.5,19,21,22 Aumento dei recettori dell’insulina sono stati osservati nel cervello di pazienti con AD, probabilmente come compensazione per la resistenza all’insulina.,21
Nel complesso, questa compromissione nella segnalazione dell’insulina ha molti effetti a valle nell’AD. Una teoria è che basse concentrazioni di insulina nel SNC causano una diminuzione dei livelli di acetilcolina e del flusso sanguigno cerebrale.13 Inoltre, alterazioni delle concentrazioni di insulina possono favorire la formazione di beta-amiloidi e proteine tau.2 Nel cervello, l’enzima degradante l’insulina (IDE) è coinvolto nella degradazione e nella clearance delle proteine beta-amiloidi.21 Alti livelli di insulina inibiscono l’IDE e possono portare ad una diminuzione della clearance beta-amiloide, aumentando successivamente la deposizione cerebrale di beta-amiloide.,5,19,21
Recentemente le ceramidi, una famiglia di lipidi, hanno attirato l’attenzione per il loro potenziale ruolo nella resistenza all’insulina e nella demenza.23,24 Ceramidi sono generati in presenza di infiammazione, che è comune nell’obesità, T2DM e AD.24 Poiché la ceramide attraversa prontamente il BBB, l’esposizione provoca una compromissione del metabolismo energetico e alterazioni dell’espressione genica dell’insulina, contribuendo alla resistenza all’insulina.23,24 Questa è attualmente un’area attiva di interesse, con i ricercatori che dimostrano che l’inibizione della sintesi di ceramide ha impedito l’insulino-resistenza mediata dall’obesità.,insulina intranasale: Come accennato in precedenza, la somministrazione di insulina intranasale migliora le prestazioni della memoria nell ‘ uomo.Sono stati condotti diversi studi sull ‘ insulina intranasale. Dopo la somministrazione di 20 unità di insulina intranasale due volte al giorno in soggetti umani, Reger et al hanno riscontrato che, rispetto al placebo, il gruppo trattato con insulina conservava più informazioni verbali e mostrava un miglioramento dell’attenzione e dello stato funzionale.,25 Questi ricercatori hanno anche notato che il glucosio plasmatico a digiuno e l’insulina non sono cambiati con l’uso di insulina intranasale, indicando che la somministrazione intranasale fornisce un accesso diretto all’insulina al SNC senza effetti periferici.25,26
Agonisti PPAR-Gamma: ampiamente studiati per il trattamento dell’insulino-resistenza periferica, i tiazolidinedioni rosiglitazone e pioglitazone sono in fase di studio per il loro ruolo nel trattamento della AD. I tiazolidinedioni sono agonisti del recettore attivato dal proliferatore del perossisoma (PPAR)-gamma., PPAR-gamma è coinvolto nel metabolismo del glucosio e dei lipidi e modula l’infiammazione, un noto collaboratore di AD.22,27 I tiazolidinedioni sono sensibilizzanti all ‘insulina, che agiscono per ridurre la resistenza all’ insulina; sembrano inoltre diminuire l ‘ infiammazione.21,26 In diversi studi clinici controllati con placebo, i pazienti trattati con rosiglitazone hanno mostrato un miglioramento della memoria e della funzione cognitiva.Sebbene siano stati condotti solo piccoli studi su pioglitazone, questo farmaco è stato anche associato a miglioramenti nella memoria e nella cognizione.,Sebbene pioglitazone e rosiglitazone abbiano una scarsa permeabilità alla BBB, ciascuno di questi agenti è stato documentato nel cervello dopo somministrazione orale.22 Sebbene questi farmaci possano svolgere un ruolo nella prevenzione o nel trattamento dell’AD, non sono attualmente approvati dalla FDA per i pazienti con AD e i loro potenziali benefici e rischi devono essere attentamente considerati su base individuale.
Esercizio aerobico: forse il metodo più efficace e più trascurato per ridurre la resistenza all’insulina è l’attività fisica., L’obesità è stata associata ad un aumentato rischio di insulino-resistenza, diabete, demenza e AD.29,30 L’esercizio migliora la sensibilità all’insulina e abbassa i livelli di insulina periferica.26,31 L’attività fisica, indipendente dal peso, è associata a un minor rischio di AD, rendendolo l’unica terapia neuroprotettiva provata.29-31 Un possibile meccanismo di questa neuroprotezione è che l’esercizio promuove la clearance delle proteine beta-amiloidi e aumenta il fattore neurotrofico derivato dal cervello, un fattore di crescita vitale per la cognizione e la sopravvivenza neuronale che si riduce nell’AD.,32
Ruolo del farmacista
I farmacisti svolgono un ruolo essenziale nell’educare i pazienti sulle nuove terapie; devono anche rimanere al passo con le nuove scoperte mediche o le condizioni che vengono spesso presentate nelle notizie. Il diabete di tipo 3 è una di queste condizioni. Mentre rimane molto da imparare su questo potenziale nuovo legame tra diabete e cognizione alterata, il pubblico chiederà l’opinione dei propri fornitori di assistenza sanitaria. Inoltre, molti pazienti con diabete saranno interessati a saperne di più e si rivolgeranno ai loro farmacisti per informazioni., Pertanto, i farmacisti dovrebbero discutere l’attuale comprensione di questa condizione con i loro pazienti e anche consigliarli sulle strategie che possono ridurre il loro rischio, date le loro comorbidità individuali.
Conclusione
È in corso uno studio intensivo nel tentativo di caratterizzare meglio il diabete di tipo 3 e di sviluppare strategie preventive e terapeutiche. Ad oggi, non ci sono trattamenti specifici con comprovata efficacia nella prevenzione del declino cognitivo o AD in pazienti con DM., Pertanto, la gestione del deterioramento cognitivo nei pazienti con DM è identica a quella dei pazienti senza DM, con particolare attenzione al controllo glicemico e ai fattori di rischio cardiovascolare. Questo è lo stesso approccio già essenziale per prevenire le complicanze correlate alla DM. Mentre alcuni gruppi di pazienti sembrano essere ad aumentato rischio di deterioramento cognitivo, la maggior parte dei pazienti con DM non ha associazioni cliniche ben definite., Sebbene non siano disponibili opzioni di trattamento specifiche, l’attuale approccio logico è quello di raggiungere il controllo glicemico e gestire prudentemente i fattori di rischio cardiovascolare, come l’iperlipidemia e l’ipertensione.
1. Stewart R, Liolitsa D. Diabete mellito di tipo 2, deterioramento cognitivo e demenza. Diabetologia.
2. Xu WL, von Strauss E, Qiu CX, et al. Il diabete incontrollato aumenta il rischio di malattia di Alzheimer: uno studio di coorte basato sulla popolazione. Diabetologia. 2009;52:1031-1039.
3. Arvanitakis Z, Wilson RS, Bennett DA. Diabete mellito, demenza e funzione cognitiva nelle persone anziane., J Nutr Salute Invecchiamento. 2006;10:287-291.
4. I nostri servizi sono a vostra disposizione. Effetto a lungo termine del diabete e del suo trattamento sulla funzione cognitiva. N Ingl J Med. 2007;356:1842–1852.
5. Whitmer RA. Diabete di tipo 2 e rischio di deterioramento cognitivo e demenza. Curr Neurol Neurosci Rep. 2007;7:373-380.
6. Steen E, Terry BM, Rivera EJ, et al. Alterata insulina e l’espressione del fattore di crescita insulino-simile e meccanismi di segnalazione nella malattia di Alzheimer – è questo diabete di tipo 3? J Alzheimer Dis. 2005;7:63-80.
7. American Diabetes Association. Standard di assistenza medica nel diabete-2010., Cura del diabete.
8. Triplitt Cl, Reasner CA, Isley WL. Diabete mellito. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Principi farmacoterapeutici& Pratica. 7a ed. New York, NY: McGraw Hill Medical; 2008: 1205-1241.
9. Nathan DM, Buse JB, Davidson MD, et al. Gestione medica dell’iperglicemia nel diabete di tipo 2: un algoritmo di consenso per l’inizio e l’aggiustamento della terapia: una dichiarazione di consenso dell’American Diabetes Association e dell’European Association for the Study of Diabetes. Cura del diabete.
10. Hebert LE, Scherr PA, Bienias JL, et al., Malattia di Alzheimer nella popolazione degli Stati Uniti: stime di prevalenza utilizzando il censimento del 2000. Arch Neurol. 2003;60:1119-1122.
11. Cummings J. Malattia di Alzheimer. N Ingl J Med. 2004;351:56-67.
12. Slattum PW, Swerdlow RH, Hill AM. Malattia di Alzheimer. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Principi farmacoterapeutici& Pratica. 7a ed. New York, NY: McGraw Hill Medical; 2008: 1051-1065.
13. Craft S, Watson GS. Insulina e malattia neurodegenerativa: meccanismi condivisi e specifici. Lancet Neurol. 2004;3:169-178.
14. de la Monte SM, Bacchette JR., Revisione dell’insulina e dell’espressione del fattore di crescita insulino-simile, segnalazione e malfunzionamento nel sistema nervoso centrale: rilevanza per la malattia di Alzheimer. J Alzheimer Dis. 2005;7:45-61.
15. Parco CR, Seeley RJ, Mestiere S, Boschi SC. L’insulina intracerebroventricolare migliora la memoria in un compito di evitamento passivo. Physiol Behav. 2000;68:509-514.
16. Fehm HL, Perras B, Smolnik R, et al. Manipolare i percorsi neuropeptidergici negli esseri umani: un nuovo approccio alla neurofarmacologia? Eur J Pharmacol. 2000;405:43-54.
17. Zhao WQ, Alkon DL. Ruolo dell’insulina e del recettore dell’insulina nell’apprendimento e nella memoria., Endocrinol delle cellule di Mol. 2001;177:125-134.
18. Kopf S, Baratti C. Effetti della somministrazione post-allenamento di insulina su ritenzione di una risposta di assuefazione nei topi: partecipazione di un meccanismo colinergico centrale. Neurobiol Impara Mem.
19. Revill P, Moral MA, Prous JR. Segnalazione alterata dell’insulina e patogenesi della malattia di Alzheimer. Farmaci oggi (Barc). 2006;42:785-790.
20. Moroz N, Tong M, Longato L, et al. Neurodegenerazione di tipo Alzheimer limitata nell’obesità sperimentale e nel diabete mellito di tipo 2. J Alzheimer Dis. 2008;15:29-44.
21. Haan MN., Insight Therapy: diabete mellito di tipo 2 e rischio di malattia di Alzheimer ad esordio tardivo. Nat Clin Pract Neurol. 2006;2:159-166.
22. Landreth G, Jiang Q, Madrekar S, et al. Agonisti PPARgamma come terapia per il trattamento della malattia di Alzheimer. Neuroterapeutica. 2008;5:481-489.
23. Lyn-Cook LE, Lawton M, Tong M, et al. La ceramide epatica può mediare la resistenza all’insulina cerebrale e la neurodegenerazione nel diabete di tipo 2 e nella steatoepatite non alcolica. J Alzheimer Dis.
24. Tong M, de la Monte SM. Meccanismi di neurodegenerazione mediata da ceramide. J Alzheimer Dis.
25., Reger MA, Watson GS, Verde PS. L’insulina intranasale migliora la cognizione e modula la beta-amiloide all’inizio dell’AD. Neurologia. 2008;70:440-448.
26. Craft S. Sindrome da insulino-resistenza e malattia di Alzheimer: effetti legati all’età e all’obesità sulla memoria, sull’amiloide e sull’infiammazione. Invecchiamento Neurobiol. 2005;26 (suppl 1): 65-69.
27. Jiang Q, Heneka M, Landreth GE. Il ruolo del recettore-gamma attivato dal proliferatore del perossisoma (PPARgamma) nella malattia di Alzheimer: implicazioni terapeutiche. Farmaci del SNC. 2008;22:1-14.
28. I nostri servizi sono a vostra disposizione., Cognizione conservata in pazienti con malattia di Alzheimer precoce e deficit cognitivo lieve amnestico durante il trattamento con rosiglitazone: uno studio preliminare. Am J Geriatr Psichiatria. 2005;13:950-958.
29. Luchsinger JA, Mayeux R. Adiposità e malattia di Alzheimer. Curr Alzheimer Res. 2007;4:127-134.
30. Whitmer RA. L’epidemiologia dell’adiposità e della demenza. Curr Alzheimer Res. 2007;4:117-122.
31. Watson GS, Craft S. Il ruolo della resistenza all’insulina nella patogenesi della malattia di Alzheimer: implicazioni per il trattamento. Farmaci del SNC. 2003;17:27-45.
32. Cole GM, Frautschy SA., Il ruolo dell’insulina e della segnalazione del fattore neurotrofico nell’invecchiamento cerebrale e nella malattia di Alzheimer. Scad Gerontol. 2007;42:10-21.
















Lascia un commento