pensez à ce qui se passe à mi-chemin du changement de couleur. À ce stade, les concentrations de l’acide et de son ion sont égales. Dans ce cas, ils annuleront l’expression aimable.
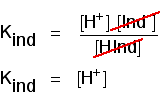
Vous pouvez l’utiliser pour travailler ce que le pH est à ce point à mi-chemin., Si vous réorganisez la dernière équation de sorte que la concentration en ions hydrogène soit sur le côté gauche, puis convertissez en pH et pnkind, vous obtenez:
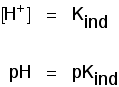
cela signifie que le point final de l’indicateur dépend entièrement de sa valeur pnkind. Pour les indicateurs que nous avons vu ci-dessus, ce sont:
| voyant | pKind |
|---|---|
| tournesol | 6.5 |
| méthyle orange | 3.7 |
| phénolphtaléine | 9.,3 |
la plage de pH des indicateurs
Les indicateurs ne changent pas brusquement de couleur à un pH particulier (donné par leur pnkind). Au lieu de cela, ils changent sur une plage étroite de pH.
supposons que l’équilibre est fermement d’un côté, mais maintenant vous ajoutez quelque chose pour commencer à le déplacer. Au fur et à mesure que l’équilibre change, vous commencerez à obtenir de plus en plus de la deuxième couleur formée, et à un moment donné, l’œil commencera à la détecter.
par exemple, supposons que vous ayez de l’orange méthylique dans une solution alcaline de sorte que la couleur dominante soit jaune., Maintenant, commencez à ajouter de l’acide pour que l’équilibre commence à se déplacer.
à un moment donné, il y aura assez de la forme rouge de l’orange méthylique présente que la solution commencera à prendre une teinte orange. Au fur et à mesure que vous ajoutez plus d’acide, le rouge finira par devenir si dominant que vous ne pourrez plus voir de jaune.
Il y a un changement progressif et lisse d’une couleur à l’autre, qui se produit sur une plage de pH. comme une « règle empirique » approximative, le changement visible a lieu environ 1 unité de pH de chaque côté de la valeur pKind.,
les valeurs exactes pour les trois indicateurs que nous avons examinés sont:
| indicateur | pKind | plage de pH |
|---|---|---|
| tournesol | 6.5 | 5 – 8 |
| orange méthylique | 3.7 | 3.1 – 4.4 |
| phénolphtaléine | 9.3 | 8.3 – 10.0 |
le changement de couleur du tournesol se produit sur une plage inhabituellement large, mais il est utile pour détecter les acides et les alcalis change de couleur autour du pH 7., L’orange méthylique ou la phénolphtaléine seraient moins utiles.
ceci est plus facilement visible sous forme de diagramme.
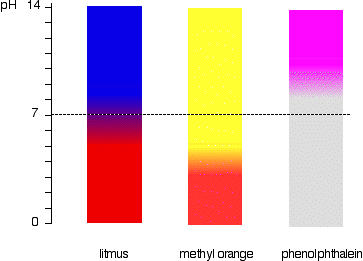
Par exemple, méthyle orange jaune toute solution avec un pH supérieur à 4.4. Il ne pouvait pas distinguer entre un acide faible avec un pH de 5 ou un alcali fort avec un pH de 14.
choix des indicateurs pour les titrages
rappelez-vous que le point d’équivalence d’un titrage est l’endroit où vous avez mélangé les deux substances dans des proportions exactement équivalentes., Vous devez évidemment choisir un indicateur qui change de couleur le plus près possible de ce point d’équivalence. Qui varie de titrage pour le titrage.
acide fort v base forte
Le diagramme suivant montre la courbe de pH pour ajouter un acide fort à une base forte. Les plages de pH de l’orange méthylique et de la phénolphtaléine y sont superposées.
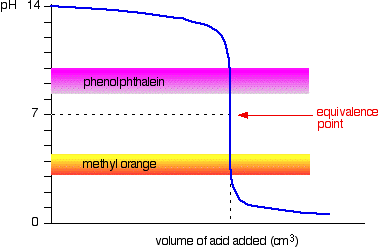
Vous pouvez voir que ni l’indicateur change de couleur au point d’équivalence.,
cependant, le graphique est si raide à ce moment-là qu’il n’y aura pratiquement aucune différence dans le volume d’acide ajouté quel que soit l’indicateur que vous choisissez. Cependant, il serait logique de titrer à la meilleure couleur possible avec chaque indicateur.
Si vous utilisez la phénolphtaléine, vous titrerez jusqu’à ce qu’elle devienne incolore (à pH 8,3) car c’est aussi proche que possible du point d’équivalence.
d’autre part, en utilisant de l’orange méthylique, vous titreriez jusqu’à ce qu’il y ait la toute première trace d’orange dans la solution., Si la solution devient rouge, vous vous éloignez du point d’équivalence.
acide Fort v la faiblesse de la base
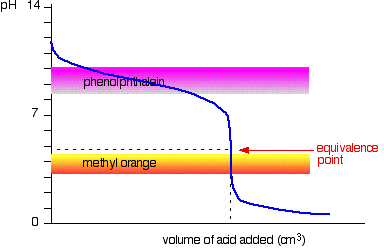
Cette fois, il est évident que la phénolphtaléine serait complètement inutile. Cependant, l’orange méthylique commence à passer du jaune à l’orange très près du point d’équivalence.
Vous devez choisir un indicateur qui change de couleur sur le peu raide de la courbe.
acide Faible v base solide
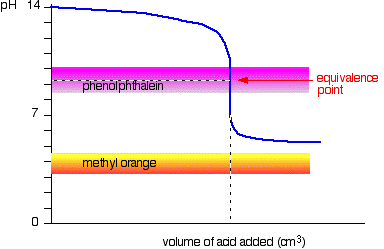
Cette fois, le méthyle orange est sans espoir!, Cependant, la phénolphtaléine change de couleur exactement où vous le souhaitez.
acide faible v base faible
la courbe est pour un cas où l’acide et la base sont tous deux également faibles – par exemple, l’acide éthanoïque et une solution d’ammoniac. Dans d’autres cas, le point d’équivalence sera à un autre pH.
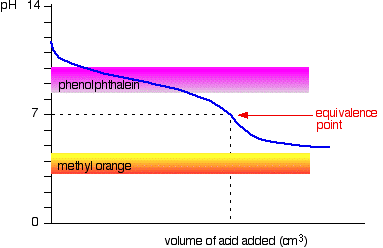
Vous pouvez voir que ni l’indicateur est d’aucune utilité. La phénolphtaléine aura fini de changer bien avant le point d’équivalence, et l’orange méthylique tombe complètement du graphique.,
Il peut être possible de trouver un indicateur qui commence à changer ou finitions changer au point d’équivalence, mais parce que le pH du point d’équivalence sera différent d’un cas à l’autre, vous ne pouvez pas généraliser.
dans l’ensemble, on ne titrerait jamais un acide faible et une base faible en présence d’un indicateur.
solution de carbonate de Sodium et l’acide chlorhydrique dilué
C’est un cas intéressant d’une., Si vous utilisez la phénolphtaléine ou l’orange méthylique, les deux donneront un résultat de titrage VALIDE – mais la valeur avec la phénolphtaléine sera exactement la moitié de l’orange méthylique.
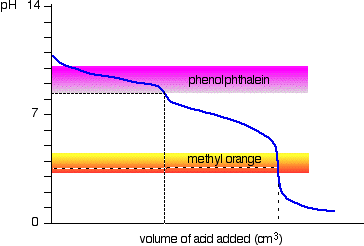
Il se trouve que la phénolphtaléine a terminé son changement de couleur exactement le pH du point d’équivalence de la première moitié de la réaction dans laquelle sodium hydrogencarbonate est produit.
![]()
![]()
Le méthyle orange change de couleur à exactement le pH du point d’équivalence de la deuxième étape de la réaction.,
![]()
![]()
les Questions pour tester votre compréhension
Si c’est la première série de questions que vous avez fait, merci de lire la page d’introduction avant de commencer. Vous devrez utiliser le bouton Retour de votre navigateur pour revenir ici par la suite.
les questions sur les indicateurs
réponses
Où aimeriez-vous aller maintenant?
Au menu équilibres acido-basiques . . .
Au menu de Chimie Physique . . .
Au Menu Principal . . .,
















Laisser un commentaire