| a Sheffieldi Egyetem | |
| Kémiai Tanszék | VSEPR | Lewis felépítése: |
| a Központi atom: | nitrogén |
| Valence elektronok a központi atom: | 5 |
| 3 H minden hozzájárulnak 1 elektron: | 3 |
| Összesen: | 8 |
|---|---|
| osztva 2 adni elektron párok | 4 |
| 4 elektron párok: | tetraéderes geometria a négy forma-meghatározó elektron párok |
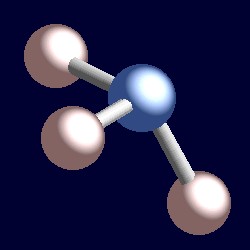
fontolja meg az elektronok kötési párját. A két elektron két mag között helyezkedik el, mindkettő vonzza. Egy magányos pár más. Ez szükségszerűen csak egy maghoz vonzódik, ennek következménye az, hogy hatékonyan közelebb áll az egyik maghoz, mint az elektronok kötési párjai. Ez azt jelenti, hogy egy magányos pár által elfoglalt hatékony szilárd szög nagyobb, mint egy kötéspár által elfoglalt szög., A magányos párok nagyobb szögletes teret igényelnek, és az atomjaikhoz közelebb helyezkednek el, mint a kötéspárok. A következménye ennek az ammónia, hogy a magányos pár helyet csinál magának, nyomja meg a három hidrogén atomok együtt egy kicsit, majd a H-N-H bond szögek valamivel kevesebb (106.6°), mint az ideális tetraéderes szög 109.5°.
















Vélemény, hozzászólás?