gondold át, mi történik félúton a színváltozáson keresztül. Ezen a ponton a sav és ion koncentrációja egyenlő. Ebben az esetben megszüntetik a kedves kifejezést.
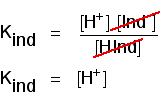
ezt felhasználhatja annak kiderítésére, hogy mi a pH ezen a félúton., Ha az utolsó egyenletet úgy rendezzük el, hogy a hidrogénion-koncentráció a bal oldalon legyen, majd pH-ra és pKind-re konvertáljuk, akkor a következőket kapjuk:
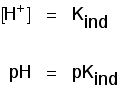
Ez azt jelenti, hogy a mutató végpontja teljes mértékben attól függ, hogy mi a pKind értéke. A mutatók megnéztünk felett, ezek a következők:
| mutató | pKind |
|---|---|
| lakmusz | 6.5 |
| metil-narancssárga | 3.7 |
| fenolftalein | 9.,3 |
a mutatók pH-tartománya
a mutatók nem változtatják meg élesen a színt egy adott pH-n (a pKind által megadott). Ehelyett a pH szűk tartományában változnak.
feltételezzük, hogy az egyensúly szilárdan az egyik oldalra van, de most hozzáad valamit, hogy elkezdje eltolni. Ahogy az egyensúly eltolódik, egyre több a második szín, és egy bizonyos ponton a szem elkezdi észlelni.
például tegyük fel, hogy lúgos oldatban metil-narancs volt, így a domináns szín sárga volt., Most kezdjen hozzá savat, hogy az egyensúly elmozduljon.
egy bizonyos ponton elegendő lesz a metil-narancs vörös formája, hogy az oldat narancssárga árnyalatot kezd. Ahogy megy hozzá több sav, a piros végül lesz olyan domináns, hogy nem magányos látni sárga.
van egy fokozatos sima változás egyik színről a másikra, zajlik egy sor pH. mint egy durva “ökölszabály”, a látható változás zajlik körülbelül 1 pH egység mindkét oldalán a pKind érték.,
A pontos értékek a három mutató megnéztünk vagy:
| mutató | pKind | pH tartomány |
|---|---|---|
| lakmusz | 6.5 | 5 – 8 |
| metil-narancssárga | 3.7 | 3.1 – 4.4 |
| fenolftalein | 9.3 | 8.3 – 10.0 |
A lakmusz színe változás történik, több, mint egy szokatlanul széles, de hasznos kimutatására savak, lúgok, a laborban, mert ez megváltoztatja a színét körül pH-ja 7., A metil-narancs vagy a fenolftalein kevésbé hasznos lenne.
Ez könnyebben látható vázlatosan.
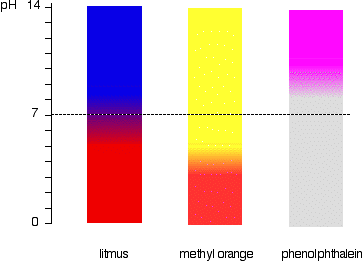
például a metil-narancs sárga lenne minden olyan oldatban, amelynek pH-értéke nagyobb, mint 4, 4. Nem tudott különbséget tenni egy gyenge sav, amelynek pH-ja 5 vagy egy erős alkáli, amelynek pH-ja 14.
titrálási mutatók kiválasztása
ne feledje, hogy a titrálás egyenértékűségi pontja az, ahol a két anyagot pontosan egyenlet arányokban keverte össze., Nyilvánvalóan ki kell választania egy olyan mutatót, amely a színt a lehető legközelebb változtatja az ekvivalencia ponthoz. Ez a titrálástól a titrálásig változik.
erős sav v erős bázis
a következő ábra a pH görbét mutatja erős sav erős bázishoz való hozzáadásához. Ezen felül a metil-narancs és a fenolftalein pH-tartományai vannak.
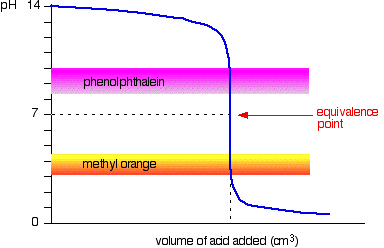
látható, hogy egyik mutató sem változtatja meg a színt az egyenértékűségi ponton.,
a grafikon azonban olyan meredek ezen a ponton, hogy gyakorlatilag nem lesz különbség a hozzáadott sav térfogatában, attól függően, hogy melyik mutatót választja. Ugyanakkor érdemes lenne a lehető legjobb színre titrálni az egyes mutatókkal.
ha fenolftaleint használ, akkor titrálja, amíg csak színtelenné nem válik (pH 8, 3), mert ez olyan közel van, amennyire az egyenértékűségi ponthoz juthat.
másrészről, metil-narancs használatával titrálná, amíg az oldatban meg nem jelenik a narancs első nyoma., Ha a megoldás piros lesz, akkor az egyenértékűségi ponttól távolabb kerül.
erős sav v gyenge bázis
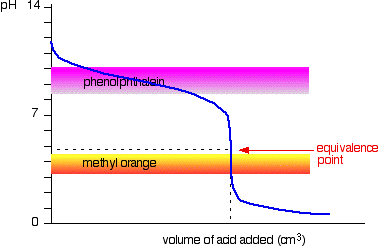
Ez alkalommal nyilvánvaló, hogy a fenolftalein lenne teljesen haszontalan. A metil-narancs azonban sárgáról narancsra változik, nagyon közel az egyenértékűségi ponthoz.
ki kell választania egy mutatót, amely megváltoztatja a színt a görbe meredek részén.
gyenge sav v erős bázis
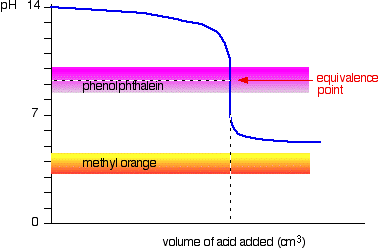
ezúttal a metil-narancs reménytelen!, A fenolftalein azonban pontosan ott változtatja meg a színét, ahol szeretné.
gyenge sav v gyenge bázis
a görbe olyan esetre vonatkozik, amikor a sav és a bázis egyaránt gyenge – például etánsav és ammónia oldat. Más esetekben az egyenértékűségi pont más pH.
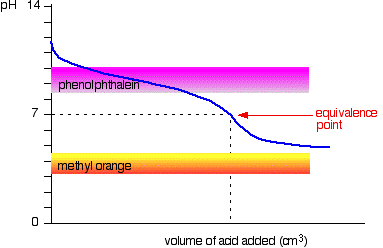
látható, hogy egyik mutató sem használható. A fenolftalein jóval az egyenértékűségi pont előtt fejeződik be, a metil-Narancs pedig teljesen leesik a grafikonról.,
lehet, hogy talál egy olyan mutatót,amely az egyenértékűségi ponton megváltozik vagy befejeződik, de mivel az egyenértékűségi pont pH-ja eltér az esettől az esettől, nem általánosítható.
összességében soha nem titrálna gyenge savat és gyenge bázist indikátor jelenlétében.
nátrium-karbonát oldat és hígított sósav
Ez egy érdekes különleges eset., Ha fenolftaleint vagy metil – narancsot használ, mindkettő érvényes titrálási eredményt ad-de a fenolftalein értéke pontosan a metil-narancs fele lesz.
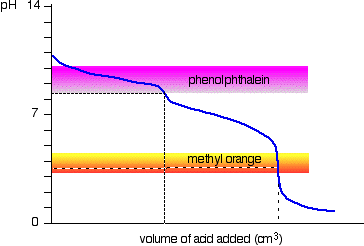
előfordul, hogy a fenolftalein színváltozását pontosan azon reakció első felének pH-értékén fejezte be, amelyben nátrium-hidrogén-karbonátot állítanak elő.
![]()
![]()
a metil-narancs színe pontosan a reakció második szakaszának egyenértékűségi pontjának pH-értékén változik.,
![]()
![]()
a megértés tesztelésére vonatkozó kérdések
Ha ez az első kérdéssor, amit tett, kérjük, olvassa el a bevezető oldalt, mielőtt elkezdené. A böngésző Vissza gombját kell használnia, hogy utána visszatérjen ide.
indikátorokkal kapcsolatos kérdések
válaszok
hová szeretne most menni?
a sav-bázis egyensúly menüben . . .
a fizikai kémia menübe . . .
a főmenübe . . .,
















Vélemény, hozzászólás?