kezelése anyai alloimmunization
általános szabály, hogy Soros anyai antitest titerek ellenőrzik, amíg a kritikus titer 1:32, ami azt jelzi, hogy a magas kockázata a magzati hydrops elérték. Ezen a ponton a magzat nagyon intenzív megfigyelést igényel a vérszegénység és a magzati hidrops jeleire., A Kell alloimmunizációban az alacsony anyai titereknél hidrops fordulhat elő az elnyomott eritropoezis miatt, ezért 1:8 titert javasoltak kritikusnak. Ezért a delta-OD 450 értékek szintén megbízhatatlanok a betegség súlyosságának előrejelzésében a Kell alloimmunizációban.
az anyai titerek nem hasznosak a magzati anaemia kialakulásának előrejelzésében az első érintett terhesség után. A titerekben nagy különbségek mutatkoznak ugyanabban a betegben a különböző laboratóriumok között, és egy újabb gél technika magasabb titereredményeket eredményez, mint a régebbi tubus módszer., Ezért a kritikus titer meghatározására standard cső módszertant kell alkalmazni, és az 1-nél nagyobb hígítás változása az anyai antitest titer tényleges növekedését jelenti. Az újszülött hemolitikus betegségéért (HDN) felelős összes antitest esetében az antitest titer 4-szeres növekedését általában jelentős változásnak tekintik, amely magzati értékelést igényel.
ha szükséges, az amniocentesis már 15 hetes vemhességben is elvégezhető (ritkán szükséges az első érintett terhességben a 24 hetes vemhesség előtt) a magzati genotípus meghatározásához és a súlyosság felméréséhez., Az anyai és apai vérmintákat amniotikus folyadékmintával kell elküldeni a referencialaboratóriumnak, hogy kiküszöböljék a hamis pozitív eredményeket (az anyai pszeudogénből vagy a CCD génből) és a hamis negatív eredményeket (az apai RHD gén locus átrendeződéséből).
a magzati Rh-genotípus meghatározása az anyai plazmában számos európai országban rutinszerűvé vált, és az Egyesült Államokban kínálják., A magzati sejtmentes DNS a teljes keringő anyai plazma DNS 3% – át teszi ki, már a terhesség 38 napján megtalálható, és a placenta citotrofoblaszt réteg apoptózisából származik. A keringő magzati DNS átlagos felezési ideje átlagosan kevesebb, mint 30 perc, az anyai plazmát szűrésnek és mikrocentrifikációnak vetik alá, hogy minden sejtelemet eltávolítsanak a vizsgálat előtt. Ez kiküszöböli a hamis pozitív eredményeket az anyai limfoid szervekben a korábbi terhességek metszett magzati sejtjeiből.,
a sejtmentes magzati DNS-t valós idejű polimeráz láncreakciónak (PCR) vetik alá RHD génspecifikus szekvenciák jelenlétében, és az esetek 99,5%–ában pontosnak bizonyultak. A SRY gént (a hím magzatban) és a DNS polimorfizmust az általános populációban (a női magzatban) belső kontrollként használják a sejtmentes DNS magzati eredetének megerősítésére. Egy 92 egy nukleotid polimorfizmusból (SNPs) álló panelt hasonlítanak össze a buffy coat és a plazma anyai mintái között., A 6 SNP-nél nagyobb különbség megerősíti a magzati DNS jelenlétét és a vizsgálat érvényességét egy női magzatban. A hamis negatív eredmények a leginkább nem kívánatosak, következésképpen a részleges vagy gyenge d-fenotípusok okozzák. Ezeket legalább két RHD-specifikus exon primer segítségével észlelik, és duplikátumokban futnak.
szerencsére a sejtmentes magzati DNS-vizsgálat a genotípus meghatározására más vörösvérsejt-antigének,például a c, C, e, E és Kell esetében is rendkívül megbízhatónak és pontosnak bizonyult.,
a Soros amniocentesis 10-14 napos időközönként kezdődik, hogy figyelemmel kísérje a betegség súlyosságát a magzatban. Minden kísérletet meg kell tenni a tű transzplacentális áthaladásának elkerülésére, amely fetomaternális vérzéshez (FMH) és az antitest titer további emelkedéséhez vezethet. Soros delta-OD 450 értékeket ábrázoljuk a Queenan chart vagy a kiterjesztett Liley chart, hogy értékelje a magzati hidrops. Korai ultrahangvizsgálatot végeznek a helyes terhességi kor megállapítására., Gyakori ultrahangos monitorozás is végzik, hogy értékelje a magzati jólét és kimutatására mérsékelt vérszegénység, valamint a korai jelei hydrops.
a csúcs szisztolés középső agyi artéria (MCA) Doppler sebessége megbízható szűrőeszköznek bizonyult a magzati vérszegénység kimutatására, és felváltotta az amniocentézist. Az MCA könnyen láthatóvá színáramú Doppler; pulzáló Doppler ezután mérésére használják a csúcs szisztolés sebesség csak disztális annak bifurkáció a belső nyaki artéria., Mivel az MCA sebessége növekszik a terhességi kor előrehaladtával, az eredményt a medián (anyák) többszörösében jelentik. A közelmúltban végzett vizsgálatok kimutatták, hogy a mérsékelt vagy súlyos magzati anémia kimutatásának érzékenysége 100%, hamis pozitív aránya 10% 1,5 MOM. Kimutatták, hogy több mint 70% – kal csökkenti az invazív diagnosztikai eljárások, például az amniocentesis és a cordocentesis szükségességét.
az MCA Doppler-vizsgálatok már 18 hetes vemhesség után elkezdhetők, de 35 hetes vemhesség után nem megbízhatóak., Arra is használták, hogy időben a későbbi magzati transzfúzió és diagnosztizálni vérszegénység több okból, mint például a twin-twin transzfúzió. Az MCA lejtését a 3 heti leolvasásokból most a súlyos vérszegénység magzati kockázatának előrejelzésére használják (lásd az alábbi képet).
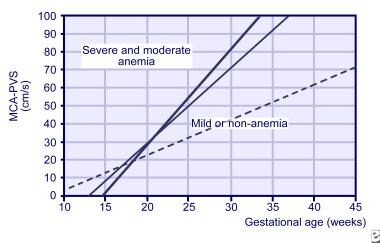 lejtők a szisztolés csúcssebességhez a középső agyi artériában (MCA) a normál magzatoknál (pontozott vonal), enyhén vérszegény magzatok (vékony vonal), valamint súlyosan vérszegény magzatok (vastag vonal).,
lejtők a szisztolés csúcssebességhez a középső agyi artériában (MCA) a normál magzatoknál (pontozott vonal), enyhén vérszegény magzatok (vékony vonal), valamint súlyosan vérszegény magzatok (vastag vonal)., az MCA Doppler-vizsgálat elvégzésével szerzett tapasztalatok megszerzésével a magzati anémia kimutatására szolgáló soros amniocentesist kisebb mértékben alkalmazták.
abban az időszakban, amikor az intrauterin peritoneális transzfúzió volt a kezelés egyetlen eszköze, az újszülötteket rutinszerűen szállították 32 hetes terhesség alatt. Ez a megközelítés a hialinmembrán-betegség és a transzfúzió magas előfordulását eredményezte., A méhen belüli intravaszkuláris transzfúzió (IVT) megjelenésével a súlyosan érintett magzat általános megközelítése az IVT szükség szerinti végrehajtása 35 hetes vemhességig, a szülés tervezett időtartamával. A létesítmény a tüdő lejárati nehéz ezekben a magzatok, mert a szennyezés a magzatvíz, a maradék vér transzfúzió során; ha azonban a szállítás tervezett előtt 34 hetes terhesség, anyai szteroid alkalmazása fokozza a magzati tüdő lejárati jelzi.,
ezen kívül, a felesleges magzatvíz bilirubin szint, mert hamis magasság a fluoreszcencia depolarization TDx magzati tüdő érettségi vizsgálat, verzió II. (TDX-FLMII); ezért, egyéb vizsgálatok, hogy meghatározza a magzati tüdő lejárati kell használni, például infravörös spektroszkópia, lamellás test számít, phosphatidylglycerol mennyiségi meghatározására vagy a lecitin/sphingomyelin (L/S) aránya.
Liley először 1963-ban írta le az intraperitoneális transzfúziót (IPT). Egy Tuohy tűt vezetünk be a magzati peritoneális üregbe ultrahangos útmutatás alapján., Epidurális katétert vezetünk át a tűn. A magzati peritoneumba radiopaque közeget fecskendeznek be. A megfelelő elhelyezést a bélrendszeren vagy a membrán alatt vagy a magzati ascites diffúziójával megerősítik.,ss mint 4 napos, csoport, O, Rh-negatív, Kell-negatív, leukoreduced, kiégett 25 Gy, hogy megakadályozzák a graft-versus-host betegség, kereszt illeszkedik az anyai szérum fecskendeznek be a 10 mL-es aliquot, hogy a kötet a következő képlettel kell kiszámítani:
IPT kötet = (gesztációs hét – 20) × 10 mL
a Maradék hemoglobin (Hb) a magzat becsült, hogy lehetővé tegye a megfelelő távolság IPT kiválasztása a terhesség, a szállítás, a következő képlettel:
Hb g/dL = 0.,85/125 × a/b × 120 – c/120
a képletben az a donor RBC HB transzfundált mennyisége, b a magzati test becsült súlya, és c a transzfúzió idejétől a donor Hb becsléséig eltelt napok közötti intervallum.
az IPT megismétlődik, amikor a magzati Hb becslések szerint 10 g/dL-re csökkent. Általában egy második IPT-t az első transzfúzió után 10 nappal hajtanak végre annak érdekében, hogy a Hb 10 g/dL fölé emelkedjen. Ezután 4 hetente újabb transzfúziót hajtanak végre a tervezett szállítás időpontjáig 34-35 hetes terhesség alatt., A magzati diafragmatikus mozgások szükségesek az RBC felszívódásához. Ez a megközelítés nem jelent értéket a moribund nem lélegző magzat számára. Az anyai szövődmények közé tartozik a fertőzés és a transzplacentális vérzés, míg a magzati szövődmények a túltranszfúzió, a kivérzés, a szívtamponád, a fertőzés, a koraszülés és a graft versus host betegség. Az IPT után a túlélési arány körülbelül 75% – ot közelített meg ultrahangvizsgálat segítségével.,
a közvetlen IVT a magzati beavatkozás előnyös módjává vált, mivel a hidropikus magzatban az IPT magasabb szövődményei és korlátozott hatékonysága miatt. Rodeck először 1981-ben sikeresen elvégezte az IVT-t. Ultrahangvizsgálattal egy 20-22 g-os tűt vezetünk be a köldökzsinór vénájába a placentába vagy annak intrahepatikus részébe behelyezett köldökzsinórnál, és magzati vérmintát kapunk. A vérmintát a gyors lúgos denaturációs teszt igazolja, hogy magzati eredetű., Minden releváns magzati vizsgálatot (pl. vércsoport, közvetlen antitest teszt, retikulocitaszám, vérlemezkeszám, Hb szint, Hct szint, szérum albuminszint, eritropoetin szint) végeznek. Ha a Hb szint kevesebb, mint 11 g/dL, vagy ha a Hct szint kevesebb, mint 30%, IVT indul. A tű helyzetét megerősíti, hogy megemlíti a magzati edényben a turbulenciát sóoldat befecskendezésével. A magzatot gyakran pancuroniummal bénítják meg, és fentanilt adnak 10 mcg/kg-ra, hogy megakadályozzák a tű magzati mozgásokkal történő elmozdulását., Az anyai gyógyszeres kezelés a helyi érzéstelenítőtől a rutin indometacinig és a tudatos szedációig, a spinális epidurális fájdalomcsillapításig változik.
a transzfúziót 10 mL-es aliquotokban végezzük, körülbelül 50 mL/ttkg becsült testtömegre ultrahangvizsgálat alkalmazásával vagy a 40% – os Hct szint eléréséig. Az eljárás azonnal megszűnik, ha szív dekompenzációt észlelnek az ultrahangvizsgálat során., A súlyosan vérszegény magzatok nem tolerálják Hct-jük akut korrekcióját a normál értékekre, és a kezdeti Hct-t nem szabad több mint 4-szeresére növelni az első IVT idején. Ezután 2-7 naponta ellenőrizni kell őket. Az IVT megismétlődik, amikor eléri a kritikus vérszegénységet tükröző értéket a magzatban. A transzfúziós sejtek napi 1% – ának elvesztése várható.
egyes központok ismételt transzfúziót végeznek 10 napos, 2 hetes és 3 hetes időközönként. Mások transzfúzió alapján várható csökkenése magzati hemoglobin 0,4 g / dL / nap, 0,3 g / dL / nap, 0.,2 g / dL / nap az első, a második és a harmadik transzfúziós intervallumokban. A szisztolés MCA csúcssebességét a második transzfúzió időzítésére használták, 1, 32 MOM küszöbértékkel. Miután az első intrauterin transzfúzió, a jelenlétét a vörös vérsejtek felnőtt hemoglobin elnyomja erythropoesis, valamint javítja az oxigén szállítást, amely felelős a szegény összefüggés csúcs MCA sebessége, illetve súlyos magzati vérszegénység. Egyes központok a kombinált IVT és IPT transzfúzió kedvező hatását találták a transzfúzió megismétlésére.,
az IPT szövődményei mellett átmeneti magzati bradycardiát, köldökzsinór hematómát, köldökvénás kompressziót és magzati halált jelentettek az IVT során. Az IVT-nek azonban számos előnye van, többek között az anémia azonnali korrekciója és a magzati hidropok felbontása, a hemolízis csökkent aránya és az azt követő hiperinzulinémia, valamint a magzati növekedés gyorsulása a nem hidropikus magzatok számára, akik gyakran növekedési retardáltak. Az IVT az egyetlen beavatkozás a moribund hidropikus magzatok és az elülső placentával rendelkezők számára. A magzati veszteség kockázata körülbelül 0, 8% az IVT-vel szemben a 3-mal szemben.,Az IPT eljárásonként 5%, a teljes túlélési arány pedig 88%.
Nemrég mosott anyai Vvt sikeresen használják forrásként antigén-negatív Vvt abban az esetben, ha a ritka összeférhetetlenség, de már rutinszerűen használják, mert a juttatások, mint például csökkent a kockázata a túlérzékenységet, hogy új vörösvértest-antigének, hosszabb keringő felezési ideje, hogy friss, csökkent átvitelének kockázata vírusos ügynökök. Az anya az első trimeszter után adományozhat egy egység vörösvértestet.,
pulmonalis éretlenség és delta-OD 450 esetén a Queenan-görbe érintett zónájában 30 mg fenobarbitál szájon át történő beadása az anyának naponta 3-szor, majd egy héten belüli indukció, csökkenti az érintett újszülöttben a cseretranszfúzió szükségességét. Kiváló algoritmusok kezelésére az első érintett terhesség, valamint a terhesség egy anya korábban érintett magzat vázolt felülvizsgálat Moise (lásd az alábbi képeket).
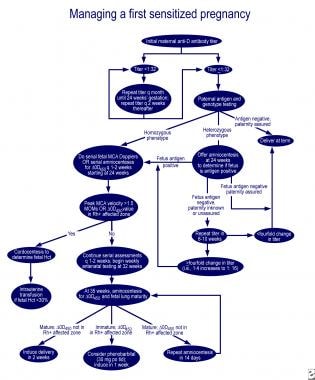 az első érintett terhesség kezelése.,
az első érintett terhesség kezelése., 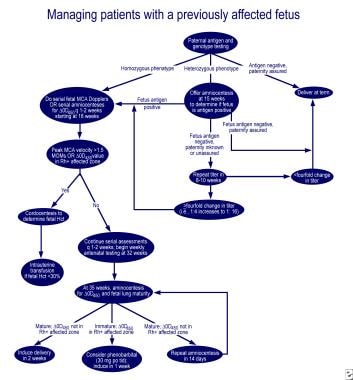 korábban érintett magzattal rendelkező terhes nők kezelése.
korábban érintett magzattal rendelkező terhes nők kezelése. az Rh hapten, Rh-pozitív RBC stroma és prometazin alkalmazása során az Rh antitest-termelés elnyomására irányuló kezdeti kísérletek sikertelenek voltak. A kiterjedt plazmaferezis 5% albumin (terápiás plazmacsere) és intravénás immunglobulin (IVIG) alkalmazásával, vagy az IVIG hetente 1 g/ttkg adagolása mérsékelten hatékonynak bizonyult., Úgy tűnik, hogy a hatásmechanizmus az Fc receptorok elzáródása a placentában, csökkenti az antitest transzportot a magzatra, az Fc receptorokat a fagocitákon a magzati retikuloendotheliális rendszerben,valamint az anyai antitest szintézis visszacsatolását. Mindazonáltal antitestfüggő sejt-mediált citotoxicitást és az antitest-koncentráció rebound-emelkedését, a placenta véráramlásának megváltozását az eljárás során, valamint a szülés utáni vérzést figyeltek meg a plazmacsere után.,
Egy újabb retrospektív tanulmány, amely 5 várandós nők, akiknek súlyos HDFN miatt RBC alloimmunization számolt be sikeres kezelés a kombinált kezelés terápiás plazma csere, IVIG, valamint intrauterin transzfúzió (IUT) korai a terhesség. A nők vetették alá, 3 plazma exchange eljárások során hét 10-13, a terhesség, a következő által heti IVIG infúziók; a magzatok kapott RBC egységek, amelyek teljes mértékben illeszkedik az anyai fenotípus, hogy a D, C, E, K, Fy, Jk, S antigén csoportok. Minden nő egészséges csecsemőket szállított 33-38 hetes terhesség alatt.,
ezek a technikák azonban csak 20-22 hetes vemhességig halasztják el a perkután köldökvér mintavétel (Pub) és IVT szükségességét, amikor ezek az eljárások elfogadhatóbb kockázattal végezhetők. Az IVIG alkalmazásának áttekintése megmutatja annak hasznosságát a magzati hidrops kialakulásának megelőzésében, valamint az IUT szükségességének késleltetésében., Így a kombinált megközelítés a plazmaferezis hogy indul a 12 hetes vemhesség 3 alkalommal, hogy a héten, majd IVIG a telítő adag 2 g/kg után a harmadik plazmaferezis, majd folytatta IVIG 1 g/kg/hét, amíg a 20 hetes terhesség már javasolta, hogy a veszélyeztetett terhességek előtt 20 hetes terhesség is használható, később, a terhesség, ha a szakmai alapképzés nem lehet elvégezni, vagy ha hydrops nem reagál, hogy a szakmai alapképzés.,
egy jelentés azt mutatta, hogy a súlyos alloimmunizációval rendelkező magzatok IVT-vel történő kezelése a magzati IVIG terápiával kombinálva 1 g / kg / dózissal a harmadik IVT-től kezdve segített csökkenteni az IVT gyakoriságát és javítani a hidropok jeleit. Egy esettanulmány azt mutatja, sikeres kezelés a súlyos vérszegénység és hydrops a magzat alloimmunizáció miatt anti-m antitest magzati intraperitoneális IVIG injekciók 2 g / kg adott heti Kezdő 30 hét. Ez azonban eseti jelentés volt, és randomizált, kontrollált vizsgálatra van szükség, mielőtt ez az ellátás színvonalává válhat.,
hasonló vizsgálati sémákat és kezelést alkalmaznak a nem RHD alloimmunizáció által érintett terhességek kezelésére, mint például az anti-Rhc, az anti-K (K1) és az anti-M. Miután az anyát hemolitikus betegséggel összefüggő antitesttel diagnosztizálták, közvetett Coombs titert végeznek, az érintett antigén és zygositás apai tesztelésével együtt. Az anyai titereket addig ismételjük (havonta 28 hetes vemhességig, majd 2 wk-ig), amíg el nem éri a magzati anémia küszöbét (Kell esetében 1:8, pihenés esetén 1:32).,
a magzati antigén tipizálását amniocentézis vagy sejtmentes magzati DNS útján végezzük az anyai plazmában, ha az apa heterozigóta (100% K1 esetén, 65% m esetén). Ha a magzat ismert antigén pozitív, megfigyelés súlyos magzati vérszegénység végzett, a heti MCA Doppler szűrés olyan korán, mint 16-18 hét IUT végzik, ha az meghaladja a 1.5 ANYA a szállítás 38 hetes terhesség.
az anyai alloantitestek az apai leukocitákhoz Fc blokádot és a magzati hemolitikus anémia súlyosságának csökkentését eredményezték., Ezt fel lehet használni a jövőben.
a szenzibilizált újszülött kezelése
az enyhe hemolitikus betegség az újszülöttek 50% – át teszi ki, pozitív közvetlen antitest vizsgálati eredményekkel. Ezen újszülöttek többsége nem vérszegény (cord hemoglobin >14 g/dL), és minimális hemolízissel rendelkezik (cord bilirubin < 4 mg/dL). A korai fototerápián kívül nem igényelnek transzfúziót. Azonban ezek az újszülöttek veszélyeztetik a súlyos késői vérszegénység kialakulását 3-6 hétig. Ezért fontos a Hb szintjének ellenőrzése a kórházi kibocsátás után.,
a mérsékelt hemolitikus betegség az érintett újszülöttek körülbelül 25% – át teszi ki. Az újszülött mérsékelt hemolitikus betegségét mérsékelt vérszegénység és fokozott köldökzsinór bilirubinszint jellemzi. Ezek a csecsemők nem klinikailag sárgulnak születéskor, de gyorsan alakulnak ki nem konjugált hiperbilirubinémia az élet első 24 órájában. A perifériás kenet számos nukleált RBC-t, csökkent vérlemezkéket, esetenként nagyszámú éretlen granulocitát mutat., Ezeknek az újszülötteknek gyakran hepatosplenomegalia van, és megfelelő kezelés nélkül fennáll a bilirubin encephalopathia kialakulásának veszélye. Korai csere transzfúzió az O típusú Rh-negatív friss RBC-kkel, intenzív fototerápiával általában szükséges. Az IVIG alkalmazása 0,5-1 g/ttkg dózisban egyszeri vagy többszöri adagban hatékonyan csökkentette a transzfúzió szükségességét.,
egy prospektív, randomizált, kontrollos vizsgálat korai, 12 órás IVIG 1 g/ttkg adagolást mutatott a fototerápia és a kórházi tartózkodás időtartamának csökkentése, valamint a közepesen súlyos vagy súlyos Rh izoimmunizációval rendelkező újszülötteknél a transzfúzió megelőzése érdekében. Ezek az újszülöttek is veszélyeztetik a késői hyporegeneratív anémia kialakulását a csecsemőkorban 4-6 hetes korban. Egy randomizált, kettős-vak, placebo-kontrollos vizsgálat azonban nem mutatta ki a profilaktikus IVIG-kezelés 0 előnyeit.,75 g/kg 4 órán belül súlyosan érintett újszülötteknél, akiket Rh izoimmunizáció céljából intrauterin transzfúzióval kezeltek.
a súlyos hemolitikus betegség az alloimmunizált újszülöttek fennmaradó 25% – át teszi ki, akik születéskor halva vagy hidropikusak. A magzati hydrops elsősorban az okozta, egy kapilláris szivárgás szindróma miatt szöveti hypoxia, hypoalbuminemia másodlagos májműködési zavar, magas-szívgyengeséget a vérszegénység., Ezeknek a magzatoknak körülbelül a fele hidropikussá válik a 34 hetes vemhesség előtt, és intenzív monitorozásra és az alloimmunizált vemhesség kezelésére van szükség, amint azt korábban leírtuk. Enyhe hydrops érintő ascites megfordítja a IVTs csak 88% – ában a jobb túlélési de súlyos hydrops okoz fejbőr ödéma súlyos ascites, valamint pleurális folyadékgyülem fordított 39% – ban esetben társul a szegény túlélés.
ABO-összeférhetetlenség kezelése
a hyperbilirubinaemia kezelése az ABO-összeférhetetlenséggel küzdő újszülötteknél jelentős aggodalomra ad okot., A transzfúzió és a fototerápia cseréjének kritériumai hasonlóak az Rh alloimmunizációban alkalmazott kritériumokhoz. Az IVIG nagyon hatásos volt a kezelés korai szakaszában is. Ón (Sn) porfirin egy erős gátló hem oxygenase, az enzim, amely katalizálja a sebesség-korlátozó lépés a termelés, a bilirubin a hem, kimutatták, hogy csökkentik a termelést, a bilirubin csökkenteni kell a vércsere, valamint időtartama a fényterápia az újszülöttek, az ABO összeférhetetlenség.
ón-vagy cink-protoporfirint vagy mezoporfirineket újszülötteknél vizsgálták., Intramuscularisan kell beadni őket testtömeg alapján, és hatásosságuk minden terhesség esetén dózisfüggő. Lehetséges toxikus hatásaik közé tartozik a bőr fényérzékenysége, a vashiány, valamint a szén-monoxid-termelés lehetséges gátlása. Az újszülött Rh hemolitikus betegségében történő alkalmazásáról nem számoltak be. Rutinszerű használatuk még nem ajánlott a hosszú távú biztonsági adatok hiánya miatt.
















Vélemény, hozzászólás?