Bevezetés
replikáció az eukarióta sejtek magjában három DNS-polimerázt alkalmaz: α, δ És ε (Hubscher et al., 2002; Pavlov et al., 2006b; Kunkel and Burgers, 2008; Loeb and Monnat, 2008; Burgers, 2009; Pavlov and Shcherbakova, 2010; Lange et al., 2011)., A DNS-szintézis irányított, és 5′ – ről 3′ – ra folytatódik, ahol egy nukleotid α-foszfátjára egy primer 3 ‘ OH-jával történő nukleofil támadás nukleozid-monofoszfát beépülését és pirofoszfát felszabadulását eredményezi (Steitz, 1999). Minden DNS-polimerázhoz primer és szabad 3 ‘ OH szükséges a DNS-szintézis elvégzéséhez, és a pol α sem kivétel. A Pol α egy heterotetramer, amely két primáz alegységből és két polimeráz alegységből áll., A primáz alegységek a DNS-replikációt rövid (7-12 ribonukleotid) RNS-primerek szintetizálásával indítják el, amelyeket ezután α polimeráz meghosszabbít (Pellegrini, 2012). A δ És ε DNS-polimeráz a pol α által generált primereket pontosan és processzív módon meghosszabbítja (Kunkel, 2004, 2011; Pellegrini, 2012). Élesztőben kimutatták, hogy a δ DNS-polimeráz elengedhetetlen a lemaradó szál DNS-szintéziséhez, míg a Pol ε elsősorban a vezető szálon működik (Pursell et al., 2007; Nick Mcelhinny et al., 2008; Kunkel, 2011; Georgescu et al., 2014)., Ezzel szemben a mitokondriumokban a replikáció az egyetlen polimeráz, a γ DNS-polimeráz (Lee et al., 2009).
A DNS-polimerázok hét családba vannak csoportosítva (a, B, C, D, X, Y és RT). Az eukariótákban a három nukleáris replikatív DNS-polimeráz történetesen a B családhoz tartozik (Burgers et al., 2001; Patel and Loeb, 2001). Jelenleg az élesztőből származó mindhárom replikatív DNS-polimeráz kristályszerkezete létezik, amelyek először teszik lehetővé közös szerkezeti elemeik összehasonlítását, valamint egyedi tulajdonságaik vizsgálatát (Swan et al., 2009; Perera et al.,, 2013; Hogg et al., 2014; Jain et al., 2014a). Mindhárom replikatív DNS-polimeráz több alegységi enzim (1. táblázat) (Johansson and Macneill, 2010; Pavlov and Shcherbakova, 2010; Makarova et al., 2014). A felülvizsgálat középpontjában a katalitikus tartomány vagy az A.
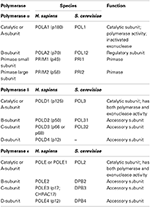
1. táblázat áll. Az eukarióta DNS-polimerázok több alegység enzimek.,
Általános Szerkezete B Család Polimeráz
az Összes DNS-polimeráz közös polimeráz-szeres, ami ahhoz képest, hogy egy emberi jobb kezét, amely három aldomain: ujjal, tenyérrel, s hüvelykujját (Steitz, 1999; Patel, illetve Loeb, 2001). A tenyér, egy erősen konzervált fold, amely négy antiparallel β szálból és két spirálból áll, két szigorúan konzervált katalitikus aszpartátot tartalmaz, amelyek a motívum a, DXXLYPS és motívum C, DTDS (Delarue et al., 1990; Braithwaite és Ito, 1993)., Ezt az RRM – szerű hajtást az enzimek nagyon nagy csoportja osztja meg, beleértve a DNS – és RNS-polimerázokat, a reverz transzkriptázokat, a KRISPR polimerázokat, sőt a reverz (3′ -5′) transzferázokat, például a Thg1-et (Anantharaman et al., 2010; Hyde et al., 2010). Ezzel szemben a hüvelykujj és az ujjak aldomainjei lényegesen nagyobb szerkezeti sokszínűséget mutatnak (Steitz, 1999). Az ujjak konformációs változáson mennek keresztül a kötő DNS és a megfelelő bejövő nukleotid hatására. Ez a mozgás lehetővé teszi, hogy az ujjak aldomain maradékai érintkezzenek a születő bázispár nukleotidjával., A hüvelykujj tartja a DNS duplexet a replikáció során, és szerepet játszik a processivitásban (Doublié and Ellenberger, 1998; Doublié et al., 1999).
eukarióta DNS polimeráz α, δ És ε sok archaeális, bakteriális, bakteriofág és virális polimeráz (Delarue et al., 1990; Braithwaite and Ito, 1993; Franklin et al., 2001; Firbank et al., 2008; Wang and Yang, 2009)., Koonin közreműködők hozzájárult ahhoz, részletes filogenetikai elemzése archaeal DNS-polimeráz a kapcsolatot eukarióta polimeráz ebben a kérdésben a Határok mellett elkötelezett polimeráz Makarova et al. (2014).
B család polimeráz tagjai öt aldomain: az ujj, hüvelykujj, majd a palm (fent leírt) alkotja a magot, az enzim, valamint egy exonuclease domain egy N-terminális domén (NTD) (Franklin et al., 2001; Xia és Konigsberg, 2014) (1.ábra; S1 táblázat)., Az exonukleáz domén 3′-5′ lektorálási aktivitást hordoz, amely eltávolítja a nem megfelelő nukleotidokat. Az exonukleáz aktív hely 40-45 Å távolságra található a polimeráz aktív helyétől. Úgy tűnik, hogy az NTD nem rendelkezik katalitikus aktivitással. Pol δ-ban az NTD három motívumot tartalmaz: az egyik topológiája OB-hajtásra hasonlít, egyszálú DNS-kötési motívum, a másik RNS-kötési motívumot (RNS-felismerési motívum vagy RRM) (Swan et al., 2009). A T4 bakteriofágban az NTD mutációi csökkentik a polimeráz expresszióját (Hughes et al., 1987)., Az RB69-ben és a T4-ben a gp43 polimeráz megköti saját hírvivő RNS-ét, feltehetően az NTD-n keresztül, és elnyomja a fordítást (Petrov et al., 2002), ami nem tűnik pol δ (Swan et al., 2009). Az új adatok azt mutatják, hogy az NTD más doménekkel (Li et al., 2010; Prindle et al., 2013) (lásd alább).
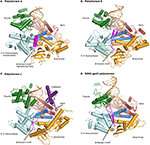
1.ábra. Az α, δ, ε és rb69 gp43 polimerázok háromkomponensű komplexeit azonos orientációkból szemléltetjük összehasonlítás céljából., A hüvelykujj (zöld) és az ujjak (Sötétkék) tartományok megragadják a duplex nukleinsavat (bézs színű alapozó, narancssárga sablon) a tenyértartomány ellen (piros). Az N-terminális domain aranyban jelenik meg, a 3′-5′ exonukleáz domén (Cián) mellett. A) polimeráz α (PDBID 4FYD) kötődik egy RNS/DNS hibridhez, ahol az A-alakú DNS széles, sekély, kisebb hornya látható a hüvelykujj közelében. A 3′ -5 ‘ exonukleáz doménnek nincs aktivitása. A spirális régió (magenta) az inaktivált exonukleáz doménben stabilizálja a sablon 5 ‘ végét., B) A δ polimeráz (PDBID 3IAY) egy nagy β hajtű motívumot (magenta) tartalmaz, amely fontos a primer szálnak a polimeráz aktív helyéről az exonukleáz aktív helyére történő átkapcsolásában lektorálás esetén. (C) az ε polimeráz (PDBID 4M8O) egyedülálló P-doménnel (lila) rendelkezik, amely a polimerázt megnövelt processivitással ruházza fel. Érdekes módon a β hajtű motívum pol ε-ban atrófizálódik., (D) A B DNS-polimeráz-hajtás és a doménszervezet védelme nyilvánvaló, amikor az rb69 gp43 (PDBID 2ozs) bakteriofágból származó modellenzimet a három eukarióta replikatív polimerázzal együtt vizsgáljuk. Az egyes polimerázokra vonatkozó tartományhatárolást az S1 táblázat tartalmazza. Ábra készült PyMOL (a PyMOL molekuláris grafikus rendszer, verzió 1.5.0.4 Schrödinger, LLC.).
minden emlős B család DNS-polimerázról ismert, hogy két ciszteinben gazdag fémkötőhelyet (CISA és CysB) tartalmaz C-terminális doménjükben (CTD) (2.ábra)., A CysA feltételezhetően cink-kötő hely, míg a CysB egy vaskén klaszter (Netz et al., 2012). A klaszter elvesztése a Pol δ élesztő CTD-ben negatívan befolyásolja a B-alegységgel való kölcsönhatásokat (Sanchez Garcia et al., 2004). A cink-kötési motívum fontosnak bizonyult a Pol δ kölcsönhatásában a processivitási tényezőjével, a PCNA-val (Netz et al., 2012).

2.ábra. A három Saccharomyces cerevisiae replikatív DNS polimeráz α, δ És ε vázlatos rajza., Az RB69 bakteriofágból származó DNS-polimeráz összehasonlításra kerül.
DNS-polimeráz α
a DNS-polimeráz α katalitikus alegysége 1468 aminosavból áll (2.táblázat). A kristályosításra tervezett fehérjeszerkezetet az N – és C-terminiben (349-1258 maradványok) csonkolták, ezért hiányzik a CTD és annak klasztere (2.ábra). A konstrukciót egy bináris komplexben, egy DNS/RNS hibrid oligonukleotiddal kristályosítottuk, és egy DNS/RNS és bejövő nukleotid (Perera et al., 2013) (1.,

2.táblázat. Az ismert szerkezetű B család DNS-polimerázainak összeállítása.
a polimeráz
leválasztásának mechanizmusa a kristályokban rögzített RNS / DNS oligonukleotid a várt módon a-formájú konformációt alkalmaz. A hüvelykujj tartomány több kölcsönhatást folytat az RNS alapozóval, mind hidrofób kapcsolatok, mind poláris kölcsönhatások révén (Perera et al., 2013)., Az oldatban végzett kísérletek azt mutatták, hogy az RNS primer Pol α-val történő kiterjesztése 10-12 nukleotidra korlátozódik, ami egy spirál egy fordulatának felel meg. Ez a megfigyelés vezetett a szerzők, hogy azt sugallják, egy mechanizmus megszűnése alapozó szintézis által pol α, ahol elvesztése specifikus kölcsönhatások között, a hüvelykujj pedig az RNS beindítja a polimeráz, hogy kapcsolja ki a DNS/RNS oligonukleotid, valamint lehetővé teszi a kezét, hogy egy replikációs polimeráz.,
Mozgások a Palm Domain megkönnyíthetik a Transzlokáció a Pol α
Hogy kikristályosodott az enzim három államban (apo, kettős, illetve hármas) lehetővé tette, hogy a szerzők, hogy overlay mind a három strukturális modellek. A Pol α az egyetlen eukarióta B DNS-polimeráz család, amelyre mindhárom államot kristályszerkezetben rögzítették. A szerkezeti szuperpozícióból kiderült, hogy a szubsztrátkötést és nukleotidil-transzfert kísérő ujjak és hüvelykujj aldomain jól dokumentált mozgása mellett maga a tenyér aldomain is szerkezeti átrendeződésen megy keresztül (Perera et al.,, 2013). A szerzők azt javasolják, hogy a tenyérdomain különböző konformációi elősegíthetik a pol α transzlokációját az RNS/DNS duplex mentén és azon túl. Mint már említettük, az RNS-szálhoz való érintkezések elvesztése várhatóan kiváltja a primer felszabadulását, amely ezután Pol δ vagy ε kiterjesztéssel válik elérhetővé.,
az inaktivált exonukleáz Aldomainban egy másik Fehérjehajtás
a lektorálási aktivitás megszűnik a pol α-ban, mind a négy karboxilát mutációja miatt (az RB69 gp43-ban az ASP114/Glu116/Asp222/Asp327 a ser542/Gln544/Tyr644 / Asn757 szerkezet alapú igazításban) (2. táblázat). Ezenkívül a B család legtöbb polimerázában található β-hajtű motívumot (az RB69 gp43-ban 246-267 maradványok) a pol α spirális régiója váltja fel (maradék 667-676; 681-693) (Hogg et al., 2007)., A β hajtű az exonukleáz domén része, és T4 és RB69 pols-ban kimutatták, hogy részt vesz a DNS-primer polimeráz és az exonukleáz aktív hely közötti felosztásában (Reha-Krantz, 1988; Stocki et al., 1995; Hogg et al., 2007). Lektorálási tevékenység hiányában nem meglepő, hogy ez a motívum nem maradt fenn a pol α-ban. A Pol α veremben található spirális régió 684-es és Phe 685-ös értéke timin és guanin bázissal -3, illetve -2 pozícióban marad a sablon párosítatlan 5 ‘ végén (Perera et al., 2013)., Így a pol α-ban a β-hajtű motívumnak megfelelő régió más hajtást (helices vs.β szálak) és más funkciót (stabilizálja a sablonszál párosítatlan régióját, ahelyett, hogy megkönnyítené az aktív helykapcsolást). Mivel a pol α-nak nincs lektorálási aktivitása, felmerül a kérdés, hogy korrigálják-e a rövid oligonukleotidokat, és ha igen, melyik DNS-polimeráz. Úgy tűnik, hogy a Pol α által szintetizált primerek lektorálását Pol δ (Pavlov et al., 2006a).,
δ
humán pol δ négy alegységből áll, míg a Saccharomyces cerevisiae három (Gerik et al., 1998; Liu et al., 2000) (1. táblázat). A DNS replikációban betöltött szerepe mellett a pol δ szerepet játszott a DNS javításában és rekombinációjában (Hubscher et al., 2002; Lee et al., 2012; Tahirov, 2012). A P12, az emberi pol δ legkisebb alegysége, valamint a bimbózó élesztőben nem látható alegység a DNS-károsodás hatására lebomlik (Lee et al., 2014). A Pol δ (POL3) élesztő katalitikus alegysége 1097 maradékból áll., A kristályosításhoz használt konstrukció 67-985 maradékot tartalmaz, így hiányzik a CTD (1. ábra; 2. táblázat).
egy harmadik fémion a polimeráz aktív helyén
a tenyérdomén három konzervált karboxilátot (Asp608, Asp762 és Asp764) tartalmaz. A két katalitikus aszpartát, az Asp608 és az Asp764 két fémionnal (Ca2+) érintkezik a polimeráz aktív helyén, 3,7 Å-vel elválasztva. A bejövő nukleotid γ-foszfátja és a Glu802 egy harmadik fémet is megfigyeltek, a közelben Glu800 található., Mindkét glutamát alaninra történő mutálása egy polimeráz változatot eredményezett, amely csökkent beépítési hatékonysággal rendelkezik mind a helyes, mind a helytelen nukleotidok esetében (Swan et al., 2009). Ezeken az aminosav pozíciókon a pol α és Pol ε karboxilát-maradékokkal is rendelkezik (Pol δ Glu800/Glu802 megfelel a Pol α Asp1033/Asp1035 és Pol ε Glu945/Asp947-nek). Meg kell vizsgálni, hogy ezek a karboxilátok hasonló szerepet játszanak-e a pol α-ban és az ε-ban.,
high Fidelity and Lektorating
a humán pol δ egy nagy hűségű polimeráz, amely katalizálja a nukleotidil átviteli reakciót 1 / 22,000 hiba gyakorisággal (Schmitt et al., 2009). Lektorálás növeli a hűség a polimeráz egy tényező 10-100 (Mcculloch and Kunkel, 2008; Prindle et al., 2013). A Pol δ polimeráz és exonukleáz aktív helyet foglal el, melyet körülbelül 45 Å (Swan et al., 2009). DNS-polimeráz a lektorálás tevékenység képes értelemben misincorporated nukleotidok a kapcsolatot a kisebb horony bázispár túl a beillesztés helyén., A fehérje kölcsönhatásba lép az univerzális hidrogénkötési akceptorokkal a purinok és pirimidinek N3, illetve O2 pozíciójában (Seeman et al., 1976; Doublié et al., 1998; Franklin et al., 2001). Ezek a hidrogénkötési érintkezők megmaradnak, amikor az alappár egy Watson-Crick geometriát alkalmaz, és elvesznek egy eltérés esetén. Az RB69 gp43-ban az érintkezők az első két bázispárra terjednek ki a születő bázispáron túl (Franklin et al., 2001; Hogg et al., 2004, 2005). Az érintkezők sokkal kiterjedtebbek a pol δ-ban, öt bázispárra terjednek ki a beillesztés után (Swan et al.,, 2009), amely hozzájárulhat a nagy hűséghez.
mint már említettük, az exonukleáz domén β-hajtű szegmense kritikus szerepet játszik a DNS-nek a polimerizáció és a T4 és RB69 pols (Stocki et al., 1995; Hogg et al., 2007). Az RB69 gp43-ban a β-hajtű motívum különböző konformációkat alkalmaz, attól függően, hogy a komplexet sértetlen DNS-vel nyerték-e (Franklin et al., 2001; Zahn et al., 2007) vagy károsodást tartalmazó DNS (Freisinger et al., 2004; Hogg et al., 2004)., Teljesen láthatóvá vált, hogy mind a primer, mind a sablon szálakkal érintkezik egy komplexben a timinglikollal (Aller et al., 2011). Hasonlóképpen, a pol δ β hajtűje a DNS fő horonyjába nyúlik, és ékként működik a kettős szálú DNS és a sablonszál egyszálú 5 ‘ endje között, amelyet két aromás maradék phe441 és Tyr446 stabilizál (1. ábra) (Swan et al., 2009). A β hajtű helyzete megegyezik az aktív helykapcsolásban betöltött szerepével.,
Interdomain kapcsolatok és hűség
a rákban részt vevő mutációk többnyire a Pol δ És ε exonukleáz doménjében találhatók, hangsúlyozva a lektorálás kritikus szerepét a mutációk előfordulásának csökkentésében (Church et al., 2013; Henninger and Pursell, 2014). Az emberi colorectalis rákos sejtek egyik mutációja az ujjak tartományába, R689W-be lokalizálódik. az élesztő analóg mutációja (R696W) mutátor fenotípust eredményez (Daee et al., 2010)., Az Arg696 közelében lévő mutáció a Pol δ (a699q) élesztő aldomain ujjainak erősen megőrzött B motívumában mutátor fenotípust is eredményez. Az ujjak ezen területe az NTD közvetlen közelében van. Az NTD Met540 alaninra történő mutálása megszünteti az a699q mutátor fenotípusát, jelezve, hogy az ujjak és az NTD közötti kölcsönhatások befolyásolhatják a polimeráz hűségét (Prindle et al., 2013)., Hasonlóképpen a T4 pedig RB69 pols az NPL alapvető motívum, amely magában foglalja a maradékok az N-terminális palm tartományok, érintkezik az ujjak domain kimutatták, hogy stabilizálja a polimeráz-DNS-komplexek (Li et al., 2010).
ε DNS-polimeráz
az ε DNS-polimeráz katalitikus alegysége egy nagyon nagy gén (2222 aminosav élesztőben; 2286 emberben) terméke, és csak a harmadik a polimeráz ζ (szintén a B család tagja) és a Pol θ, egy polimeráz (3130 és 2590 aminosav) után (Lange et al.,, 2011; Hogg and Johansson, 2012) (1.ábra; 2. táblázat). A Pol ε kétszer akkora, mint a Pol δ, és két tandem polimeráz / exonukleáz régióból áll. Az N-terminális szegmens mind polimerázzal, mind lektorálási tevékenységgel rendelkezik, míg a C-terminális szegmens inaktivált. A két exonukleáz-polimeráz modul távoli rokonságban áll (Tahirov et al., 2009). Bár az inaktivált szegmens feltételezhetően szerkezeti szerepet játszik a replikáció során, két csoport képes volt katalitikusan aktív pol ε konstrukciók (maradékok 1-1228; 1-1187) kristályosodására, hiányzik a teljes C-terminál modul (Hogg et al.,, 2014; Jain et al., 2014a). Mindkét kristályszerkezet a polimeráz, a DNS alapozó/sablon és a bejövő nukleotid háromkomponensű komplexéből állt.
egy új Processivity Domain, amely a Tenyértartományból
Pol ε különbözik a pol δ-tól, mivel nem igényli a DNS csúszó bilincs PCNA-t a nagy processivitáshoz (Hogg and Johansson, 2012). A Pol ε tenyértartománya lényegesen nagyobb (380 maradék), mint a Pol α vagy δ (175, illetve 203 maradék)., A legutóbbi pol ε kristály struktúrák kiderült, hogy a betoldások a palm domain együttesen alkotnak egy új domain, amely három β-szál két helices (maradékok 533-555; 682-760) (Hogg et al., 2014; Jain et al., 2014a) (1. ábra; S1 táblázat). A 690-751 maradványok törlése csökkent polimeráz aktivitással rendelkező változatot eredményezett. Ezenkívül a foszfát gerincének közelében található pozitív töltésű maradványok (His748, Arg749 és Lys751) mutációja befolyásolta az enzim processivitását (Hogg et al., 2014)., A tenyérből származó extra domént tehát a processivity vagy P domainnek nevezték el, funkciója után. A P domain alapja fémkötési helyet tartalmaz (lásd alább) (Hogg et al., 2014; Jain et al., 2014A, b).
egy Vaskén Klaszter a polimeráz-tartományon belül
váratlanul oldatvizsgálatok kimutatták, hogy maga az ε élesztőpolimeráz katalitikus alegysége tartalmaz egy klasztert a polimeráz-hajtásán belül (Jain et al., 2014B), a CTD klaszterén kívül (2.ábra; 2. táblázat)., A pol ε-n belüli második klaszter azt sugallja, hogy ez a polimeráz érzékenyebb lehet az oxidatív stresszre (Jain et al., 2014b). Pol ε kristályszerkezetei azonban nem tártak fel klasztert a polimeráz tartományban (Hogg et al., 2014; Jain et al., 2014a; Zahn és Doublié, 2014). A ciszteinmaradványok közül kettő rendezetlen a szerkezeti modellekben, és úgy tűnik, hogy az így létrejövő fémkötőhely kötődik a cinkhez (Hogg et al., 2014; Jain et al., 2014a). Az a helyettesítése egy nem natív cink fémkötő fehérjék nem szokatlan (Netz et al., 2012) mivel a klaszterek labilisak., A pol ε polimeráz tartományon belüli megjelenítéséhez anaerob körülmények szükségesek.
egy rövid β-hajtű motívum az exonukleáz tartományban
minden olyan DNS-polimerázban, amely mind a polimeráz, mind az exonukleáz tevékenységeket magában foglalja, a kötött DNS egyensúlyban van a két aktív központ között (Beechem et al., 1998). A bejövő nukleotid koncentrációja, valamint a sérült bázis vagy rosszindulat jelenléte két tényező, amelyek befolyásolják a DNS átvitelét a polimeráz aktiválási helyéről a lektoráló aktív helyre., Polimerázok figyelemmel kíséri a kisebb horony oldalán az újonnan alakult bázis Párok, és kölcsönhatásba lépnek az univerzális H kötés elfogadók, O3, és N2, mint egy módja annak, hogy ellenőrizze az eltérések (Seeman et al., 1976; Franklin et al., 2001). A pol ε egyedülálló tulajdonsága, hogy az exonukleáz-tartományból, a Tyr431-ből származó maradékon keresztül érintkezik a születő bázispár fő horonyoldalával. További elemzésre van szükség annak tisztázására, hogy ennek a tirozinnak milyen szerepe van a pol ε Nagy hűségében.,
pol δ-ban a β-hajtű szegmens beszúrja magát a DNS-be, és ékként viselkedik az egyszálú és a kettős szálú DNS között (Swan et al., 2009). Az E. coli DNS pol II-ben egy β hordó behelyezése úgy változtatja meg a β hajtű helyzetét, hogy a polimerizáció előnyben részesüljön a lektorálás felett (Wang and Yang, 2009). Ez a módosítás feltehetően lehetővé teszi, hogy ez a polimeráz transzlezionszintézis kiterjesztést hajtson végre., Mivel a Pol ε pontos DNS-polimeráz, a kristályszerkezet ismerete előtti feltételezés az lenne, hogy a β hajtűnek közelebb kell lennie a Pol δ-hoz, mint az E. coli Pol II-hez. meglepő módon a Pol ε β-hajtű motívuma csonka, túl rövid a DNS-hez való érintkezéshez (1.ábra). Melyik fehérje motívum, akkor lehet, hogy megkönnyíti az aktív helykapcsolást a hiba észlelésekor? A P domain jó jelölt, mind az alapozó, mind a sablon szálakkal való érintkezése miatt; a P tartomány maradványai érzékelhetik a replikációs hibákat, így elősegíthetik az aktív webhelykapcsolást.,
Következtetéseket
Mind a három eukarióta replikációs DNS-polimeráz közös B-család szeres, minden polimeráz beépült, módosított szerkezeti elemek, amelyek egyedi, személyre szabott, minden polimeráz sajátos funkciót (például a kiegészítéssel, hogy a processivity domain a pol ε, egy processive polimeráz, hogy nem használja a PCNA, vagy a módosított régió vegye fel a kapcsolatot a 5’end a sablon a pol α, egy polimeráz mentes a szerkesztői tevékenység). A B család polimerázainak hajtása jól alkalmazható nagy hűségű, replikatív polimerázokhoz., De meglepő módon a transzlezion polimerázok is használják. Az eukarióta pol ζ (vagy REV3L) egy 353 kDa polimeráz, amely a transzlezionszintézisben működik, és úgy tűnik, hogy elnyomja a tumorigenezist (Wittschieben et al., 2010; Lange et al., 2011; Zahn et al., 2011; Hogg and Johansson, 2012; Sharma et al., 2013). Az E. coli Pol II szerkezete olyan módosításokat tárt fel az NTD-ben, amelyek befolyásolják az exonukleáz domén β hajtűjének helyzetét, és ezáltal a DNS elválasztását a polimerizációs és lektorálási helyek között (Wang and Yang, 2009)., A pol ζ szerkezete hasonló kiigazításokat mutathat ki, amelyek megváltoztatják a nagy hűségű, replikatív polimerázok által alkalmazott hajtást, hogy az enzim kevésbé hű legyen, és képes transzlezionszintézist végezni.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
nyugtázás
ezt a munkát az Országos Egészségügyi Intézetek (NCI R01 CA 52040) támogatása támogatta.
















Vélemény, hozzászólás?