mivel a hőmérséklet emelkedik, így az enzimreakciók sebessége is. A tíz fokos hőmérséklet-emelkedés a legtöbb enzim aktivitását 50% – kal 100% – ra növeli. A reakcióhőmérséklet 1 vagy 2 fokos változása 10-20% – os változásokat eredményezhet az eredményekben. Ez a növekedés csak egy bizonyos pontig tart, amíg az emelkedett hőmérséklet meg nem szakítja az enzim szerkezetét. Az enzim denaturálása után nem javítható., Mivel az egyes enzimek szerkezete és az aminosavak és a peptidek közötti kötések eltérőek, a denaturálás hőmérséklete minden egyes enzimre specifikus. Mivel a legtöbb állati enzim gyorsan denaturálódik 40°C feletti hőmérsékleten, a legtöbb enzim meghatározást valamivel a hőmérséklet alatt végzik.
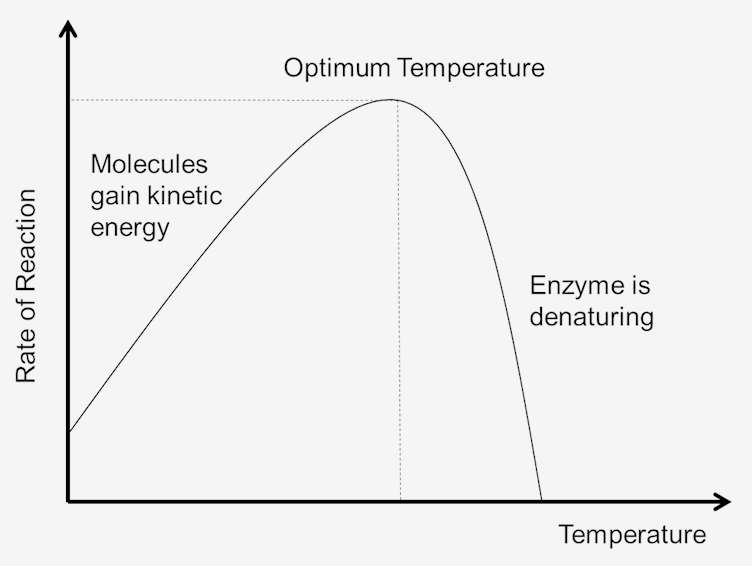 1.ábra. A hőmérséklet hatása a reakciósebességre.
1.ábra. A hőmérséklet hatása a reakciósebességre.
egy idő alatt az enzimeket még mérsékelt hőmérsékleten is deaktiválják. Az enzimek tárolása 5°C-on vagy alatt általában a legmegfelelőbb. Az alacsonyabb hőmérséklet lassabb kémiai reakciókhoz vezet., Az enzimek végül inaktívvá válnak fagyasztási hőmérsékleten, de visszaállítják enzimaktivitásuk nagy részét, amikor a hőmérséklet ismét növekszik, míg egyes enzimek fagyasztva elveszítik aktivitásukat.
kinetikus energia és belső energia
a rendszer hőmérséklete bizonyos mértékig a rendszerben lévő molekulák kinetikus energiájának mértéke. Az összes molekula közötti ütközések a hőmérséklet növekedésével nőnek. Ennek oka a hőmérséklet emelkedését követő sebesség-és kinetikai energia növekedése. Gyorsabb sebesség esetén kevesebb idő lesz az ütközések között., Ez azt eredményezi, hogy több molekula éri el az aktiválási energiát, ami növeli a reakciók sebességét. Mivel a molekulák is gyorsabban mozognak, az enzimek és a szubsztrátok közötti ütközések is növekednek. Így minél alacsonyabb a kinetikus energia, annál alacsonyabb a rendszer hőmérséklete, valamint minél magasabb a kinetikus energia, annál nagyobb a rendszer hőmérséklete.
a rendszer hőmérsékletének növekedésével a rendszerben lévő molekulák belső energiája növekedni fog., A molekulák belső energiája magában foglalhatja a molekulák transzlációs energiáját, vibrációs energiáját és forgási energiáját, a molekulák kémiai kötésében részt vevő energiát, valamint a nem kötődő kölcsönhatásokban részt vevő energiát. Ennek a hőnek egy része kémiai potenciális energiává alakítható. Ha ez a kémiai potenciál energia növekedés elég nagy néhány gyenge kötések, amelyek meghatározzák a háromdimenziós alakja az aktív fehérjék lehet törni. Ez a fehérje termikus denaturálásához vezethet, így inaktiválhatja a fehérjét., Így a túl sok hő hatására az enzimkatalizált reakció sebessége csökkenhet, mivel az enzim vagy szubsztrát denaturálódik és inaktív lesz.
optimális hőmérséklet
minden enzimnek olyan hőmérsékleti tartománya van, amelyben maximális reakciósebességet érünk el. Ezt a maximumot az enzim hőmérsékleti optimumának nevezik. A legtöbb enzim optimális hőmérséklete körülbelül 98,6 Fahrenheit fok (37 Celsius fok). Vannak olyan enzimek is, amelyek jól működnek alacsonyabb és magasabb hőmérsékleten., Például a sarkvidéki állatok enzimjei az alacsonyabb optimális hőmérsékletekhez igazodnak; a sivatagi éghajlatú állatok enzimjei magasabb hőmérsékletekhez igazodnak. Az enzimek azonban még mindig fehérjék, és mint minden fehérje, 104 Fahrenheit fok feletti hőmérsékleten is elkezdenek lebomlani. Ezért az enzimaktivitás tartományát az a hőmérséklet határozza meg, amelyen az enzim aktiválódni kezd, valamint azt a hőmérsékletet, amelyen a fehérje elkezd bomlani.,
kapcsolódó szolgáltatások
enzim kinetika
Enzimológiai vizsgálatok
a szolgáltatás további részleteinek megvitatásához kérjük, vegye fel velünk a kapcsolatot az 1-631-562-8517 telefonszámon, vagy e-mailben [email protected].
















Vélemény, hozzászólás?