US Pharm. 2010;35(5):36-41.
a diabetes mellitus (DM) és a demencia közötti kapcsolat tagadhatatlan, számos tanulmány arra a következtetésre jutott, hogy a DM növeli a kognitív hanyatlás és a demencia kockázatát, beleértve az Alzheimer-kórt (ad).1-5 nem csak a DM növeli a demencia kockázatát, hanem valójában növeli a demencia kialakulásának sebességét két – három alkalommal.,3 ennek a károsodásnak a mechanizmusa nem teljesen ismert, de feltételezzük, hogy a hiperglikémia, az inzulinrezisztencia, az oxidatív stressz, a fejlett glikációs végtermékek, valamint a gyulladásos citokinek együttesen kognitív diszfunkcióhoz vezetnek.5 valójában a cukorbetegséget 1976-ban “speciális gyorsított öregedésnek” nevezték, sok kapcsolódó szövődménye miatt.,5 a DM és a demencia közötti nyilvánvaló átfedés arra a felvetésre vezetett, hogy az AD nem kizárólag neurológiai rendellenesség, hanem neuroendokrin rendellenesség, Steen et al a 3.típusú cukorbetegség kifejezésével a hibrid betegség leírására.,6
Áttekintés az Inzulin Rezisztencia/Csökkent Glükóz Tolerancia
Történik: Mind a csökkent glükóz tolerancia—meghatározása a plazma glükóz 140 mg/dL 199 mg/dL után egy orális glükóz tolerancia teszt—, illetve károsodott éhomi vércukor—meghatározás szerint egy éhgyomri plazma glükóz 100 mg/dL 125 mg/dL—vagy diagnosztikai prediabetes (prekurzor, hogy 2-es típusú DM ), mint a hemoglobin A1C 5.7% 6,4%.7 a prediabetes kórélettana megegyezik a T2DM kórélettanával, amelyet 126 mg/dL vagy annál nagyobb éhgyomri vércukorszint vagy 6-os A1C után diagnosztizálnak.,5% vagy nagyobb (a vizsgálat megismétlődik a megerősítéshez).7 mind A feltételeket, inzulin rezisztencia alakul ki a perifériás szövetekben, ahol inzulin szükséges a glükóz felvételét (azaz izom, máj, zsír), valamint a hasnyálmirigy arra kényszerül, hogy a kínálat egyre több inzulint kell leküzdeni ezt az ellenállást.8 ebben a szakaszban a betegek gyakran hyperinsulinemikusak; idővel azonban a hasnyálmirigy nem képes kielégíteni a szövetek igényeit, és a hasnyálmirigy inzulintermelő béta sejtjei lassan meghibásodnak, egyre kevesebb inzulint termelnek.,8 elegendő inzulin nélkül a vércukorszint emelkedik, ami prediabeteshez vezet, és a prediabetesben szenvedő betegek legfeljebb 70% – ánál T2DM.9 A szövődmények hyperglykaemia számos terjed fokozott macrovascular szövődmények (beleértve a miokardiális infarktus, cerebrovascularis esemény, valamint a perifériás érbetegség), valamint a mikrovaszkuláris szövődmények (beleértve a nephropathia, neuropathia, valamint a retinopathia).7
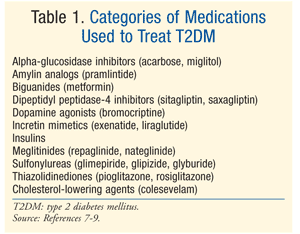
kezelés: számos terápia létezik a DM kezelésére., A kezdeti kezelés mind a prediabetes, mind a T2DM esetében az életmód módosítása, amely magában foglalja az étrendet, a testmozgást és a fogyást.7 Az American Diabetes Association (ADA) szintén javasolja a metformin megfontolását olyan prediabeteses betegeknél, akiknek nagy a kockázata a cukorbetegség kialakulásának.7 A Metformin ajánlott a T2DM kezdeti farmakológiai terápiájaként.7 gyakran további farmakológiai terápiára van szükség az ADA glikémiás céljainak eléréséhez, beleértve az A1C <7% – ot.,7 a T2DM-nek számos gyógyszerosztálya van (1. táblázat), és a vércukorszint normalizálására szolgáló szer kiválasztása számos beteg – és gyógyszerspecifikus tényezőtől függ. Fontos megjegyezni, hogy sok T2DM-ben szenvedő betegnek végül exogén inzulinra lesz szüksége az euglikémia eléréséhez és fenntartásához, mivel a béta-sejt funkció fokozatosan csökken.
az AD áttekintése
patofiziológia: az AD a demencia leggyakoribb formája idősebb felnőtteknél, az esetek 60-80% – át teszi ki.,10 Az AD két kórszövettani jellemzője a neuritikus plakkok és a neurofibrilláris hínár.11 plakk oldhatatlan béta-amiloid fehérjéből áll. Az intracelluláris gubancok foszforilált tau fehérjéből állnak. A tau fehérje fontos szerepet játszik a mikrotubulusok összeszerelésében, és ha ez a fehérje abnormálisan foszforilált, a neuronális funkció megszakad. A neurofibrilláris gubancok leggyakrabban a kolinerg neuronokat érintik.12 ezenkívül a fő izgató neurotranszmitter, a glutamát megzavarása hozzájárul az AD patológiájához., Az AD-ben a glutamát túlaktiválódik, jelezve egy excitotoxicitás néven ismert folyamatot, amely plakkképződéshez, a tau fehérje hiperfoszforilációjához és sejthalálhoz vezet.Összefoglalva, az excitotoxicitás, valamint a neuritikus plakkok és neurofibrilláris hínárok kialakulása megzavarja a neurotranszmitter pályákat, ami az AD-vel kapcsolatos tanulási és memóriazavarhoz vezet.
kezelés: a rendelkezésre álló FDA által jóváhagyott farmakológiai terápiákat az AD-re a 2. táblázat foglalja össze.,11,12, Miközben még mindig sok a tanult tekintetében terápiák ezt kezelni, vagy megváltoztathatja a patológia HIRDETÉS, jelenleg rendelkezésre álló terápiák jár a használata acetilkolineszteráz-gátlók, amelyeket négy, az N-metil-d-aszpartát-receptor antagonista memantin.

inzulin és az agy
bár a perifériás szövetekbe történő glükóz szállításhoz szükséges, úgy tűnik, hogy az inzulin nem szükséges a glükóz agyba történő szállításához vagy az agyi glükóz metabolizmusához., Míg az agyba történő glükózszállítás nem függ az inzulintól, maga az inzulin a vér–agy gáton (BBB) keresztül az inzulinreceptor által közvetített transzportfolyamatok útján terjed.13 Ez a transzportmechanizmus telíthető; a periférián-például a prediabeteszben és a T2DM-ben-a túlzott inzulinkoncentráció (hyperinsulinemia) hosszabb ideig tartó fennállása esetén ez a receptor által közvetített transzportmechanizmus lecsökken, ezáltal csökkentve az inzulinnak az agyba és a cerebrospinális folyadékba történő szállítását.,
az inzulin mellett az 1-es típusú inzulinszerű növekedési faktor (IGF-1) is jelen van az agyban, és a központi idegrendszer (CNS) normális növekedéséhez és működéséhez szükséges.14 inzulin és IGF-1 receptor található az agyban neuronokon és asztrocitákon (csillag alakú sejtek a központi idegrendszerben, amelyek segítik az agy neuronjait). Az agy két, a tanuláshoz és a memóriához elengedhetetlen területe, a hippokampusz és a hipotalamusz magas koncentrációban tartalmaz inzulinreceptorokat.5 patkányokban kimutatták, hogy az intracerebroventricularis inzulin alkalmazása fokozza a memóriát.,15 ezenkívül kimutatták, hogy az intranazális inzulin alkalmazása emberben növeli a memória teljesítményét.16 amint azt korábban említettük, az inzulin nem szükséges az agyi glükóz metabolizmusához; azonban lehetnek olyan területek az agyban, ahol az inzulin metabolikus folyamatokat vált ki glükózzal. Patkánykísérletekben kimutatták, hogy az inzulin befolyásolja a glükóz felhasználását a hipotalamuszban és a locus coeruleusban, két olyan területen, amelyek fontosak a tanulás és a memória szempontjából.,17 Tanulás is kimutatták, hogy megkönnyítse a fokozott kifejeződése CNS inzulin receptorokhoz, ami a feltételezése, hogy a jelenlét az inzulin aktivitás az agyban hozzájárulni alapvető szerepet játszanak a tanulás, memória. Az inzulin hozzájárulhat a központi idegrendszeri neurotranszmitterek, különösen az acetilkolin és a noradrenalin modulációjához is, amelyek mind a normális megismerés, mind az agy egészsége szempontjából kritikusak.,18
inzulinrezisztencia és demencia
áttekintés: úgy tűnik, hogy az AD-betegek agyában számos hiányosság van az inzulin jelátvitelében, ami csökkent glükózfelhasználáshoz és energia metabolizmushoz vezet.6,19 mivel a T2DM perifériás inzulinrezisztenciával társul, az AD az agyi inzulinrezisztenciával társul.Az AD 20 korai szakaszában úgy tűnik, hogy nem megfelelő az inzulinfelvétel és a jelzés az agyban, ami az inzulinrezisztencia jele.5,19,21,22 emelkedett inzulinreceptorokat észleltek az AD-ben szenvedő betegek agyában, valószínűleg az inzulinrezisztencia kompenzációjaként.,21
összességében az inzulinjelzés ezen károsodása számos downstream hatást fejt ki az AD-ben. Az egyik elmélet szerint az alacsony inzulinkoncentráció a központi idegrendszerben az acetilkolin-szint és az agyi véráramlás csökkenését okozza.13 ezenkívül az inzulinkoncentráció változásai elősegíthetik a béta-amiloid és a tau fehérje képződését.2 az agyban az inzulinbontó enzim (IDE) részt vesz a béta-amiloid fehérjék lebomlásában és clearance-ében.21 az inzulin magas szintje gátolja az IDE-t, és a béta-amiloid clearance csökkenéséhez vezethet, ami később növeli a béta-amiloid agyi lerakódását.,5,19,21
az utóbbi időben a ceramidok, a lipidek családja figyelmet fordított az inzulinrezisztenciában és a demenciában betöltött potenciális szerepükre.23,24 ceramidok keletkeznek gyulladás jelenlétében, ami gyakori az elhízásban, a T2DM-ben és az AD-ben.24 mivel a ceramid könnyen átjut a BBB-n, az expozíció károsodott energia-anyagcserét és az inzulingén expressziójának változásait okozza, hozzájárulva az inzulinrezisztenciához.23,24 ez jelenleg aktív érdeklődési terület, a kutatók bebizonyították, hogy a ceramid szintézis gátlása megakadályozta az elhízás által közvetített inzulinrezisztenciát.,24
intranazális inzulin: amint azt korábban említettük, az intranazális inzulin alkalmazása javítja a memória teljesítményét emberekben.16 több intranazális inzulinnal végzett vizsgálatot végeztek. Amikor naponta kétszer 20 egység intranazális inzulint adtak humán alanyoknak, a Reger et al megállapította, hogy az inzulinnal kezelt csoport a placebóhoz képest több verbális információt tartott fenn, és jobb figyelmet és funkcionális státuszt mutatott.,25 ezek a kutatók azt is megjegyezték, hogy az éhomi plazma glükóz és inzulin nem változott az intranazális inzulin alkalmazásakor, ami azt jelzi, hogy az intranazális alkalmazás közvetlen inzulin hozzáférést biztosít a központi idegrendszerhez perifériás hatások nélkül.25,26
PPAR-Gamma agonisták: a perifériás inzulinrezisztencia kezelésére széles körben tanulmányozták a tiazolidindionok roziglitazon és pioglitazon AD kezelésében betöltött szerepüket. A tiazolidindionok peroxiszóma proliferátor-aktivált receptor (PPAR) – gamma agonisták., A PPAR-gamma részt vesz a glükóz és a lipid metabolizmusában, és modulálja a gyulladást, amely az AD ismert közreműködője.22,27 a tiazolidindionok inzulinérzékenyítők, amelyek csökkentik az inzulinrezisztenciát; úgy tűnik, hogy csökkentik a gyulladást is.21,26 több placebo-kontrollos vizsgálatban a roziglitazonnal kezelt betegeknél javult a memória és a kognitív funkció.21,22,28 bár csak kis vizsgálatokat végeztek pioglitazonnal, ez a gyógyszer is összefüggésbe hozható a memória és a megismerés javulásával.,22 bár a pioglitazon és a roziglitazon BBB permeabilitása gyenge, mindegyik hatóanyagot orális adagolás után az agyban dokumentálták.22 Bár ezek a gyógyszerek szerepe lehet a megelőzés, illetve a kezelés AD, ezek jelenleg nem FDA által jóváhagyott, a betegek AD, a lehetséges előnyeit, illetve kockázatot, alaposan meg kell egyedi mérlegelés alapján.
aerob testmozgás: talán az inzulinrezisztencia csökkentésének leghatékonyabb és leginkább figyelmen kívül hagyott módszere a fizikai aktivitás., Az elhízás összefüggésbe hozható az inzulinrezisztencia, a cukorbetegség, a demencia és az AD fokozott kockázatával.29,30 testmozgás javítja az inzulinérzékenységet és csökkenti a perifériás inzulinszintet.26,31 a testsúlytól független fizikai aktivitás alacsonyabb AD-kockázattal jár, így ez az egyetlen bizonyított neuroprotektív terápia.29-31 ennek a neuroprotekciónak az egyik lehetséges mechanizmusa, hogy a testmozgás elősegíti a béta-amiloid fehérjék clearance-ét, és növeli az agyból származó neurotróf faktort, amely a kognitív és neuronális túlélés szempontjából létfontosságú növekedési faktor, amely az AD-ben csökken.,32
gyógyszerész szerepe
a gyógyszerészek alapvető szerepet játszanak a betegek oktatásában az új terápiákról; tartózkodniuk kell az új orvosi felfedezésektől vagy a hírekben gyakran bemutatott állapotoktól is. A 3-as típusú cukorbetegség egy ilyen állapot. Bár még sokat kell tudni erről a lehetséges új kapcsolatról a cukorbetegség és a károsodott megismerés között, a nyilvánosság megkérdezi az egészségügyi szolgáltatók véleményét. Ezenkívül sok cukorbetegségben szenvedő beteg érdeklődik a tanulás iránt, és információért fordul a gyógyszerészekhez., Ezért a gyógyszerészeknek meg kell vitatniuk ennek a betegségnek a jelenlegi megértését betegeikkel, és tanácsot kell adniuk nekik olyan stratégiákról is, amelyek csökkenthetik kockázatukat, tekintettel az egyéni társbetegségekre.
következtetés
intenzív vizsgálat folyik a 3-as típusú cukorbetegség jobb jellemzésére, valamint megelőző és terápiás stratégiák kidolgozására. A mai napig nincsenek specifikus kezelések, amelyek bizonyítottan hatékonyak a kognitív hanyatlás vagy az AD megelőzésében DM-ben szenvedő betegeknél., Ezért a DM-ben szenvedő betegek kognitív károsodásának kezelése megegyezik a DM-ben nem szenvedő betegekével, különös tekintettel a glikémiás kontrollra és a kardiovaszkuláris kockázati tényezőkre. Ez ugyanaz a megközelítés, amely már elengedhetetlen a DM-hez kapcsolódó szövődmények megelőzéséhez. Míg úgy tűnik, hogy egyes betegcsoportok fokozott kockázatot jelentenek a kognitív károsodás szempontjából, a DM-ben szenvedő betegek többsége nem rendelkezik jól meghatározott klinikai társulásokkal., Bár konkrét kezelési lehetőségek nem állnak rendelkezésre, a jelenlegi logikus megközelítés a glikémiás kontroll elérése és a kardiovaszkuláris kockázati tényezők, például a hiperlipidémia és a magas vérnyomás körültekintő kezelése.
1. Stewart R, Liolitsa D. 2-es típusú diabetes mellitus, kognitív károsodás és demencia. Diabet Med.
2. Xu WL, von Strauss E, Qiu CX, et al. Az ellenőrizetlen cukorbetegség növeli az Alzheimer-kór kockázatát: populációs kohorsz vizsgálat. Diabetologia. 2009;52:1031-1039.
3. Arvanitakis Z, Wilson RS, Bennett DA. Diabetes mellitus, demencia és kognitív funkció időseknél., J Nutr Egészségügyi Öregedés. 2006;10:287-291.
4. Jacobson AM, Musen G, Ryan CM, et al. A cukorbetegség hosszú távú hatása és kezelése a kognitív funkcióra. N Engl J Med. 2007;356:1842–1852.
5. Whitmer RA. 2-es típusú cukorbetegség, kognitív károsodás és demencia kockázata. Curr Neurol Neurosci Rep. 2007; 7: 373-380.
6. Steen E, Terry BM, Rivera EJ, et al. Csökkent inzulin – és inzulinszerű növekedési faktor expresszió és jelátviteli mechanizmusok az Alzheimer-kórban-ez a 3-as típusú cukorbetegség? Dzsudzsák Balázst. 2005;7:63-80.
7. American Diabetes Association. A cukorbetegség orvosi ellátásának normái-2010., Cukorbetegség Kezelése.
8. Triplitt Cl, Reasner CA, Isley WL. Diabetes mellitus. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Farmakoterápiás elvek & gyakorlat. 7. Szerk. New York, NY: McGraw Hill Medical; 2008:1205-1241.
9. Nathan DM, Buse JB, Davidson MD, et al. A hiperglikémia orvosi kezelése a 2-es típusú cukorbetegségben: konszenzus algoritmus a terápia megkezdéséhez és kiigazításához: az American Diabetes Association és az Európai Szövetség konszenzusos nyilatkozata a cukorbetegség tanulmányozásához. Cukorbetegség Kezelése.
10. Hebert LE, Scherr PA, Bienias JL, et al., Alzheimer-kór az Egyesült Államok népességében: prevalencia becslések a 2000-es népszámlálás alapján. Arch Neurol. 2003;60:1119-1122.
11. Cummings J. Alzheimer-kór. N Engl J Med. 2004;351:56-67.
12. Slattum PW, Swerdlow RH, Hill AM. Alzheimer-kór. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Farmakoterápiás elvek & gyakorlat. 7. Szerk. New York, NY: McGraw Hill Medical; 2008:1051-1065.
13. Craft S, Watson GS. Inzulin és neurodegeneratív betegség: közös és specifikus mechanizmusok. Lancet Neurol. 2004;3:169-178.
14. de La Monte SM, Wands JR., Az inzulin és az inzulinszerű növekedési faktor expressziójának, jelátvitelének és a központi idegrendszer működésképtelenségének felülvizsgálata: az Alzheimer-kór szempontjából releváns. Dzsudzsák Balázst. 2005;7:45-61.
15. Park CR, Seeley RJ, Craft S, Woods SC. Az intracerebroventricularis inzulin fokozza a memóriát egy passzív elkerülési feladat során. Physiol Behavior. 2000;68:509-514.
16. Fehm HL, Perras B, Smolnik R, et al. A neuropeptidergikus utak manipulálása emberben: a neurofarmakológia új megközelítése? Eur J Farmakol. 2000;405:43-54.
17. Zhao WQ, Alkon DL. Az inzulin – és inzulinreceptor szerepe a tanulásban és a memóriában., Mol Sejt Endokrinol. 2001;177:125-134.
18. Kopf s, Baratti C. Az inzulin poszttraining alkalmazásának hatásai a szoktatási válasz megtartására egerekben: központi kolinerg mechanizmus részvétele. Neurobiol Tanulni Mem.
19. Revill P, Moral MA, Prous JR. Gyógyszerek Ma (Barc). 2006;42:785-790.
20. Moroz N, Tong M, Longato L, et al. Korlátozott Alzheimer-típusú neurodegeneráció kísérleti elhízásban és 2-es típusú diabetes mellitusban. Dzsudzsák Balázst. 2008;15:29-44.
21. Haan MN., Terápia insight: 2-es típusú diabetes mellitus és a késői Alzheimer-kór kockázata. Nat Clin Pract Neurol. 2006;2:159-166.
22. Landreth G, Jiang Q, Madrekar S, et al. PPARgamma agonisták, mint terápiák az Alzheimer-kór kezelésére. Neurotherapeutika. 2008;5:481-489.
23. Lyn-szakács LE, Lawton M, Tang M, et al. A máj ceramid 2-es típusú diabetesben és alkoholmentes steatohepatitisben az agyi inzulinrezisztenciát és neurodegenerációt közvetíthet. Dzsudzsák Balázst.
24. Tong M, De La Monte SM. A ceramid által közvetített neurodegeneráció mechanizmusai. Dzsudzsák Balázst.
25., Reger MA, Watson GS, Zöld PS. Az intranazális inzulin javítja a megismerést, és ad elején modulálja a béta-amiloidot. Neurológia. 2008;70:440-448.
26. Craft S. inzulinrezisztencia szindróma és Alzheimer-kór: életkorral és elhízással kapcsolatos hatások a memóriára, az amiloidra és a gyulladásra. Neurobiol Öregedés. 2005;26(suppl 1): 65-69.
27. Csiang Q, Heneka M, Landreth GE. A peroxiszóma proliferátor-aktivált receptor-gamma (PPARgamma) szerepe az Alzheimer-kórban: terápiás következmények. Központi idegrendszeri gyógyszerek. 2008;22:1-14.
28. Watson GS, Cholerton BA, Reger MA, et al., Tartósított megismerés korai Alzheimer-kórban és amnesztiás enyhe kognitív károsodásban szenvedő betegeknél a roziglitazon-kezelés alatt: előzetes vizsgálat. Am J Geriatr Pszichiátria. 2005;13:950-958.
29. Luchsinger JA, Mayeux R. Adiposity és Alzheimer-kór. 2007;4:127-134.
30. Whitmer RA. Az adipozitás és a demencia epidemiológiája. 2007;4:117-122.
31. Watson GS, Craft S. az inzulinrezisztencia szerepe az Alzheimer-kór patogenezisében: a kezelésre gyakorolt hatások. Központi idegrendszeri gyógyszerek. 2003;17:27-45.
32. Cole GM, Frautschy SA., Az inzulin és a neurotróf faktorjelzés szerepe az agyi öregedésben és az Alzheimer-kórban. Exp Gerontol. 2007;42:10-21.
















Vélemény, hozzászólás?