Introduction
les chloroplastes représentent une caractéristique structurelle des cellules végétales et soutiennent la survie des plantes par leur métabolisme primaire et leurs fonctions de haut niveau (Kirk et Tilney-Bassett, 1978; Mullet, 1988; López-Juez et Pyke, 2005). Pendant la croissance végétative des plantes, les cellules foliaires contiennent une population très homogène de chloroplastes en ce qui concerne la taille et la forme., Le nombre de chloroplastes par cellule est obtenu par fission binaire d’organites préexistants et par partitionnement en deux cellules filles au cours de la division cellulaire (Birky, 1983; Possingham et Lawrence, 1983). Ainsi, la régulation du nombre de chloroplastes dans un type cellulaire donné est cruciale pour la fonction cellulaire et l’héritage génétique des chloroplastes.
pour étudier la nature de la détermination du nombre de chloroplastes dans les cellules végétales, les cellules du mésophylle foliaire des espèces représentatives ont joué un rôle majeur ., Ces cellules sont physiologiquement importantes pour la photosynthèse et présentent un haut degré d’homogénéité structurelle et fonctionnelle. Premières analyses systématiques d’observation de tissus et de cellules isolés (Boasson et Laetsch, 1969; Possingham et Saurer, 1969; Boffey et al., 1979; Lamppa et coll.,, 1980; Thomas Et Rose, 1983; Pyke et Leech, 1991) ont fourni de nombreuses informations utiles sur la détermination du nombre de chloroplastes, y compris la notion que les chloroplastes (plastes) ne sont pas synthétisés de novo mais se répliquent par division et l’observation que le nombre de chloroplastes du mésophylle foliaire est sensible à divers facteurs environnementaux et endogènes des plantes. Dans ce dernier cas, chez les épinards, la lumière a un impact positif sur la division des chloroplastes pendant la culture du disque foliaire comparativement aux conditions sombres ou sombres (Possingham et Lawrence, 1983)., Dans les premières feuilles de blé, le volume cellulaire est positivement corrélé à la prolifération des chloroplastes (Ellis et Leech, 1985; Pyke et Leech, 1987). Chez Arabidopsis, le fond génétique affecte la prolifération des chloroplastes; le nombre moyen de chloroplastes par cellule dans les premières feuilles est de 121 dans L’écotype Landsberg erecta (Ler) et de 83 dans L’écotype Wassilewskija (WS) (Pyke et Leech, 1994; Pyke et al., 1994)., Les cellules du mésophylle foliaire ont également contribué à la compréhension du contrôle génétique de la division des chloroplastes; par exemple, Le dépistage des mutants altérés dans la prolifération des chloroplastes et la caractérisation des fonctions géniques impliquées dans la division des chloroplastes ont révélé plus de 20 gènes codant pour les composants de la machinerie de la division des chloroplastes ou des facteurs, 2011; Basak et Møller, 2013; Osteryoung et Pyke, 2014; Li et coll., 2017).
en revanche, des études sur la réplication des chloroplastes dans des cellules non mésophylles (par exemple, de la chaussée et des cellules dans l’épiderme de la feuille; Itoh et coll., 2018) sont rares. Récemment, il a été rapporté que la régulation de la division des chloroplastes différait entre les tissus foliaires (Fujiwara et al., 2018; Itoh et coll., 2018), bien que le mécanisme détaillé reste inconnu. De plus, alors que les analyses des cellules by-2 cultivées en suspension et des protoplastes du mésophylle foliaire dans le tabac et le méristème apical des pousses et les cellules primordiales des feuilles chez Arabidopsis (Nebenführ et al., 2000; Sheahan et coll.,, 2004; Seguí-Simarro et Staehelin, 2009) ont fourni des informations majeures, la façon dont le cloisonnement des chloroplastes (plastides) est régulé dans les plantes n’est pas encore claire. Ainsi, malgré des efforts considérables, des questions fondamentales demeurent dans la recherche sur les chloroplastes, telles que (i) comment le nombre de chloroplastes par cellule est-il coordonné dans les tissus végétaux et (ii) comment le partitionnement des chloroplastes est-il régulé lors de la division cellulaire.,
Historique des recherches sur le nombre de chloroplastes des cellules de garde
Les GCs stomatiques de l’épiderme des pousses contiennent généralement des chloroplastes et contrôlent les échanges gazeux entre le mésophylle foliaire et l’atmosphère (Sachs, 1875; Taiz et al., 2015; voir Figure 1a). La première étude du nombre de chloroplastes de GC dans les feuilles a été réalisée il y a plus d’un siècle chez des droséras cultivés naturellement (Macfarlane, 1898)., Cette étude a démontré que, comme d’autres caractéristiques structurelles des plantes et des cellules, le nombre de chloroplastes par cellule chez un hybride supposé dérivé d’un croisement entre Drosera filiformis et Drosera intermedia était intermédiaire entre les deux espèces, ce qui implique que le nombre de chloroplastes par GC pourrait être utilisé pour déterminer la composition génétique d’une plante. Des observations importantes ont ensuite été rapportées sur les différences dans le nombre de chloroplastes de GC entre les espèces végétales (Sakisaka, 1929) et le nombre relativement stable de chloroplastes dans le GCs dans l’épiderme foliaire du mûrier (Morus spp.,; Hamada et Baba, 1930) et dans les feuilles matures de plusieurs espèces de Brassica (Iura, 1934). De plus, l’analyse de plants de betteraves à sucre autopolyploïdes (Beta vulgaris) a révélé que le nombre de chloroplastes GC dans les feuilles est positivement corrélé avec le niveau de ploïdie nucléaire des plantes (Mochizuki et Sueoka, 1955). Des analyses plus approfondies et plus complètes ont ensuite été effectuées à l’aide de divers échantillons de plantes pour étudier la relation entre le nombre de chloroplastes et la taille des stomates avec le niveau de ploïdie (p. ex., Frandsen, 1968)., Dans ces analyses, le comptage des chloroplastes au niveau stomatal (paire de GC) a souvent été adopté, ce qui a exclu l’effet d’une distribution biaisée des chloroplastes entre GC appariés (p. ex., Mochizuki et Sueoka, 1955; Frandsen, 1968), révélant que le nombre moyen de chloroplastes de GC dans les feuilles ou les cotylédons chez environ 80 espèces, variants ou hybrides variait de 2,8 à 40,0 chez les diploïdes (2×) et de 5,0 à 73,5 chez les tétraploïdes (4×). En outre, les événements de duplication du génome entier chez les plantes (c.-à-d., 1× à 2×, 2× à 4×, etc.) a provoqué un environ 1.,Augmentation de 7 fois dans GC chloroplaste nombre avec une grande fidélité (revue dans Butterfass, 1973). Ces résultats ont encouragé des recherches sur le niveau de ploïdie dans divers tissus et plantes obtenus par culture tissulaire, croisement ou culture naturelle, en combinaison avec des traitements chimiques (p. ex. colchicine) ou des traitements de radiothérapie (p. ex. Jacobs et Yoder, 1989; Singsit et Veilleux, 1991; Qin et Rotino, 1995)., Bien que le nombre de chloroplastes GC ait été étudié en biologie stomatale (Lawson, 2009) et en cytologie pour comprendre la multiplication des chloroplastes (Butterfass, 1979; voir ci-dessous), il a largement servi de marqueur fiable et pratique pour la détection d’hybrides, d’espèces et de variantes et pour l’estimation des niveaux de ploïdie des tissus végétaux cibles.
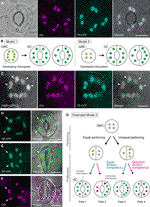
Figure 1 modèles simplifiés et preuves de microscopie pour le contrôle du nombre de chloroplastes dans les cellules de garde stomatale (GCs)., (A) une stomie typique (paire de GC) dans l’épiderme abaxial du limbe foliaire D’Arabidopsis exprimant une fusion ciblée par stomie du peptide de transit (TP) avec la protéine fluorescente cyan (CFP; TP-CFP). B) deux modèles de détermination du nombre de chloroplastes dans les GCs, impliquant soit le partitionnement des chloroplastes (modèle 1), soit la prolifération et le partitionnement des chloroplastes (modèle 2) au cours du développement du GC à partir de cellules mères de garde (GMCs). (C) une paire de GC dans l’épiderme adaxial du pétiole foliaire D’Arabidopsis exprimant TP-CFP et FtsZ1 fusionnés à la protéine fluorescente verte (GFP; FtsZ1-GFP)., (D-F) GC paires dans l’épiderme abaxial du limbe foliaire Arabidopsis avec (D, E) ou sans (F) l’expression de TP fusionné à la protéine fluorescente jaune (YFP; TP-YFP). F) L’autofluorescence De La Chlorophylle (Chl) a été utilisée comme marqueur chloroplastique., G) Modèle étendu 2, représentant l’implication d’un partage égal et inégal des chloroplastes après la division GMC et la division subséquente des chloroplastes GC avec compétence égale (ligne bleue) ou sélective (ligne rouge), ce qui entraînerait quatre types de détermination du nombre de chloroplastes (destins 1-4) au cours du développement stomatique tardif des feuilles D’Arabidopsis. (A, C–F) la microscopie à épifluorescence a été réalisée avec un microscope inversé Olympus IX71 en utilisant des matériaux végétaux comme décrit précédemment (Fujiwara et al. En 2017, Fujiwara et coll., 2018)., Les signaux de Fluorescence de chlorophylle, CFP, GFP et YFP sont pseudo-colorés en magenta, cyan, Vert (dans l’image fusionnée seulement) et vert, respectivement. Les Indications dans les panneaux sont les suivantes: pointe de flèche, l’anneau FtsZ1; Flèche, chloroplaste GC agrandi; ligne pointillée, forme de cellule. Barre d’échelle = 10 µm.
utilité des cellules de protection des feuilles pour L’analyse du contrôle du nombre de chloroplastes
Les cellules du mésophylle des feuilles ont longtemps été utilisées comme modèle primaire pour l’analyse du nombre de chloroplastes., Bien qu’ils présentent des avantages pour l’étude des effets des conditions environnementales sur la division des chloroplastes (p. ex., la signalisation de la cytokinine lumineuse; Boasson et Laetsch, 1969; Possingham et Lawrence, 1983; Okazaki et al., 2009; Chiang et coll., 2012), ils sont limités à certains égards. Premièrement, les cellules du mésophylle des feuilles varient en taille et en forme et sont réparties profondément dans la feuille, ce qui rend difficile la manipulation des tissus intacts., Deuxièmement, la sensibilité de la prolifération des chloroplastes du mésophylle foliaire au stress environnemental et aux conditions de croissance des plantes peut empêcher des comparaisons fiables entre les études. Le nombre de chloroplastes de mésophylle foliaire par cellule dans L’écotype Arabidopsis Columbia (Col) a été rapporté diversement comme 76 (Kinsman et Pyke, 1998), 80-100 (Stokes et al., 2000), 70 (Tirlapur et König, 2001), 41 (Yoder et coll., 2007), 40-60 (Okazaki et coll., 2009), et de 30 à 40 (Kawade et coll., 2013)., De plus, il est presque impossible d’évaluer la contribution du partitionnement des chloroplastes au nombre final de chloroplastes par cellule mésophylle au cours du développement foliaire, bien que cela soit déterminé par l’équilibre entre le taux de division cellulaire et le taux de division des chloroplastes. Pour découvrir le mécanisme de contrôle du nombre de chloroplastes dans les cellules foliaires végétatives, un système modèle qui surmonte les problèmes ci-dessus est nécessaire.
Les GCs stomatiques (voir Figure 1a) présentent les caractéristiques d’un système modèle pour comprendre le mécanisme de contrôle du nombre de chloroplastes., Les GCs sont de taille et de forme très uniformes dans un tissu, et leur distribution dispersée mais dense dans la couche la plus externe des pousses facilite leur détection par microscopie à lumière et à fluorescence. Les GCs sont également dérivés de cellules protodermiques du méristème apical de la pousse ou de cellules épidermiques embryonnaires, et leur séquence de développement à travers les méristémoïdes (un précurseur stomatique avec activité méristématique) et les cellules mères de garde (GMCs; un précurseur des paires de GC) est établie en détail (Zhao et Sack, 1999; Nadeau et Sack, 2002; Kalve et al., 2014)., Le développement stomatique tardif implique un seul cycle de division symétrique de GMC, ce qui permet d’évaluer la distribution et le partitionnement des chloroplastes avant et après la cytokinèse. Du point de vue des expériences pratiques, les Gc de feuille conviennent à la microscopie. Il a déjà été démontré que le nombre de chloroplastes par cellule dans le GCs foliaire de Sinapis alba était moins affecté par des conditions de lumière différentes que dans les cellules du mésophylle foliaire (Wild et Wolf, 1980)., De plus, la différence dans le nombre de chloroplastes de GC dans les pétioles des feuilles est relativement mineure parmi les trois écotypes D’Arabidopsis Col, Ler et Ws (Fujiwara et al., 2018). De plus, l’endoreduplication, qui a un impact sur le développement des cellules du mésophylle foliaire, du pavage et du trichome, n’a pas été détectée dans le GCs des feuilles D’Arabidopsis (Melaragno et al., 1993), qui assurerait l’interprétation des données sur le nombre de chloroplastes au niveau 2C des cellules., Ensemble, ces rapports suggèrent que les GCs foliaires sont potentiellement un excellent modèle pour l’analyse systématique de la dynamique du nombre de chloroplastes dans une lignée cellulaire particulière.
Arabidopsis Leaf Guard Cells as a Model for Studying the Control of Chloroplast Number
dans l’histoire de la recherche sur les chloroplastes par GC, le comptage des chloroplastes au niveau stomatique (paire de GC) a joué un rôle tout aussi important dans la détermination du nombre de chloroplastes qu’au niveau individuel du GC. Les deux méthodes produisent le même nombre moyen de chloroplastes (Butterfass, 1973)., Lorsque la variation de la distribution des chloroplastes dans les GCs appariés et son mécanisme sous-jacent font l’objet d’une attention particulière, des informations détaillées sur les chloroplastes au niveau cellulaire individuel, c’est-à-dire leur taille, leur forme et leur localisation intracellulaire, sont essentielles. La prolifération des chloroplastes (plastes) au cours de la différenciation GMC–GC a déjà été étudiée chez plusieurs espèces végétales (Butterfass, 1973, Butterfass, 1979)., Ces études ont proposé deux modèles pour déterminer le nombre de chloroplastes terminaux dans le GCs chez différentes espèces végétales (Figure 1b): l’un (modèle 1; betterave à sucre) implique seulement le partitionnement des chloroplastes à la division GMC, et l’autre implique non seulement le partitionnement des chloroplastes, mais aussi la prolifération des chloroplastes pendant le développement du GC.
à l’ère de la génétique moléculaire, de la génomique, de l’imagerie cellulaire et d’autres analyses interdisciplinaires, il existe de nombreuses possibilités pour caractériser davantage le mécanisme de partitionnement des chloroplastes., Arabidopsis leaf GCs peut être l’un des meilleurs systèmes modèles à cet effet. Plusieurs études ont examiné le nombre de chloroplastes GC dans les feuilles ou les cotylédons D’Arabidopsis (Hoffmann, 1968; Pyke et Leech, 1994; Pyke et al., 1994; Robertson et coll., 1995; Keech et coll., 2007; Chen et coll., 2009; Yu et coll., 2009; Higaki et coll., 2012; Fujiwara et coll., 2018). Ces GCs présentent un nombre modeste de chloroplastes, variant de 3,5 à 5,5 en moyenne. À ce jour, aucune étude n’a examiné les altérations du nombre de chloroplastes (plastes) au cours du développement stomatique., Cependant, des preuves microscopiques provenant d’analyses du développement stomatal (p. ex., Zhao et Sack, 1999; Hachez et al., 2011) et nos observations préliminaires indiquent que les GMC peuvent contenir un plus petit nombre de chloroplastes en développement que les GC et que la prolifération des chloroplastes peut se produire pendant la différenciation des GC. Pour tester cela, la formation de la machinerie de division des chloroplastes dans GCs a été surveillée avec la sonde FtsZ1 fusionnée à la protéine fluorescente verte (FtsZ1-GFP) (Fujiwara et al., 2008)., Une lignée transgénique, exprimant simultanément un peptide de transit (TP)-CFP fusionné et FTSZ1-GFP pour visualiser le stroma et le cycle FtsZ1, respectivement, a été examinée par microscopie à épifluorescence (Fujiwara et al., 2017). Des pétioles foliaires en expansion (cinquièmes feuilles de plantules de 4 semaines) ont été utilisés. En conséquence, des GCs avec des chloroplastes symétriquement constricteurs ont été détectés (Figure 1C). Ces chloroplastes ont formé le cycle FtsZ1, un cycle de division des chloroplastes sur la surface stromale de la membrane de l’enveloppe interne dans le mésophylle foliaire et les cellules de la chaussée (Vitha et al., 2001; Fujiwara et coll.,, 2008), sur le site de constriction équatoriale. Compatible avec la structure stomatique dans le développement des feuilles D’Arabidopsis (Donnelly et al., 1999; Andriankaja et coll., 2012), des chloroplastes diviseurs ont été détectés à la fin, ainsi qu’au début, de l’expansion foliaire. Ainsi, le modèle 2 est très probablement le meilleur ajustement pour Arabidopsis leaf GCs.
relation entre la prolifération et L’Expansion des chloroplastes dans les cellules de protection foliaire D’Arabidopsis
de plus, un phénotype inattendu de la morphogenèse des chloroplastes de GC a été observé chez les GCs Matures (Figures 1d, E)., Lorsque des pelures épidermiques de feuilles complètement expansées (troisième–quatrième limbes de plantules de 4 semaines) d’une lignée de protéines fluorescentes jaunes fusionnées (YFP) ont été caractérisées au microscope (lignée FL6-5; Fujiwara et al., 2018), certains stomates présentaient des patrons de distribution inégaux des chloroplastes dans les paires de GC, tandis que la plupart des stomates foliaires présentaient des patrons de distribution égaux ou similaires des chloroplastes (Robertson et al., 1995; Fujiwara et coll., 2018)., Dans la paire GC d’une stomie, la taille des chloroplastes dans la GC contenant un plus petit nombre de chloroplastes était plus grande que dans les autres GC dans la paire contenant un plus grand nombre de chloroplastes (Figures 1D, E). De cette façon, le GCs maintient probablement le volume total de chloroplastes par cellule à un niveau constant pendant la croissance cellulaire. Les chloroplastes élargis représentaient le phénotype terminal et ne pouvaient plus se diviser en feuilles élargies. Ces résultats ont été confirmés dans plusieurs expériences indépendantes, indépendamment de l’expression d’une protéine fluorescente TP-fondue pour le marquage du stroma (Figure 1F).,
ce phénotype de chloroplaste GC est interprété comme un mécanisme de compensation de l’expansion des chloroplastes, qui a été bien documenté dans les cellules du mésophylle foliaire défectueuses dans le contrôle de la division des chloroplastes (Pyke et Leech, 1994; Pyke et al., 1994). À ce jour, une seule étude (Ellis et Leech, 1985) a signalé une corrélation négative entre le nombre de chloroplastes et la taille des chloroplastes dans les cellules du mésophylle foliaire du blé, alors que de nombreuses études ont signalé une corrélation positive entre le volume cellulaire et le nombre de chloroplastes dans les cellules normales du mésophylle foliaire (Leech et Pyke, 1988; Pyke, 1997)., Considérant que les déséquilibres dans le nombre de chloroplastes de GC se produisent à basse fréquence (Fujiwara et al., 2018), l’hétérogénéité des chloroplastes dans les paires de GC indique qu’un partitionnement inégal des chloroplastes pourrait déclencher une croissance différentielle des chloroplastes entre les cellules foliaires de type sauvage chez Arabidopsis, malgré une division cellulaire symétrique.
l’effet de compensation des chloroplastes dans le GCs peut être moins strict que dans les cellules du mésophylle foliaire., Les GCs pourraient être capables de résister à la rareté ou à la perte complète du volume total de chloroplastes par cellule chez les mutants gravement altérés par la division des chloroplastes, comme chez Arabidopsis arc6 et atminE1 et tomato suffulta, alors que de nombreux GCs mutants ont montré un nombre réduit de chloroplastes et une taille de chloroplaste élargie de la même manière que les cellules du mésophylle foliaire (Robertson et al., 1995; Forth et Pyke, 2006; Chen et coll., 2009; Fujiwara et coll., 2018)., Chez un mutant de la division tardive des chloroplastes, arc5, la réduction du nombre de chloroplastes en GC n’a pas été associée à une augmentation significative de la taille des chloroplastes, contrairement aux cellules du mésophylle foliaire (Pyke et Leech, 1994). Un degré plus faible d’expansion des chloroplastes dans le GCs que dans les cellules mésophylliennes (Pyke et Leech, 1994; Barton et al., 2016), et la variation de l’expansion des chloroplastes entre les Gc, pourrait sous-tendre une gamme aussi large admissible de volume total de chloroplastes par GC., De plus, le moment de la division des chloroplastes au cours de la différenciation GMC–GC pourrait affecter de manière significative le phénotype terminal des chloroplastes GC. Bien qu’une caractérisation plus détaillée soit nécessaire pour résoudre ce problème, il semble plausible que les GCs des feuilles D’Arabidopsis représentent un système pour étudier les aspects inexploités du contrôle du nombre de chloroplastes dans les cellules végétales.,
un modèle de travail pour la détermination du nombre de chloroplastes dans les cellules de protection foliaire D’Arabidopsis
sur la base de ce qui précède, nous proposons un modèle de travail (un modèle étendu 2) pour l’analyse du nombre de chloroplastes dans GCs (Figure 1G). Le nombre final de chloroplastes par GC est déterminé par le partitionnement des chloroplastes à la division GMC et la prolifération des chloroplastes dans les GCs. Au cours de la division GMC, les chloroplastes peuvent subir une division égale ou inégale. Au cours de la prolifération des chloroplastes, les chloroplastes GC proliféreront avec une compétence de division égale (ligne bleue) ou sélective (ligne magenta)., Par exemple, si des chloroplastes également partitionnés possèdent une compétence de division équivalente, des nombres de chloroplastes égaux se produiront dans la paire GC (Fate 1). Si les chloroplastes inégalement partitionnés possèdent une compétence de division équivalente, les chloroplastes augmenteront au même rythme au sein de la paire GC (Fate 3). Si la division sélective des chloroplastes se produit dans GCs, l’équilibre du nombre de chloroplastes dans la paire GC changera après la division GMC (destins 2 et 4)., Il est actuellement difficile de trouver un soutien à la « division sélective des chloroplastes”, mais si les destins 1 et 4 prédominent réellement dans le GCs, ils pourraient posséder un mécanisme qui contrôle le volume total de chloroplastes par cellule, comme dans les cellules du mésophylle foliaire. Le modèle soulève deux questions: (i) les chloroplastes de GC sont-ils correctement partitionnés en cellules filles et comment se partitionnent-ils? Et (ii) la compétence de la division des chloroplastes du GC est-elle réglementée de manière coordonnée?,
en ce qui concerne la question (i), la question de savoir si l’hérédité des chloroplastes se produit par distribution aléatoire de plusieurs chloroplastes dans le cytoplasme ou par des mécanismes de partitionnement positifs des chloroplastes est une préoccupation de longue date(Butterfass, 1969; Birky, 1983; Hennis et Birky, 1984; Nebenführ, 2007; Sheahan et al., 2016). Curieusement, chez Arabidopsis arc6, les Gc foliaires ou cotylédoniques ont de zéro à trois chloroplastes, et chez les Gc déficients en chloroplastes, des plastides non photosynthétiques existent encore sous des formes vésiculaires à allongées (Robertson et al., 1995; Chen et coll., 2009; Fujiwara et coll., 2018)., Aucun GCs dépourvu de plastides en soi n’a été trouvé dans arc6, et aucune explication n’a été fournie, malgré la perturbation de l’appareil de division des chloroplastes (Vitha et al., 2003). Par conséquent, il sera important d’examiner la réplication et la morphologie des chloroplastes arc6 dans les études de lignées stomatiques. La recherche sur les mutants Arabidopsis peut également donner un autre indice pour cette question., L’observation que 18% des cotylédons GCs dans le mutant de la feuille froissée (crl) ne contiennent aucune structure plastidique dans le cytoplasme, tandis que 100% des cellules du mésophylle foliaire contiennent un à quatre chloroplastes élargis (Asano et al., 2004; Chen et coll. 2009), est d’une grande importance. CRL est une protéine de l’enveloppe extérieure du chloroplaste dont la fonction est inconnue. La compréhension de la fonction des protéines CRL peut fournir des informations sur le ou les mécanismes du partitionnement des chloroplastes., L’analyse de la prolifération et du cloisonnement des chloroplastes dans les cellules du mésophylle foliaire chez les mutants de L’Arc Arabidopsis et d’autres lignées transgéniques a favorisé la recherche sur la prolifération et le cloisonnement des plastes Non mésophylles. De même, les résultats obtenus dans GCs peuvent être transférables à d’autres systèmes cellulaires.
Remarque finale
le modèle de GC ouvre de nombreuses perspectives pour le développement de la biologie des chloroplastes. Par exemple, alors que les systèmes cytosquelettiques sont connus pour réguler la morphologie, le mouvement et le partitionnement des chloroplastes (Sheahan et al.,, 2016; Ama, 2016; Erickson et Schattat, 2018), le rôle de chaque gène régulateur dans la prolifération et le cloisonnement des chloroplastes chez les plantes a reçu peu d’attention. D’autre part, une fois qu’il devient possible d’altérer le nombre ou la morphologie des chloroplastes GC via diverses stratégies expérimentales, de nouvelles informations sur le contrôle moléculaire de la morphogenèse des chloroplastes dans les cellules de lignée stomatale peuvent être fournies. De plus, en conjonction avec des analyses quantitatives du nombre de chloroplastes au cours du développement stomatique, la modélisation mathématique pourrait offrir une nouvelle voie pour ces investigations., Cet article présente les connaissances actuelles sur la façon dont le nombre de chloroplastes GC est contrôlé et met en évidence l’utilité potentielle du GCs des feuilles D’Arabidopsis pour comprendre la prolifération et le partitionnement des chloroplastes.
déclaration de disponibilité des données
tous les ensembles de données de cette étude sont inclus dans l’article / matériel supplémentaire.
contributions des auteurs
MF a conçu l’étude et écrit le manuscrit. MF et AS ont mené les expériences. AS et RI ont effectué les analyses. Tous les auteurs ont lu et approuvé le manuscrit final.,
Financement
ce travail a été soutenu par le Ministère de l’éducation, de la Culture, des Sciences et de la technologie du Japon sous KAKENHI (subventions nos 19K05831 à MF et 18K06314 à RI).
conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Les auteurs remercient le Dr Nobuyuki Kanzawa (Université Sophia) pour ses conseils sur le travail.
Birky, C. W., Jr (1983)., The partitioning of cytoplasmic organelles at cell division. Int. Rév. Cytol. 15, 49-86.
Google Scholar
Butterfass, T. (1969). La distribution des plastes dans la Mitose des cellules mères à cellules fermées du trèfle haploïde (Trifolium hybridum L.). Planta 84, 230-234.doi: 10.1007/BF00388108
PubMed Abstract | CrossRef Full Text | Google Scholar
Butterfass, T. (1973). Control of plastid division by means of nuclear DNA amount. Protoplasme 76, 167-195. doi: 10.,1007/BF01280696
CrossRef Full Text | Google Scholar
Qin, X., Rotino, G. L. (1995). Chloroplast number in guard cells as ploidy indicator of in vitro-grown androgenic pepper plantlets. Plant Cell Tissue Organ Cult. 41, 145–149. doi: 10.1007/BF00051583
CrossRef Full Text | Google Scholar
Sachs, J. (1875). Textbook of Botany. Oxford: Clarendon Press.
Google Scholar
Thomas, M. R., Rose, R. J. (1983)., Plaste nombre et les plastes des changements structurels associés à tabac de protoplastes de mésophylle de la culture et de la régénération de la plante. Planta 158, 329-338. doi: 10.1007/BF00397335
PubMed Abstract / CrossRef Full Text / Google Scholar
Tirlapur, Royaume-Uni, König, K. (2001). Lasers proche infrarouge femtoseconde comme un nouvel outil pour l’imagerie time-lapse haute résolution en temps réel non invasive de la division chloroplaste dans les cellules de la gaine du faisceau vivant D’Arabidopsis. Planta 214, 1-10. doi: 10.,1007/s004250100597
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
Sauvage, A., Wolf, G. (1980). L’effet de différentes intensités lumineuses sur la fréquence et la taille des stomates, la taille des cellules, le nombre, la taille et la teneur en chlorophylle des chloroplastes dans le mésophylle et les cellules de garde pendant l’ontogenèse des feuilles primaires de Sinapis alba. Z. Pflanzenphysiol. Bd. 97, 325–342. doi: 10.1016/S0044-328X(80)80006-7
CrossRef Texte Intégral | Google Scholar
















Laisser un commentaire